随着医药科技的飞速发展,新药研发已成为推动医疗领域进步的重要引擎。在新药研发的过程中,靶点的选择至关重要,它不仅决定着药物的疗效,也预示着医药产业的未来发展方向。在热门药物靶点研究方面,目前竞争比较激烈、同质化严重。除了众所众知的PD-1,还有哪些热门靶点是国内创新药研发的重点呢?
本文基于药融咨询《2023年中国I类新药靶点白皮书》部分内容,通过对2018-2023年期间中国新药受理及涉及靶点相关数据进行深入分析,旨在揭示热门靶点的演变趋势、靶点研发的集中度变化、新兴靶点的崛起及其背后的驱动因素,为医药行业提供决策参考和洞见。
一、2018-2023年I类新药受理情况及靶点概况
据药融云数据库统计,在2018-2023年期间,受理的新药申请共计2858个,涉及靶点总计637个。相比2017-2022年,2018-2022年期间排名前三的热门靶点依旧为PD-L1、EGFR和PD-1。
2018-2023年I类新药涉及靶点TOP30(按总药品名称计)
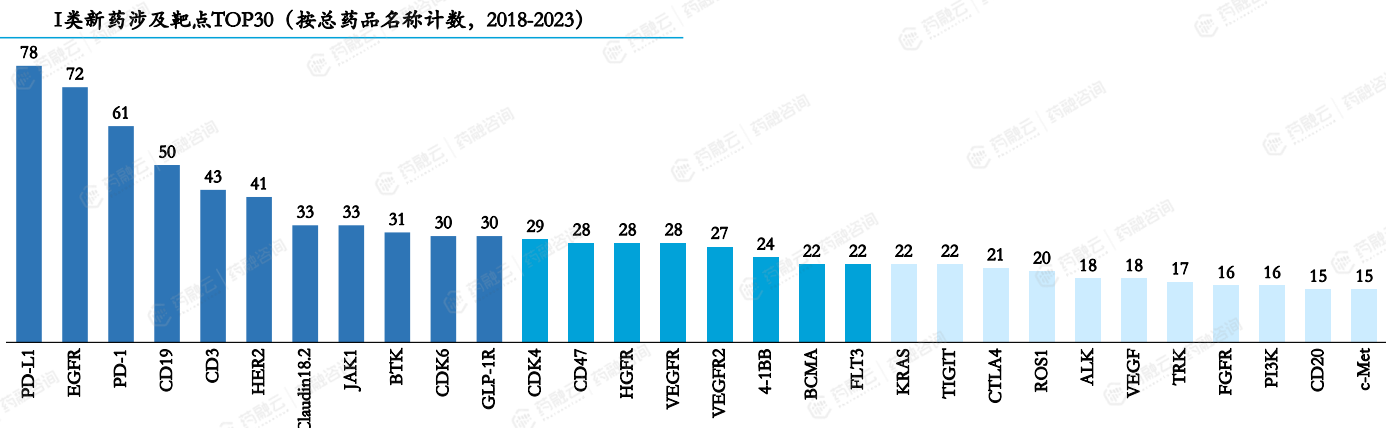
其中,CD19靶点的药品数量由38个(2017-2022期间)增长至50个,超越VEGFR和HER2成为热门靶点TOP4,成为血液肿瘤领域的一大亮点,尤其是CAR-T疗法的快速发展功不可没。
除CD19外,CD3、BTK、CDK6、GLP-1R、JAK1等靶点的研发热度有所提升,显示了在免疫治疗、血液病、代谢疾病及炎症疾病治疗领域的潜在突破。
2018-2023年期间,前5%的热门靶点涉及药物占所有受理新药的32%,相较于2017-2022年的靶点集中度(44%)有所下降,反映出研发领域正在逐步分散风险,探索更多潜在治疗领域。
2023年热门靶点TOP6
2023年的热门靶点TOP6为PD-1、EGFR、PD-L1、CD3、Claudin18.2、JAK1。
I类新药热门靶点变迁(按每年受理药品名称计数,2018-2023)
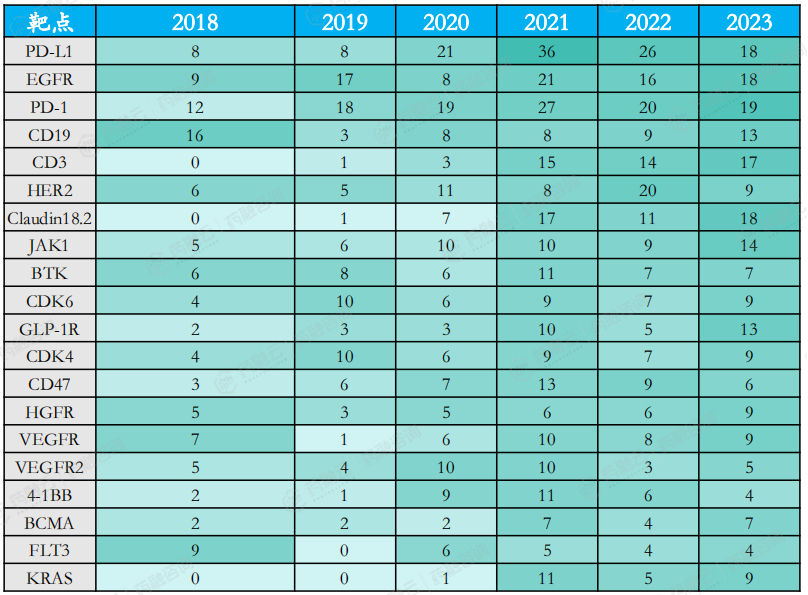
其中,PD-1的受理药品数量在2018-2021年期间持续增长,2022年开始逐渐走低。PD-L1的受理药品数量在2018-2021年期间不断上升,从2022年开始有所下降。
EGFR靶点在2021年热度较高,2022年热度有所降低,2023年较2022年稍有回升,但未达到2021年高度,相对2021年CAGR为-7.4%。
CD19靶点于2019年之后热度回升;HER2靶点2022年达热度高峰,2023年药品受理数量相对2022年下降超50%;CD3靶点近年热度高涨,2023年受理药品数量达17个。
2023年,GLP-1R、VEGF受理药品数量也显著增加,但PD-L1、HER2受理药品数量有所下降。
二、热门靶点分析
1. PD-L1
在2018-2023年期间,共计受理PD-L1药品78个。PD-L1药品研发阶段多数处于I期和II期临床研究阶段,I期和II期临床研究阶段药品数量分别占比约37.2%和34.6%,III临床及以上研发阶段药品占比约14.1%。
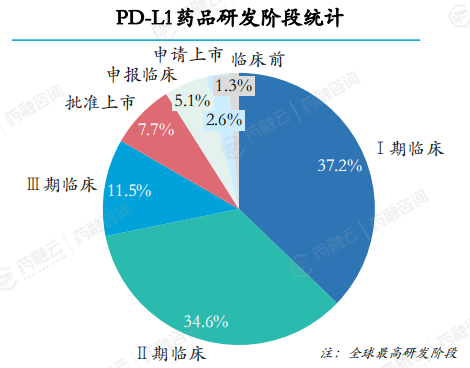
78个PD-L1药品的治疗领域均为肿瘤和免疫调节。在研发进展较快的药品中,适应症开发以(转移性)非小细胞肺癌和小细胞肺癌为主。
在2018-2023期间,批准上市的国产PD-L1药品有4款:李氏大药厂的索卡佐利单抗、盛迪医药的阿得贝利单抗、基石药业的舒格利单抗、思路迪医药/康宁杰瑞的恩沃利单抗。
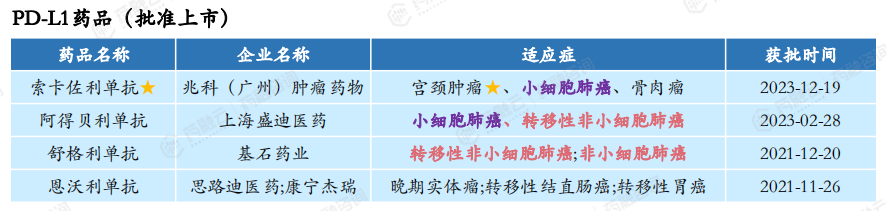
恩沃利单抗注射液(商品名:恩维达)是我国首个获批的国产PD-L1抑制剂,同时也是全球首个皮下注射PD-L1抑制剂。索卡佐利单抗于2021年被中国国家药监局药品审评中心(CDE)纳入突破性治疗品种。
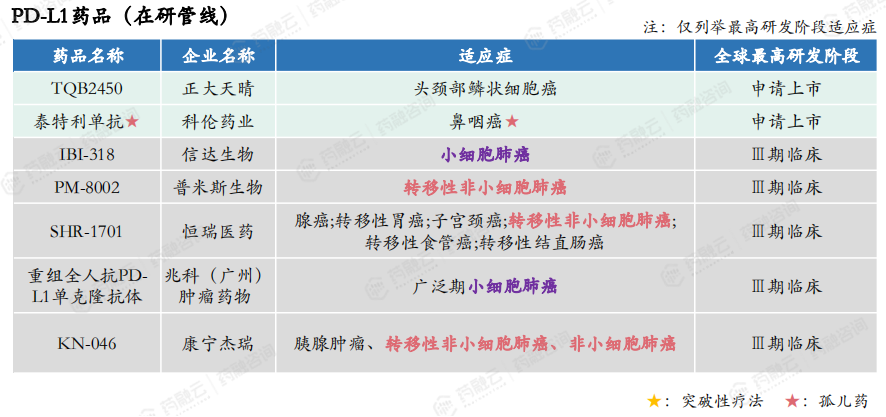
此外,在研的进度较快的PD-L1药品还有正大天晴的TQB2450 (最新数据显示,其已于2024年5月批准上市)、科伦药业的泰特利单抗、信达生物的IBI-318、普米斯生物的PM-8002、恒瑞医药的SHR-1701、李氏大药厂的重组全人抗PD-L1单克隆抗体、康宁杰瑞的KN-046等。
2. EGFR
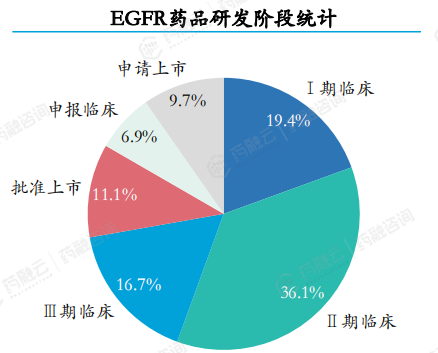
在2018-2023年期间,共计受理EGFR药品72个。EGFR药品研发阶段多数处于处于I期和II期临床研究阶段,I期和II期临床研究阶段药品数量共占比约55.5%,III临床及以上研发阶段药品共计19个,占比约26.4%。
72个EGFR药品的治疗领域均为肿瘤和免疫调节。在研发进展较快的药品中,适应症开发以(转移性)非小细胞肺癌为主。
在2018-2023年期间,批准上市的EGFR药品有4款:迪哲医药的舒沃替尼、贝达药业的贝福替尼、艾力斯的伏美替尼、豪森药业的奥美替尼/阿美替尼。
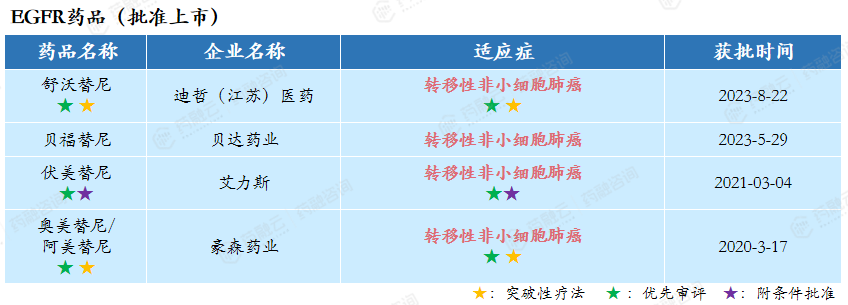
舒沃替尼是一款口服、不可逆、针对多种EGFR突变亚型的高选择性EGFR酪氨酸激酶抑制剂(TKI),用于既往经含铂化疗出现疾病进展,或不耐受含铂化疗,并且经检测确认存在表皮生长因子受体(EGFR)20号外显子插入突变的局部晚期或转移性非小细胞肺癌(NSCLC)患者。在中国被纳入优先审评和突破性治疗品种,并获得美国FDA授予突破性疗法认定。
此外,在研的进度较快的EGFR药品还有奥赛康的ASK-120067 、南京圣和药业的瑞厄替尼/奥瑞替尼/SH-1028、倍而达的瑞泽替尼、江苏晨泰医药的佐利替尼(Zorifertinib),均处于申请上市阶段(截至2023年12月,下同)。

3. PD-1
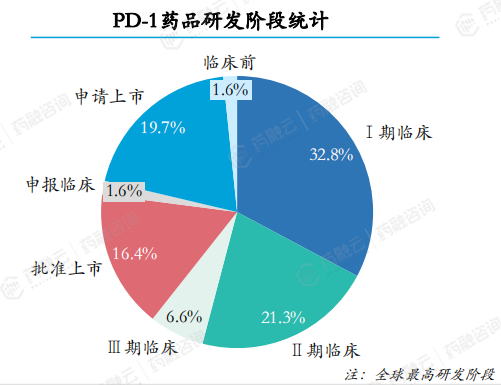
在2018-2023年期间,共计受理PD-1药品61个。PD-1药品研发阶段,I期临床和II期临床共占比约54.1%,III期临床及以上研发阶段药品共计16个,共占比约26.3%。
61个PD-1药品中有60个治疗领域为肿瘤和免疫调节,1个为抗感染。在批准上市药品中获批适应症多数为转移性非小细胞肺癌和霍奇金淋巴瘤。
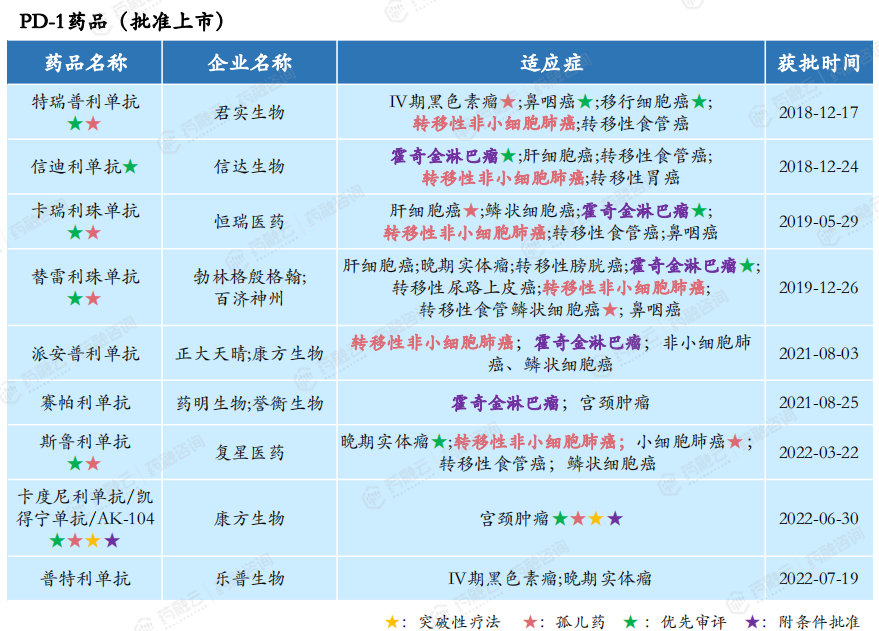
在2018-2023年期间,批准上市的PD-1药品有9款:君实生物的特瑞普利单抗、信达生物的信迪利单抗、恒瑞医药的卡瑞利珠单抗、勃林格殷格翰/百济神州的替雷利珠单抗、正大天晴/康方生物的派安普利单抗、药明生物/誉衡生物的赛帕利单抗、复星医药的斯鲁利单抗、康方生物的卡度尼利单抗/凯得宁单抗/AK-104、乐普生物的普特利单抗。
卡度尼利单抗,是康方生物自主研发的PD-1/CTLA-4双特异性抗体新药,是全球首款获批的基于PD-1的双特异性抗体药物,也是全球首款获批的PD-1/CTLA-4双特异性抗体。
卡度尼利单抗于2022年6月获国家药监局批准上市,是我国首个获批上市的用于晚期宫颈癌治疗的肿瘤免疫药物。针对复发或转移性宫颈癌适应症,已先后获得美国FDA授予快速通道资格和孤儿药资格,并被NMPA纳入突破性治疗品种名单和优先审评名单。
4. CD19
在2018-2023年期间,共计受理CD19药品50个。CD19药品研发阶段多数处于I期临床和II期临床研发阶段, I期和II期临床研究阶段药品数量共占比约82%,III期临床及以上研发阶段药品共计4个(8%)。
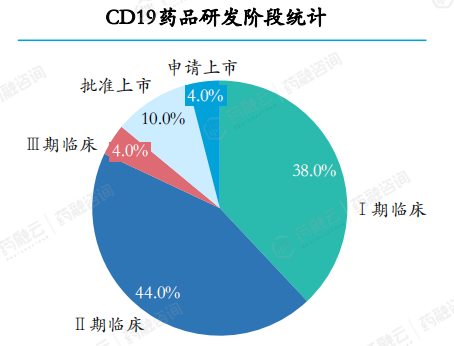
50个CD19药品的治疗领域均为肿瘤和免疫调节。已获批上市和在研的CD19药品大部分为CAR-T细胞治疗药物。在研发进展较快的药品中,适应症开发以淋巴瘤为主。
在2018-2023年期间,批准上市的CD19药品有3款:药明巨诺生物的瑞基奥仑赛/JWCAR029(CD19靶向嵌合抗原受体T细)、复星凯特生物的阿基仑赛、合源生物的赫基仑赛/纳基奥仑赛。
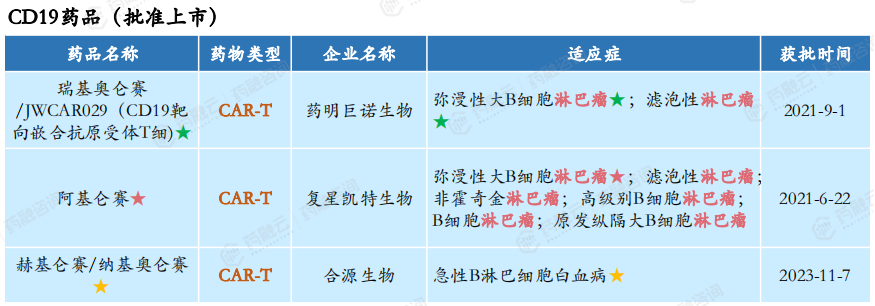
此外,在研的进度较快的CD19药品还有上海恒润达生的润达基奥仑赛、吉利德的Domvanalimab、上海泽纳仕生物的Obexelimab等。

5. CD3
在2018-2023年期间,共计受理CD3药品43个。国内CD3新药研发进度较为滞后,受理的43个CD3药品中最高研发阶段为II期临床,I期临床和II期临床阶段的药品数基本持平,分别占比44.2%和41.9%。
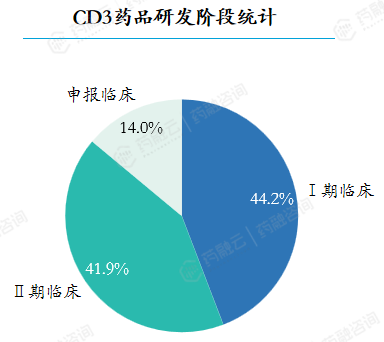
国内近年获批的CD3药品仅2款,罗氏的格菲妥单抗和Amgen Inc的贝林妥欧单抗,且均为国外进口药品。受理的43个CD3药品的治疗领域均为肿瘤和免疫调节。
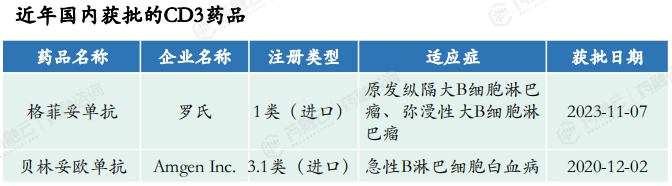
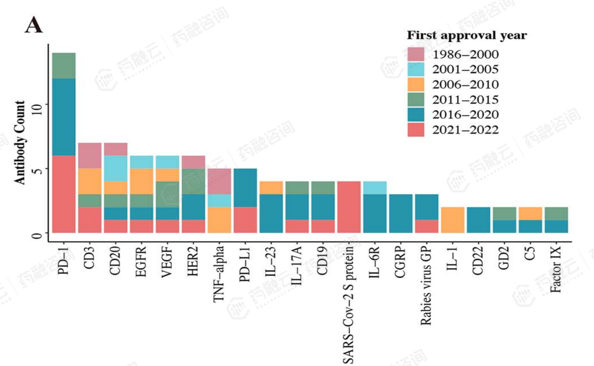
CD3分子是T细胞膜上的重要生物标志物,由于CD3与T细胞的激活密切相关,靶向CD3的抗体药物成为了癌症免疫治疗领域的一种新兴治疗方式,并且因其在血液瘤中的成功(Blinatumomab)而受到广泛关注。
有文献对历年来获批以及在临床/临床前开发阶段的抗体疗法的治疗靶点进行了统计分析。目前160多种已批准的抗体疗法中涉及90多个靶点,从统计结果来看,CD3靶点已被广泛研究,获批药物数量仅次于PD-1,在全球研发热度较高。
结语:
总的来说,2018至2023年间,新药靶点的演变轨迹揭示了医药研发的动态平衡:既有传统热门靶点的持续深耕,也有新兴靶点的快速崛起。热门靶点的变化反映了新药研发趋势的演变和市场的需求变化。随着研究的深入和技术的突破,未来新药研发将更加注重靶点的精准性、多样性和协同作用,为解决未满足的医疗需求提供更多的可能性。
拓展阅读:
1. 2023年研发新动向丨2018-2023年中国I类新药受理情况与靶点分析!
以上内容均来自{2023年中国I类新药靶点白皮书},如需查看或下载报告,可点击!
<END>
想要解锁更多药物研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!



















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论