一、CGT优势明显,政策完善加速新药研发
1. CGT分为细胞疗法和基因疗法
细胞基因疗法(Gene & Cell Therapy,简称 GCT/CGT)指将确定的遗传物质转移至患者的特定靶细胞内,通过基因添加、基因修正、基因沉默等方式修饰个体基因的表达或修复异常基因,达到治愈疾病目的的过程。
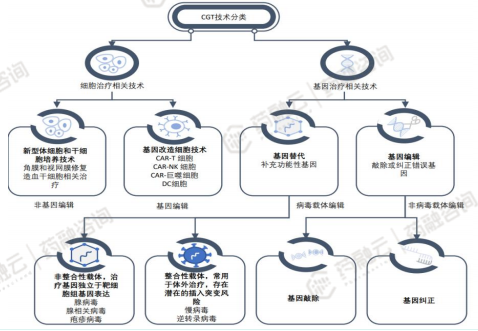
细胞疗法(体外治疗):干细胞疗法和细胞免疫疗法,后者又可分为过继细胞疗法(ACT)、肿瘤疫苗等。ACT包括嵌合抗原受体T细胞(CAR-T)疗法、T细胞受体嵌合型T细胞(TCR-T)疗法、嵌合抗原受体自然杀伤细胞(CAR-NK)疗法、肿瘤浸润淋巴细胞(TIL)疗法等。基因治疗(体内治疗):基因疗法(按照递送载体分为病毒载体和非病毒载体递送系统)、溶瘤病毒(OV)疗法、RNA干扰(siRNA,ASO)疗法。根据目的基因的作用机理可分为治疗型(例如核酸药物)和预防型(mRNA疫苗,DNA疫苗)以及预防和治疗兼顾型(个性化新抗原基因免疫)。
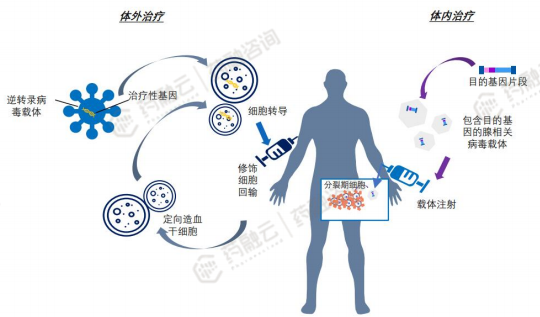
2. CGT优势分析:突破“难以成药” 束缚,研发成功率高
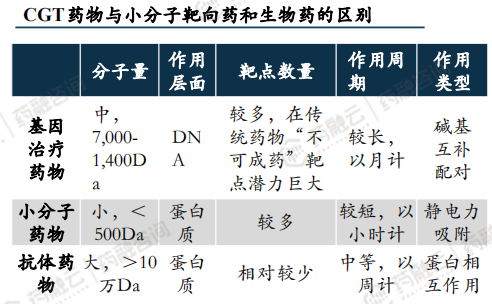
相比于小分子靶向药和生物药:CGT药物直接靶向DNA发挥作用,作用机制明确,打破蛋白质层面靶点难以成药魔咒,潜力巨大。根据 Nature Reviews Drug Discovery 披露,蛋白质编码基因仅占整个人类基因组的约1.5%,其中和疾病无关的蛋白质占其中的85%~90%。同时,在10%-15%与疾病相关的致病蛋白中,超过80%的蛋白质不能被目前常规的小分子药物以及生物大分子制剂所靶向,属于不可成药蛋白质靶点。


CGT药物作用机制明确,临床成功率高。
虽然CAR-T和RNAi复杂性增加了,但是药物作用的靶点更加清晰,作用机制更加明确,由此药物的LOA也大大提高。
根据美国生物技术创新组织机构(BIO)发布的2011-2020临床研发成功率数据, CAR-T疗法临床I期到获批上市的概率约17%,居于首位,其次是RNAi为13.5%,基因治疗概览为10%,低于单抗类药物12%,高于小分子药物7.5%。

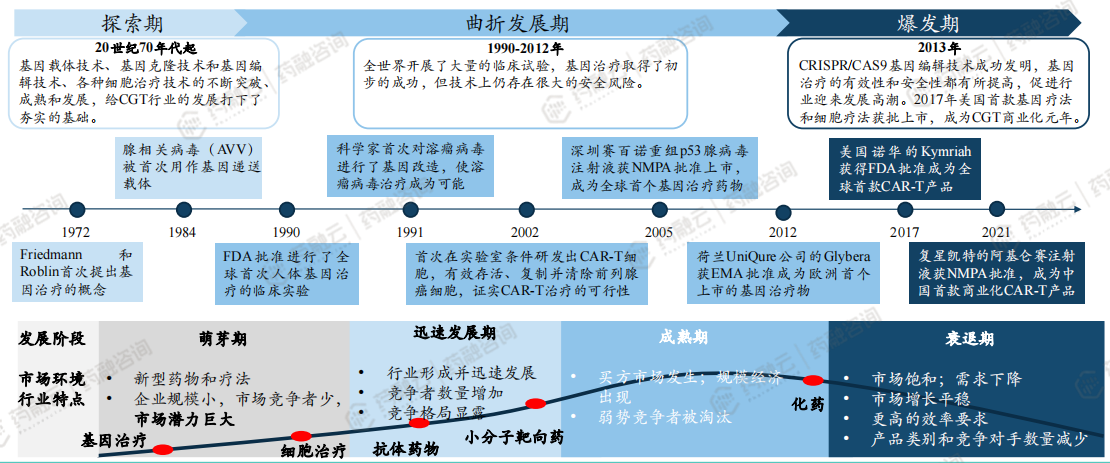
3. CGT发展历程
CGT经历50多年的发展,相比化药、靶向药,仍处于萌芽期。从CGT自身的发展历程来看,它经历了探索期、曲折发展期和爆发期,但是跟化药和大分子小分子靶向药相比,它仍处于萌芽期。
4. 中国CGT政策不断规范完善
我国CGT政策历经自由发展、调整、规范三个发展阶段:自由发展阶段监管政策法规相对滞后,内容相对简单,对CGT研究开发的多个环节所涉及的具体问题没有详细说明和规定,法规约束性不强,审批相对宽松。2016年“魏则西”事件敲响了CGT疗法安全性的警钟,中国开始加强生物安全、基因技术和生物医学等领域的立法。近年来对于细胞与基因治疗的规划来看,主要以加速新药研发、开展生物技术创新等支持性规划为主。监管体系和评价方法也在不断完善,以适应技术进步和产业发展的需求。

二、CGT药物研发和市场全景图谱
1. CGT文献关键词分析
(1)近5年文献CGT关键词共现网络
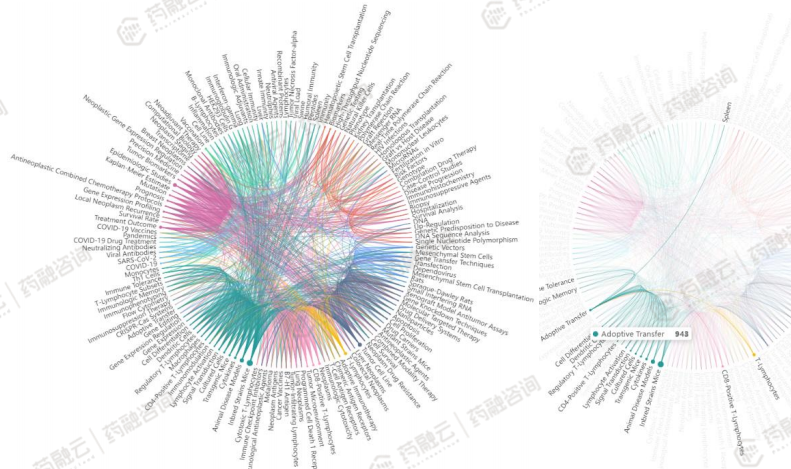
关键词反映了文献所要表现的各个主题之间的相互关系,是文章中心的核心概括。该网络中的节点代表关键词,节点的大小代表出现频次,连线粗细代表词间关系的紧密程度。
根据文献高频关键词之间的联系,可以划分为以下主要的聚类簇:
CAR-T(嵌合抗原受体T细胞免疫疗法)
iPSC细胞(诱导多能干细胞)疗法
siRNA:随着肝靶向递送系统的突破,siRNA成为资本和研发布局的宠儿,期望其他系统的靶向性取得进一步突破。
CRISPR-Cas9介导基因组编辑疗法:sgRNA指导Cas蛋白对靶基因进行敲除、插入和突变修饰,在遗传水平上控制疾病的发生,如癌症、肝脏疾病和心血管疾病等。
其他聚类簇如:T细胞受体嵌合型T细胞(TCR-T)疗法、嵌合抗原受体自然杀伤细胞(CAR-NK)疗法、肿瘤浸润淋巴细胞(TIL)疗法、溶瘤病毒等。
(2)文献CGT关键词研发热度变迁

注:关键词是文章中心的核心概括,节点的尺寸代表关键词的爆发程度,通过计算关键词在时间序列中的突发程度,可以洞察研究热点。
2010年以前研究出现爆发增长的词有腺病毒、分子序列数据等以基础实验性为主。随后寡核苷酸阵列分析、逆转录-聚合酶链反应技术(RT-PCR)、基因敲除迎来爆发,使得基因表达分析变的更加容易。
随着CRISPR技术的突破,精准医学从此开始发力,以嵌合抗原受体(CAR)技术为首的过继免疫疗法也实现了爆发增长,肿瘤免疫疗法如雨后春笋般出现。直至现在,细胞与基因治疗已成为肿瘤治疗领域的最重要方法之一。
(3)文献CGT关键词寻找研发新兴领域
根据关键词在时间序列中的位置及研究热度,将关键词分为四类:出现早且保持一定研究热度的经典领域;出现早但已经淡出视野的沉没领域;新出现但尚未爆发的萌芽领域;新出现且增长迅速的新兴领域。

CGT技术的新兴领域包括:基因编辑、嵌合抗原受体、CRISPR-Cas系统等。
2. 全球CGT药物研发全景分析
全球CGT在研管线中,基因治疗占半壁江山,适应症集中在肿瘤和罕见病。
据ASCGT(截至2023Q4)数据显示,全球3951项CGT临床试验中,2111项为基因治疗管线,占比为53%;878项为不涉及基因编辑的细胞治疗管线,占比为22%。

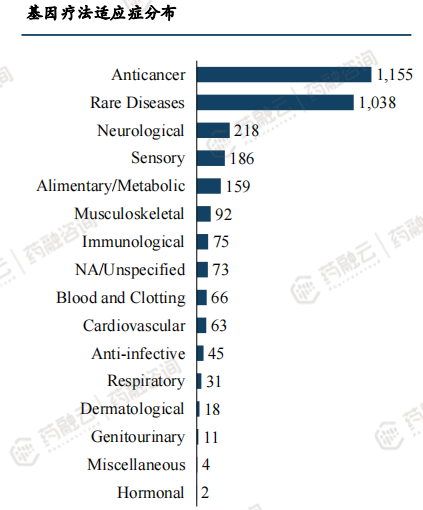
基因疗法管线阶段:主要为临床前管线,有1528项,占比75%。Ⅰ、Ⅱ期管线数量相当,均为13%。
基因疗法适应症分布:肿瘤和罕见疾病是首要领域,自2022年Q1以来,抗癌疗法超过罕见疾病疗法,成为临床最常见治疗类型。
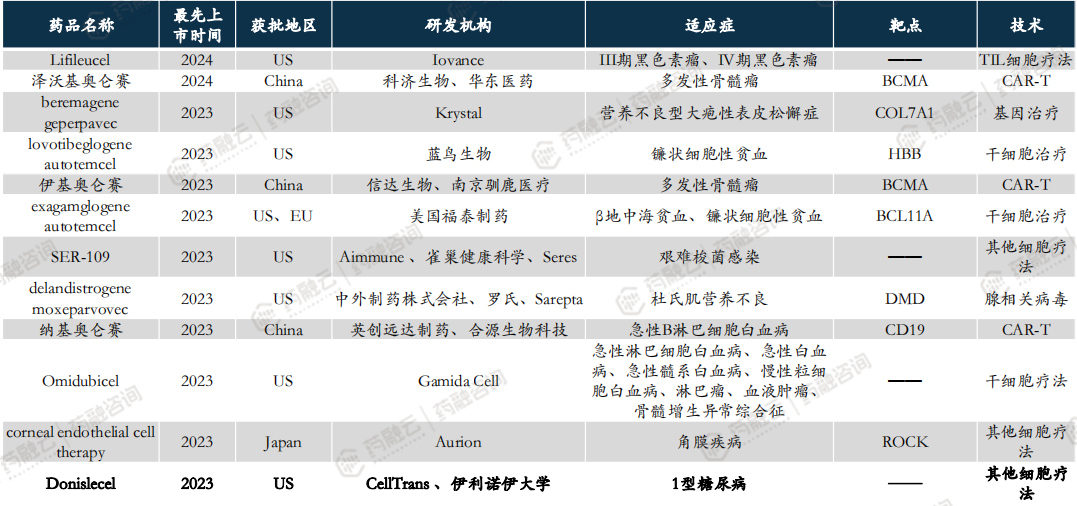
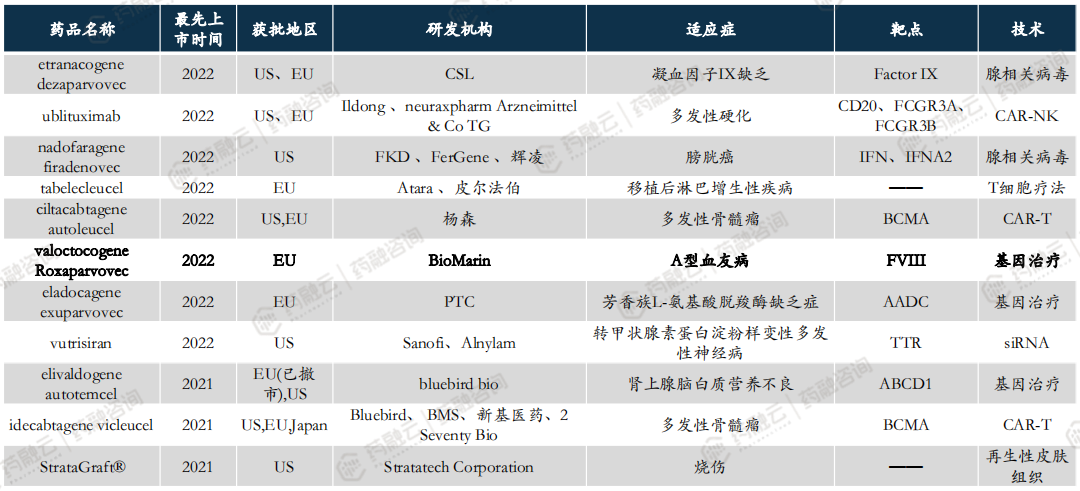
全球已有超70款CGT品种上市,2020年以来获批上市品种盘点。
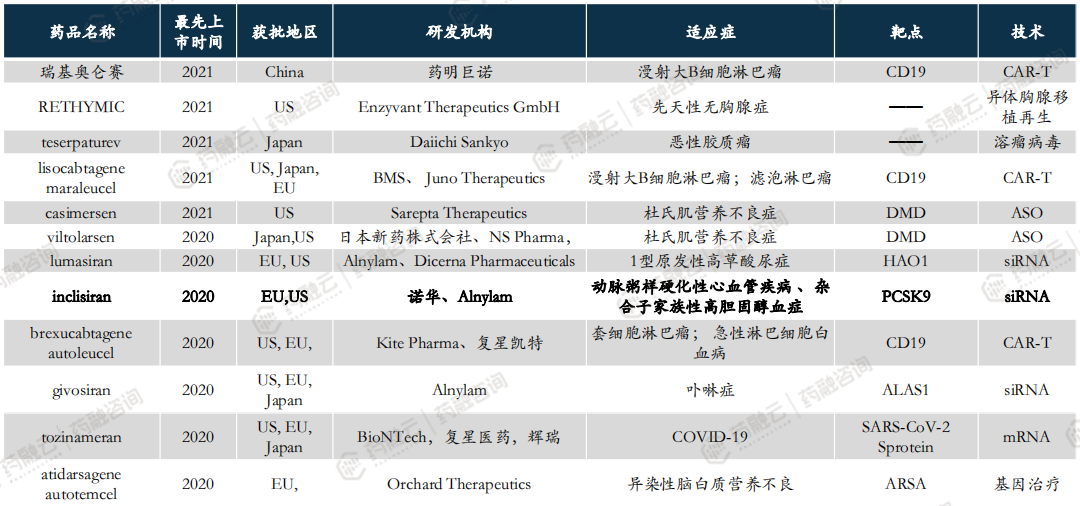
3. 中国CGT药物研发全景分析
中国CGT在研管线集中在CAR-T,靶点CD19居多,多数在I/II期临床阶段。
中国CGT在研管线647余项,除上市8款外,申请上市3项,Ⅰ期临床295项,Ⅱ期临床217项,Ⅲ期临床20项,申请临床54项。
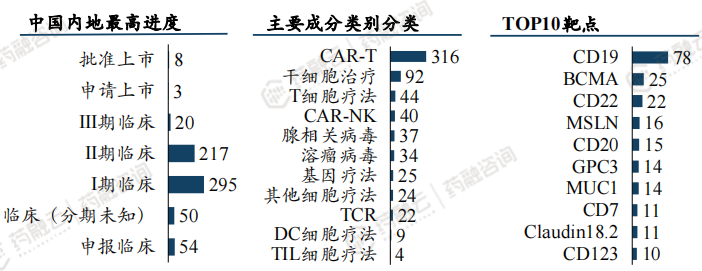
临床试验申办者排名靠前的为:深圳免疫基因治疗研究院、AbelZeta Inc、浙江大学、华夏英泰(北京)生物、上海优卡迪生物
应用技术最普遍的为:CAR-T、干细胞治疗、T细胞疗法等
研究最集中的靶点依次为:CD19、BCMA、CD22
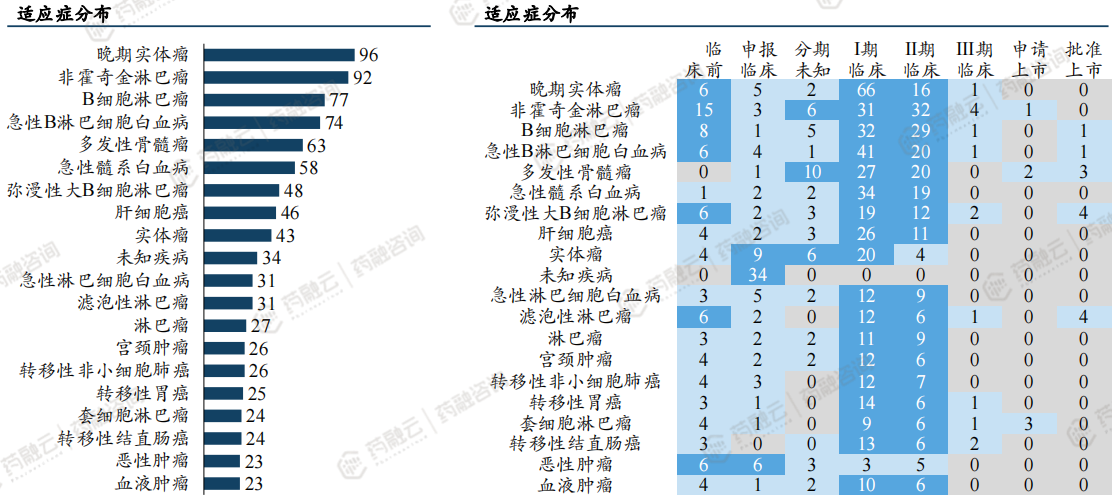
聚焦最多的适应症依次为:非霍奇金淋巴瘤、晚期实体瘤、急性B淋巴细胞白血病、多发性骨髓瘤、B细胞淋巴瘤

中国CGT在研管线各适应症及研发阶段热力图
CGT领域2024年“中国新”靶点TOP15
用全球药物研发IND及以上的靶点除去中国药物IND及以上的靶点,得到 “中国新”靶点。
靶点在全球范围内已经有药物处于IND及以上研发阶段,即在成药性上获得了一定的验证;排除国内在IND及以上药物涉及靶点,即国内还没有该靶点的药物处于IND及以上阶段。

CGT2024“中国新”TOP15 靶点主要在抗肿瘤领域,84%处于临床I/II期。
2023“中国新” TOP15靶点的药品中,抗肿瘤领域占比最大达51%,其次是神经系统占比15%,消化和代谢领域占比13%。
2023“中国新” TOP15靶点的药品中,绝大多数药品在国外仍然处于临床早中期,临床I期和临床II期共计占比84.2%,处于临床II阶段的药品占比最大,为54%。

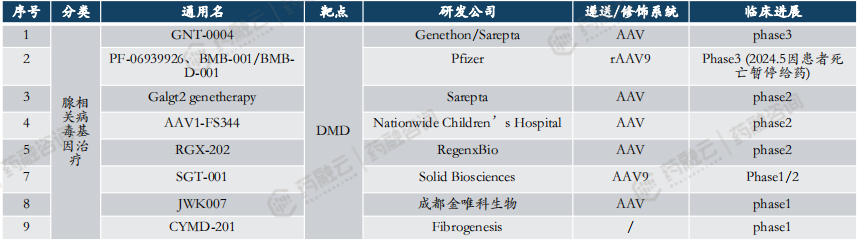
“中国新”靶点—DMD靶点针对罕见病杜氏肌营养不良症,FDA已批准首款药物上市。
DMD(杜氏肌营养不良症),是一种致命的、多发于男性的罕见遗传性精神肌肉疾病。主要病症是肌肉组织进行性地萎缩或变性,患者一般在3-5岁首次出现症状,包括肌肉炎症、纤维化、运动能力下降等,最终发展为呼吸/或心脏衰竭等,患者在20岁之前将失去独立行走能力,自然病史寿命通常不超过30岁。
从基因遗传层面来讲,DMD是严重的X染色体隐性单基因遗传病,主要病因是位于染色体Xp21.2上的DMD基因的变异。DMD基因片段较长导致其易发生突变(突变率约为1/10000),且突变方式复杂多样。当前在研管线的主要目的,是在患者的肌肉中恢复全长或接近全长的dystrophin,以恢复DMD患者心肌、骼肌、骨骼肌和在肌肉以外的神经系统缺少的dystrophin而引发的行动与认知障碍等症状。
2023年6月22日,Sarepta的Elevidys获FDA批准,用于治疗4至5岁DMD儿童患者,成为全球首款获批上市的杜氏肌营养不良AAV基因疗法。
“中国新”靶点— MAGE靶点与肿瘤密切相关,进展最快的药物已处于NDA阶段。
黑色素瘤相关抗原(Melanoma antigen,MAGE)家族分为两个亚类,即MAGE-I类和MAGE-II类。MAGE-I类抗原为肿瘤特异性抗原,属于癌睾丸抗原中的一个大家族,主要分布在生殖细胞和滋养细胞上,包括MAGE-A、B和C三个亚家族。MAGE-II类抗原,在人体正常的细胞中表达,成员有MAGE-D、E、F、G、H及L等亚科。其中,MAGE-As家族包括MAGE-A1~MAGE-A15共15个成员,人类许多其它组织来源的肿瘤都至少表达一种MAGE-A基因。因此,MAGE-A作为一种肿瘤特异性的抗原得到广泛关注,已成为多种肿瘤靶向免疫的重要靶点 。
MAGE-A4与肿瘤的发生、发展、转移及预后密切相关,其中Afamitresgene Autoleucel (Afami-cel, TCR-T细胞疗法)进展最快,其治疗晚期滑膜肉瘤的BLA正在美国接受优先审查,PDUFA日期为2024年8月4日。
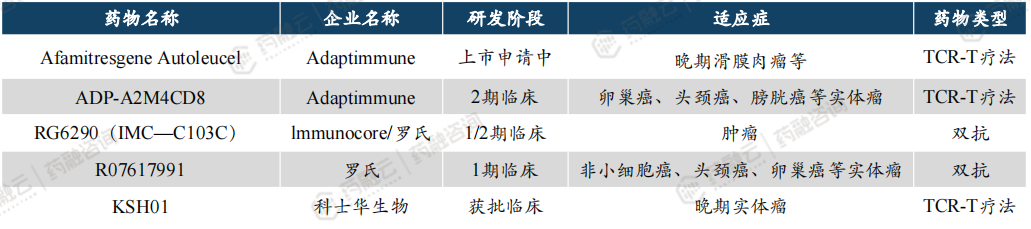
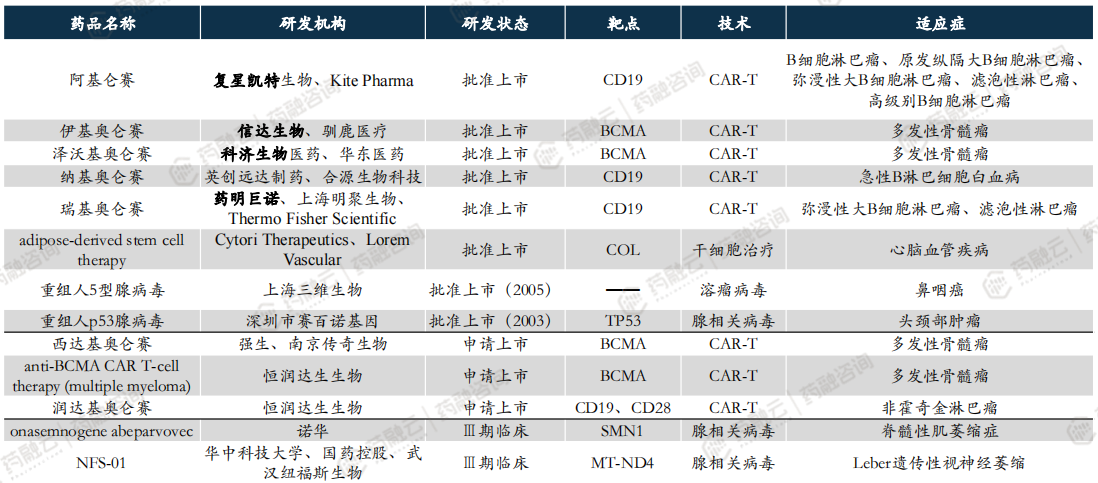
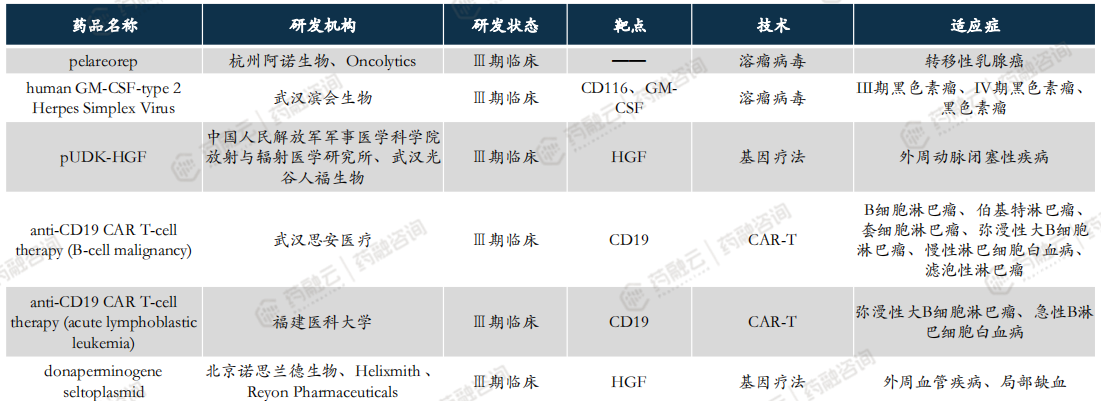
中国CGT临床三期以上产品已达30款,其中5款国产CAR-T获批上市。

4. 全球CGT专利分析
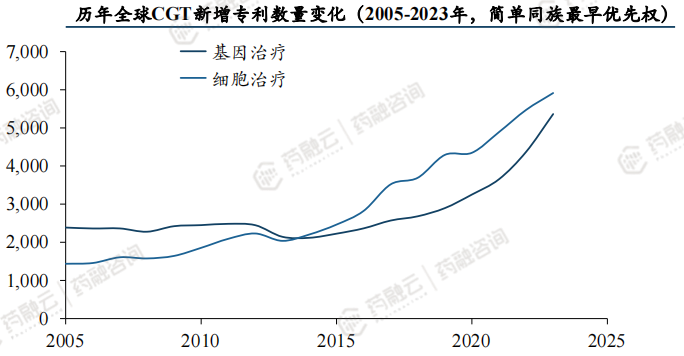
全球CGT专利数量自2013年以来迅猛增长,美国、中国居首。
全球CGT专利数量与CGT领域发展历程趋势一致,在2012年以前,呈现曲折发展的态势,2013年后迅猛增长。
从专利申请人所在国家来看,美国机构和企业布局的CGT相关专利数量最多,其次是中国和日本。
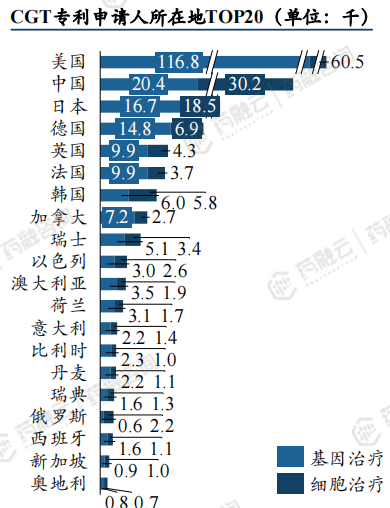
布局CGT相关专利数量靠前的公司为通用医疗、诺华、健泰科生物、 HGSI等。
全球布局基因疗法相关专利数量最多的公司分别为IONIS(ASO龙头)、人体基因组科学有限公司(Human Genome Sciences,HGSI)、Alnylam(siRNA龙头)、史密丝克莱恩比彻姆公司(隶属于GSK集团)、健泰科生物技术公司、通用医疗、诺华等。
全球布局细胞疗法相关专利数量最多的公司分别为通用医疗、詹森生物、英麦提克生物、诺华等等。

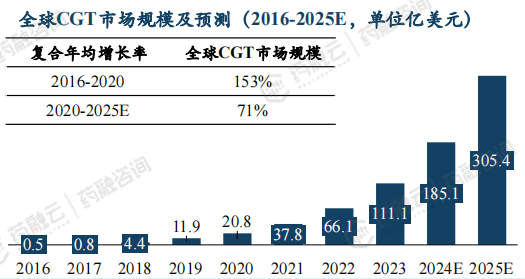
5. 全球及中国CGT药物市场规模预测
全球CGT市场规模预计2025年突破300亿美元。
2016-2020年,全球CGT市场规模年复合增长率达153.3%,2020年为20.75亿美元。预计到2025年,市场规模有望达到305.39亿美元。 中国市场起步较晚,且尚未纳入医保,患者自费较为昂贵,未来有望在支付端,供应端(更多产品获批上市),患者需求增多共同作用下销售市场得以打开。
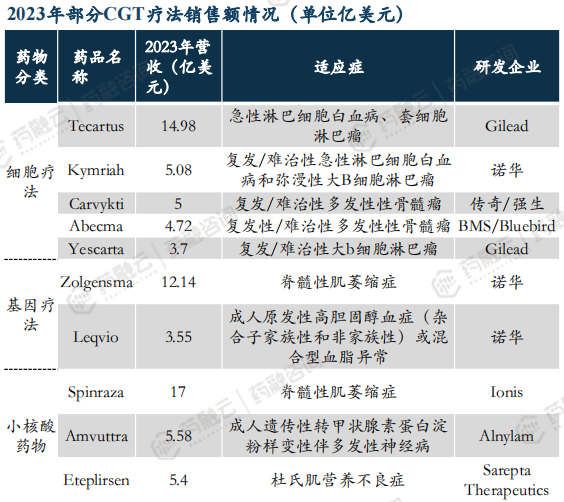
从2023年部分CGT疗法销售额情况来看,10款CGT疗法大卖77亿美元,Tecartus、Zolgensma、Spinraza均突破10亿美元。
6. CGT药物研发和生产寻求CRO/CDMO合作是大趋势
CGT工艺与成本是痛点,放大生产与CDMO合作是大趋势。
CGT由于复杂的技术机制、高门槛的工艺开发和大规模生产、严苛的法规监管要求、有限的产业化经验、差异化的适应症药物用量,相比传统制药更加依赖于研发和生产外包服务。

CGT工艺开发可分为质粒工艺、病毒工艺、细胞工艺三个较为独立的部分,各自难点不一,在质粒构建、菌库构建、递送系统设计、细胞系构建、细胞培养等环节,药企与CDMO企业间存在技术互补。当前CGT领域技术迭代速度快,企业前期投入较大且风险较高,选择CDMO服务不失为明智策略。
根据CRB报告,有限的GMP制造能力、前期过高的资本投入、缺少符合资质的人员、产能排期限制等挑战成为企业选择CDMO的主要考虑。

数据显示77%的CGT企业与CDMO公司有合作,其中20%选择将生产流程完全外包,57%选择兼有CDMO供应和自主制造,而仅有23%的企业完全自主制造。分自体疗法与异体疗法看,异体疗法公司选择CDMO的比例高于自体(73%vs71%),而若该企业同时拥有自体和异体疗法的业务则84%的企业将选择使用CDMO服务。可见海外CGT制造领域已拥有较高外包渗透率。
全球CGT CDMO 市场主要集中在Catalent、Lonza、Thermo Fisher、药明生基(药明康德子公司),前五大企业的市场份额合计接近81%,行业集中度较高。其中,药明生基在全球的市场份额约为6.7%,位列全球第四。国内CGT CDMO 企业主要包括和元生物、博腾生物、蓬勃生物(金斯瑞生物科技子公司)等。
CGT CDMO领域国内外的主要公司:
全球龙头:Catalent、Lonza、TMO、药明康德、Charles River、Oxford Biomedica、Esco集团、尼康细胞、日立化学、CELL for CURE
国内龙头:和元生物、金斯瑞生物科技、博腾股份、康龙化成
国内其他公司:谱新生物、赛诺生物、宜明细胞、源兴基因、五加和、派真生物、白泽生物、汉恒生物、云州生物、君厚生物等

三、CGT领域交易/投融资分析
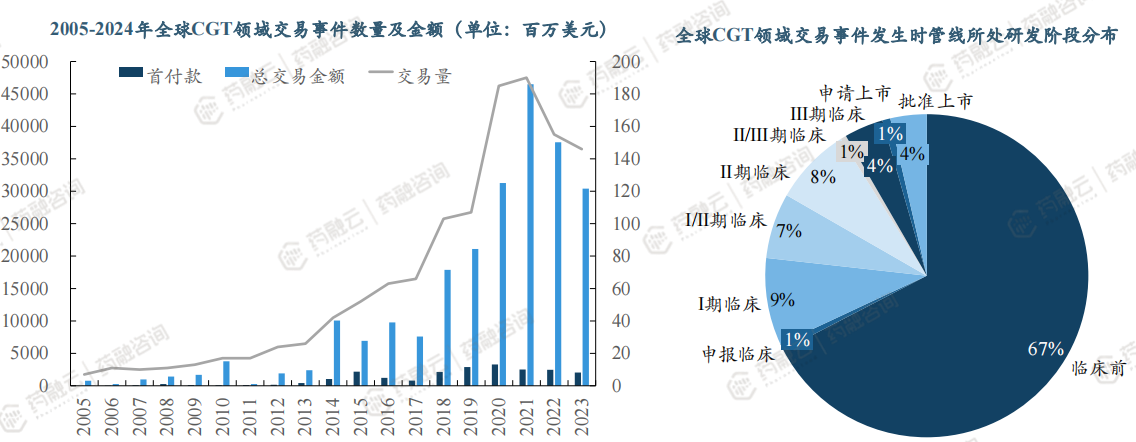
1. CGT领域交易2020-2022年活跃度较高,67%为临床前阶段
从全球CGT领域交易事件趋势来看,CGT领域交易事件在2020-2022年活跃度较高,交易事件量最高,涉及金额最大。
从交易时管线所处研发阶段来看,67%的管线临床前就发生交易,I/II期临床合计占比24%。
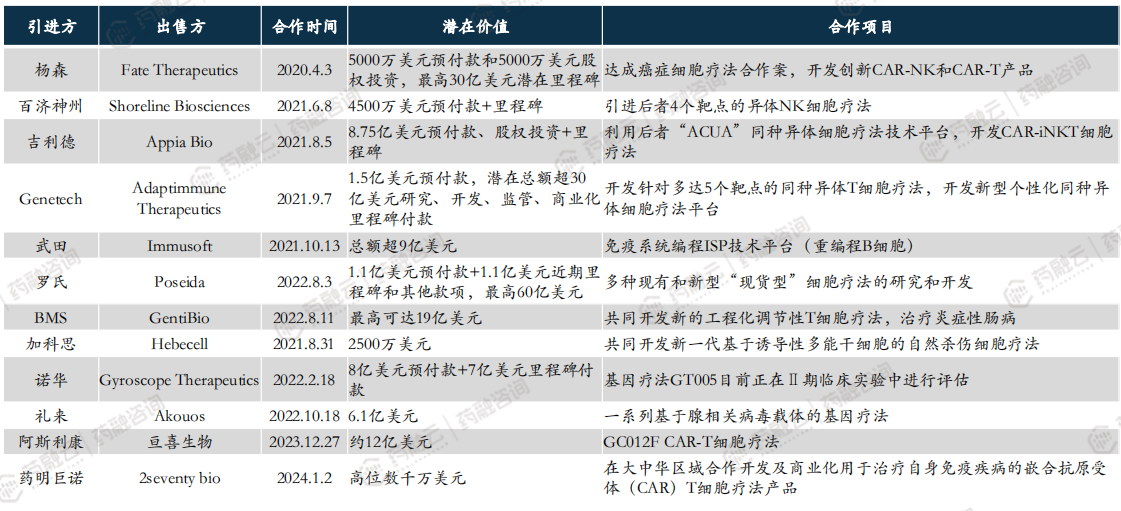
CGT领域部分重磅交易
2. CGT投融资集中在中美欧国家,且趋势一致
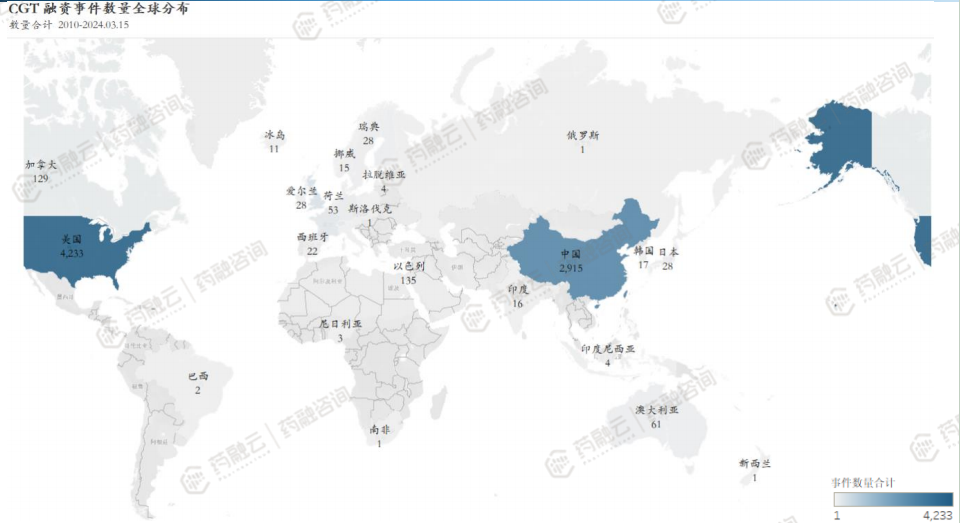
CGT领域投融资活动主要集中在中美欧国家。从全球CGT领域投融资事件分布情况来看,CGT领域融资活动参与企业主要集中在中、美及欧洲国家。
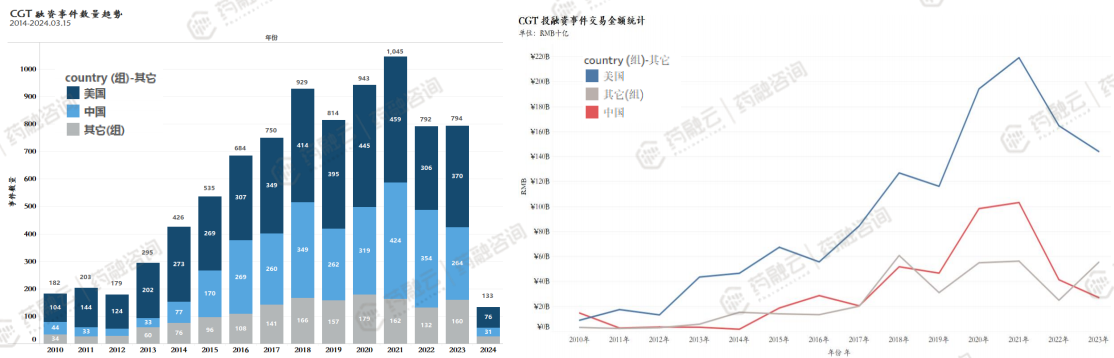
CGT领域近年投融资活跃度高,中美趋势一致。
从全球CGT领域投融资事件发生趋势来看,CGT领域融资活动在2020-2021年活跃度较高。其中,美国市场自2016年起每年融资事件均超过300起。
从已披露事件的金额统计来看,CGT全球市场趋势相似度比较高。
鉴于中国的市场交易数据披露程度较低(据药融云投融资数据显示中国未详细披露事件比例超60%,而美国未详细披露事件比例近10-15%),我们假设如果样本均匀,则可以将中国的曲线向上平移一倍,中美在该领域的投融资市场交易情况高度相似,这也反映了两国资本市场在该领域流动性较好。
美国CGT成熟期企业融资渠道畅通,中国仍以初创期阶段为主。
自2020年,美国早期项目融资比例在整体上收窄,可能原因如下,①市场上早期项目数量减少,②市场风险容忍度降低,投资行为偏向保守,③有交叉融合的其它行业领域对市场资金的虹吸。
美国成熟期融资比例逐年升高,表明CGT公司通过IPO等途径实现了较好的融资。
中国成熟期融资比例微乎其微,一方面中国有产品处于临床后期或已经获批上市的CGT研发公司数量还较少,另一方面也反应了国内对于IPO融资渠道的严格要求。

近年融资事件涉及技术主题变化,TCR-T、基因合成热度高。

四、CGT领域创新趋势
1. 应用领域从罕见病和血液瘤向实体瘤、传染病、慢性病扩大
CGT广阔适应症潜力正在不断被挖掘。随着技术的不断改进,CGT的安全性和有效性得到提升,已在多种遗传性罕见病和血液瘤,如血友病、脑白质营养不良、B细胞淋巴瘤的临床治疗中取得突破成果。
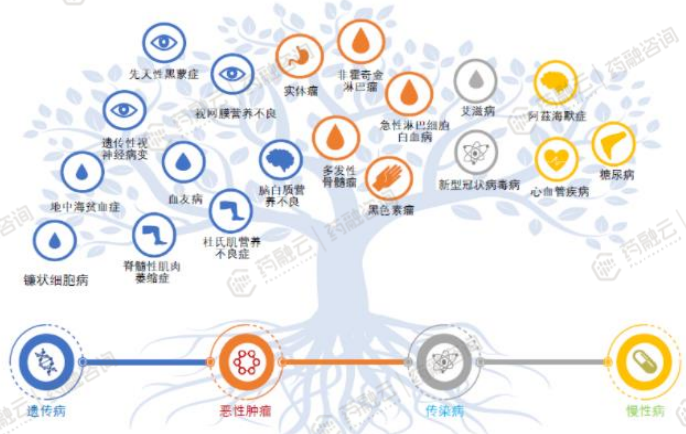
CGT临床试验应用领域逐渐扩大,对于糖尿病、心血管疾病等慢性疾病以及艾滋病等传染性疾病的应用探索也在增加。目前全球及中国在研的基因治疗临床试验大多集中在肿瘤和感染性疾病领域。
2. 细胞治疗向通用型、多靶点、联合疗法迈进
通用型CAR-T:通用CAR-T(UCAR-T)具有工业化批量生产、周期短、成本低等优势。能解决脱靶毒性、细胞因子风暴等安全性问题、制备工艺复杂、T细胞衰竭、适应症局限以及尤为突出的费用昂贵的问题。
多靶点CAR-T:能有效避免因抗原逃逸引起的肿瘤复发,改善细胞治疗效率。能克服单一靶点容易丢失、反应下降、异质细胞负面影响等问题。
免疫细胞联合疗法:免疫细胞(CAR-T、NK、巨噬细胞)+单抗/双抗能大幅提升抗癌效率;干细胞联合免疫疗法是将体外干细胞分化培养成CAR-T、NK、DC等免疫细胞,再回输病人体内。优势是可以实现大规模量产、降低成本,减少患者自体细胞提取生产的步骤。

3. 逐步降低的成本与创新支付齐头并进
CGT成本降低路径
(1)通用型CAR-T可将耗材总成本从6万美元降为2000美元,将QC费用从3万美元降为1000美元,从而将生产成本从定制CAR-T的95780美元降低至4460美元。
(2)干细胞联合免疫疗法也能实现大规模量产、降低成本。
(3)CRO/CDMO也能有效降低成本。
各国都在探索针对CGT创新支付体系
(1)美国已出台CAR-T疗法相关的支付政策,2021年提案将CAR-T细胞治疗产品纳入DRG打包支付,创建新的MS-DRG,利用DRG付费“结余留用,超额自负”的作用机制,有效控制CAR-T产品治疗费用,减轻患者负担。
(2)日本,CAR-T疗法的支付模式根据患者的年龄和临床收益,在医保支付的基础上,患者自付10%-30%,具体的支付数额可以降到41万日元左右。
(3)截至目前,国内已有5款CAR-T获批上市,福可苏(BCMA)价格高达116.6万元/针,靶向为CD19的奕凯达®、倍诺达®、源瑞达®价格分别高达120万元/针、129万元/针、99.9万元/针,都还未能进入医保目录,CAR-T疗法真正落实到患者仍任重道远。
(4)目前商业保险,如太平人寿、平安人寿、新华、众安等保险机构纷纷将CAR-T疗法纳入了保障范围,同时百万医疗可以报销CAR-T疗法药物,比如惠民保,也有百万医疗险、高端医疗险、特药险等。复星凯特和药明巨诺、信达生物/驯鹿生物都在医保之外另辟蹊径,积极尝试各种创新支付方式来解决支付难题,提高药物可及性。
以上内容均来自{CGT产业现状与未来趋势蓝皮书},如需查看或下载报告,可点击
<END>
想要解锁更多药物研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!



















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论