
“改良型新药”在2016年首次于法规中明确后,立即成为了行业研发热点,一路“狂飙”至今,其临床策略已然从一味想要BE/BA豁免确证性临床,追求改良“短频快”的昨天,迅速发展到力求通过临床试验证明产品安全性/有效性优势,追求“既有临床优势又有技术壁垒”的今天。为避免在终端市场端遭受原研和仿制产品的“双重打击”,一方面要通过合理的桥接研究节约研发成本、加快研发上市;另一方面又需要充分证明产品具备明确的临床优势。2.3类新复方制剂的立项通常立足于致病因素、不同的单药作用机制、以及真实世界联用的普遍性等方面,相较于其他改良形式,无疑更容易在临床试验中获得优于改良前单药的疗效结果,证明自身临床优势,因此,其研发正受到越来越多的关注。
本文综合了国内外相关法规、指导原则及文献对新复方开发的临床研究要求/建议,剖析了国内外相关案例,对2.3类改良型新药的临床研究策略进行了总结提炼。
一、新复方制剂开发的临床策略决策树
我国正在从制药大国向制药强国转变,近年来颁布了大量着力于鼓励创新的政策和法规,创新药企业迅速发展,仿制药企业也在积极转型。但创新药的开发投入高、风险大、周期长,改良型创新成为新药企业延长其产品生命周期的重要策略,也成为仿制药企业转型的重要契机。
在2016年《化学药品注册分类改革方案》明确改良型新药定义后,其研发申报迎来爆发式增长,但同时也暴露了大量产品临床优势不明显,同质化竞争严重的问题。在2020年《化学药品改良型新药临床试验技术指导原则》进一步对临床优势的要求进行了明确。以这两款关键法规的颁布为标志,其发展大致分为3个阶段,如图1所示。

图1国内改良型新药的发展
如上图所示,当前改良型新药的要求已逐渐明确,成功的改良型创新产品绝不仅仅是某一制剂技术或平台的必然转化产物,而是综合应用合成、制剂等药学研究手段,在临床研究/应用中证明了自身临床优势的产品。其中,2.3类改良型新药更多是将多靶点、多机制、已有临床联用经验的药物开发为复方制剂,因而更容易在临床试验中证明其安全/有效性等方面的优势,成为改良的热点方向之一。将已上市药物开发为新复方制剂的临床决策树如图2所示。

图2:新复方制剂临床开发决策树
如上图所示,在开发新的复方制剂时,如已有充分数据/临床经验证明两者联用合理/具备临床优势,并且给药剂量、适应症、患者等均与改良前的单药一致,同时与单药联用时BA/BE等效,则基本可桥接已上市单药的安全/有效性信息。否则需完成相应的剂量研究、安全性、有效性等研究内容[1]。
国内相关法规和指导原则中对复方制剂临床研究的要求与上述决策树相近,但进一步将新复方细分为:
①加载治疗:使用组成复方的任何一种(或多种)活性成份治疗效果不佳的患者。
②初始治疗:既往未曾使用复方中任何一种单药治疗的患者。
③替代治疗:复方制剂中单药剂量水平与可满意控制的患者同时服用的单方药物的剂量相同。
综合国内外法规、指导原则、文献,整理新复方制剂开发的临床研究策略如图3所示[2][3]:

图3:依据相关法规/指导原则的复方改良临床策略
如上图,在单方已有完整安全性/有效性数据,在临床中积累了丰富的联用经验,且剂量/适应症/患者等均与单药使用相同时,可考虑通过BA/BE试验桥接已有数据,可能不再需要开展复方制剂的确证性临床试验[4]。一般在新复方的开发中应进行充分的PK研究、药物相互作用(DDI研究),剂量-暴露-效应评估等研究,对给药剂量、给药间隔、组方配比等进行制定,以优选的组方、剂量和方案完成确证性临床试验[3][5]。
二、相关案例
1、替代治疗
FDA批准的Kombiglyze XR是按505(b)(2)路径获批的产品,其将沙格列汀和二甲双胍缓释片开发为了复方制剂。该产品的临床策略为:采用BA/BE研究桥接了单药的安全性/有效性数据,并豁免了确证性临床研究。其桥接路径如下图所示[6]:

图4:沙格列汀二甲双胍缓释片临床桥接策略
如上图所示,由于该产品在改良后的适应症、剂量、患者人群均未发生改变,为替代治疗的复方开发。其引用的关键数据包括:二甲双胍缓释片单药的开发中已证明了该缓释片和二甲双胍(速释)制剂的体内生物利用度一致,疗效等同;同时,在沙格列汀单药的开发中已证明了其与二甲双胍(速释)联用具有更优的疗效;因此,结合相关临床应用和数据证明了采用二甲双胍缓释片和沙格列汀片共同给药时,可以产生比单药治疗更优的临床效果。其完成的关键临床试验包括:通过Kombiglyze XR(复方沙格列汀二甲双胍缓释片)与沙格列汀片和二甲双胍缓释片两种单药同时服用的BE研究,结果显示,该复方制剂和单药联合给药时生物等效,最终桥接了单药的安全性/有效性结果、联用更优的效果,豁免了相应的确证性临床研究。
但需要注意的是,国内对2.3类复方制剂的立项和研究结果要求中,强调产品需要具备临床优势,通过BA/BE豁免确证性临床的情况通常发生在替代治疗的新复方制剂开发中,一般以提高依从性为开发目标,但是复方制剂还具有剂量调整不便、剂量倾泄风险等其他劣势,当不能论证改善依从性的必要性时,不被认为具备了临床优势。
2、加载治疗或初始治疗
由于单药间作用机制的相加、协同,不良反应的抵消等效果,可以通过2.3类新复方的开发获得更高有效性和/或安全性的临床优势。加载治疗和初始治疗通常以提高安全性和/或有效性为开发目标。其临床研究主要包括:充分的PK研究、DDI研究、探索性研究,并选择最优组方和剂量完成确证性临床试验。
FDA批准的AMTURNIDE是阿利吉仑、氨氯地平,以及盐酸氢氯噻嗪的三方复方制剂,上述三个药物均已作为单药上市,本品为新的复方改良制剂,其临床研究内容如图5所示[7]。
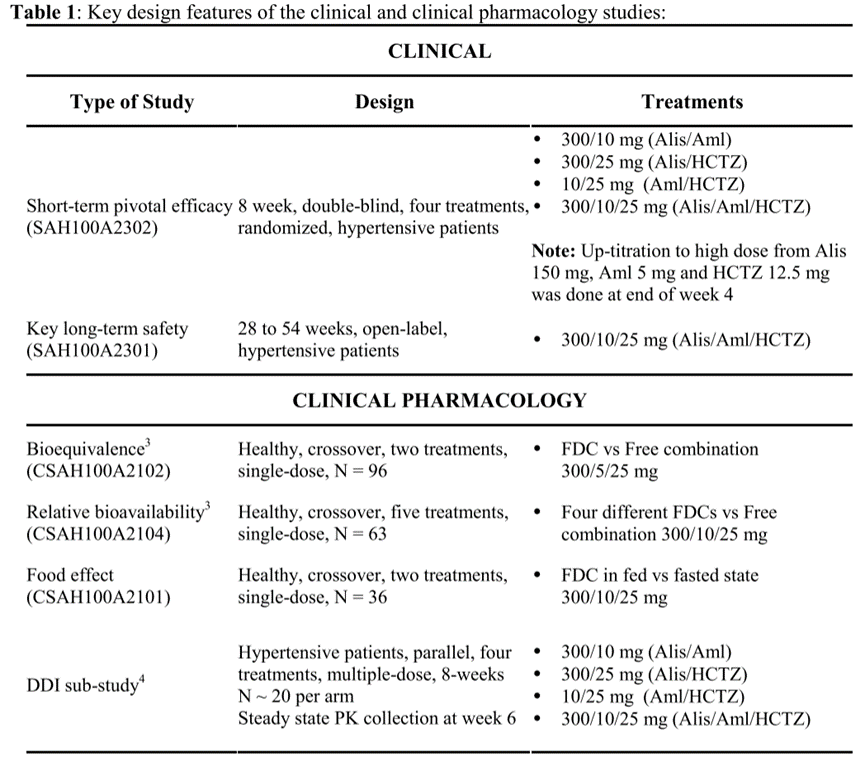
图5 AMTURNIDE的临床研究内容
如上图所示, BE对比(CSAH100A2102)结果显示,本复方制剂相较于三方联合给药,氨氯地平、盐酸氢氯噻嗪的PK行为未发生变化,阿利吉仑的暴露有所降低,但据量效关系分析,不会影响疗效;食物影响(CSAH100A2101)结果显示复方中氨氯地平、盐酸氢氯噻嗪不受食物影响,阿利吉仑的暴露在餐后下降,但据量效关系评估,不会影响疗效;BA研究(CSAH100A2104)对比了4种不同组方的复方制剂,优选了最佳组方和剂量。进一步采用探索出的最优处方和剂量完成了药物-药物相互作用研究(DDI研究)和确证性临床研究(SAH100A2302和SAH100A2301),结果显示三个药物间无显著的相互作用,效性研究和长期安全性研究符合预期,具有临床优势。
CDE批准的2.3类改良型复方制剂注射用头孢噻肟钠他唑巴坦钠的临床研究策略和内容与上述案例相似,在审评报告中显示,本品临床经历了:1)PK研究:考察了本品不同剂量的PK特征,AUC和Cmax具有线性药代动力学特征;分布体积、半衰期等特征均未发生改变;与单药相比,复方中孢噻肟和他唑巴坦的体内暴露无变化;2)药物相互作用研究结果显示两药间无显著相互影响;3)有效性和安全性研究结果显示疗效非劣于改良前药品,不良反应发生率低更低,最终基于上述研究结果,桥接了单药的其他安全/有效性数据而获批。
三、2.3类新复方开发的其他考虑
2.3类新复方药物的临床优势一般是指与单方用药相比,能提高疗效、降低不良反应,或改善依从性。其中,以改善依从性为目标的2.3类改良可能通过复方和改良前单方联用的BA/BE考察豁免确证性临床研究,但该类改良需论证依从性改良的必要性,如抗HIV的药品,当依从性达到90%时,病毒载量的有效率就可以达到80%以上,一次或少数几次漏服就可能导致有效率大幅下降[4],此时以改善依从性为目标的复方制剂开发被认为是具备临床优势的;当不能论证改良依从性的必要性时,如单纯以减少服药片数为目标的改良,则被认为是不具备临床优势的[2]。
以提高疗效或降低不良反应为目标的2.3类改良,通常基于疾病致病因素及发病机理、各单药的作用机制、以及联用的普遍性等方面进行评估立项[2],相较于将已知化合物分子开发为对应异构体、盐、新处方组成等其他的改良方式,更容易在临床试验中获得其优于改良前单方疗效的结果。通过对当前法规、指导原则和案例剖析可知,一般情况下2.3类新复方的改良需进行合理性论证、充分的PK研究、药物相互作用研究、剂量-暴露-效应分析,进一步对优选的组方、剂量进行安全性和有效性研究。此外,还应根据药物和疾病特征、治疗窗、患者特征、初步的PK研究结果,以及审评机构的意见等实际情况,考虑豁免或增加相关的研究内容。
参考文献:
1. Freije I, Lamouche S, Tanguay M. Review of drugs approved via the 505(b)(2) pathway: Uncovering drug development trends and regulatory requirements. Therapeutic Innovation & Regulatory Science. 2020;54(1): 128-138.
2.CDE.化药复方药物临床试验技术指导原则.https://www.cde.org.cn/main/news/viewInfoCommon/5c6a7a70f5c5b32319ee4143ce61211
3. CDE.化学药改良型新药临床药理学研究技术指导原则(试行). https://www.cde.org.cn/main/news/viewInfoCommon/25f498093f32286f0f31dbc4d1c8bb43
4. 钱思源,康彩练.关于复方药物开发的临床考虑[J].药物管理与评价,2015,13,(31):1335-1337.
5. 韩鸿璨,刘冬,等. 复方药物研发中临床药理学研究的一般考虑[J].药物管理与评价,2017,24(37):3389-3391.
6. FDA. Kombiglyze XR. CLINICAL PHARMACOLOGY AND BIOPHARMACEUTICS REVIEW(S)https://www.accessdata.fda.gov/drugsatfda_docs/nda/2010/200678Orig1s000ClinPharmR.pdf.
7. FDA. AMTURNIDE. CLINICAL PHARMACOLOGY AND BIOPHARMACEUTICS REVIEW(S). https://www.accessdata.fda.gov/drugsatfda_docs/nda/2010/200045Orig1s000ClinPharmR.pdf.
<END>
想要解锁更多药物研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!











































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论