
近日,外媒drughunter发布2023年度小分子榜单TOP10,入选分子主要根据其技术创新、科学贡献、潜在临床价值以及独创性等因素所评估。2023年明星小分子TOP10包括:

默沙东MK-0616
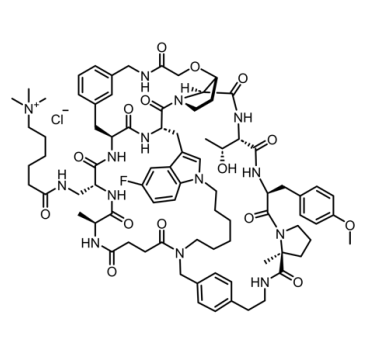
单从这些结构特征来看,就可以看出MK-0616不是一个出身草莽的简单分子。光是它三元环的特征就足够令人侧目了。三元环多肽并非极度罕见,但大多数都是通过二硫键产生的三元环肽,例如Linaclotide,但像MK-0616这样通过三唑、烯键和硫醚结构形成三元环的多肽绝非“凡肽”。不要说合成,就是使用ChemDraw软件绘制其化学结构,想要完美地“合龙”三环也是需要费一番周章的。
MK-0616在每日一次的人体临床试验(<300 mg QD)中,显示出降低PCSK9和LDL胆固醇的生物活性。目前,PCSK9靶向疗法只能通过注射实现,而使用生物制剂降低胆固醇的成本效益一直未能有效解决。口服PCSK9抑制剂是这一领域的目标,MK-0616大环肽的开发有望实现这一领域的突破。
目前,MK-0616已进入3期临床研究阶段。去年年底,默沙东在中国启动了MK-0616的两项国际多中心3期临床研究,针对适应症包括动脉粥样硬化、高胆固醇血症。
Kymera Therapeutics KT-474
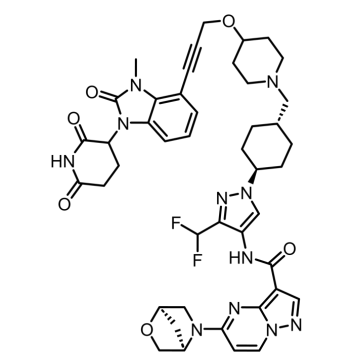
KT-474(SAR444656)是由Kymera Therapeutics开发的一款潜在“first-in-class”的IRAK4靶向蛋白降解剂。它通过与IRAK4结合,募集E3泛素连接酶给IRAK4打上泛素的“标签”。这些“标签”会指引IRAK4蛋白被细胞的蛋白酶体降解,从而阻断IRAK4介导的信号传导。
2020年7月,赛诺菲与Kymera Therapeutics达成多项目战略合作,联合开发和商业化IRAK4靶向蛋白降解疗法。
2023年11月,Kymera Therapeutics宣布IRAK4降解剂KT-474(SAR444656)的1期临床试验取得积极结果:KT-474对缓解化脓性汗腺炎(HS)和特应性皮炎(AD)患者的疾病负担和症状产生了积极的作用,且在中度至重度疾病患者中观察到了全身抗炎作用。
目前,KT-474治疗AD和HS的临床试验已进入2期阶段。
礼来orforglipron
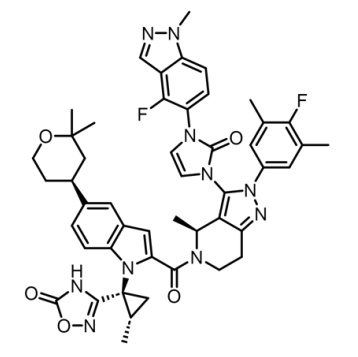
礼来的Orforglipron是一种GLP-1RA部分激动剂,能高效、有选择性地结合其他B型G蛋白偶联受体(GPCRs),从而达到有利于口服给药的药代动力学特征。该药半衰期为29~49小时,支持每日一次服药。而且,Orforglipron服用时不限制食物、水或其他药物,可在餐前或餐后服用。
2023年美国糖尿病协会(ADA)大会上公布的Orforglipron的两项2期临床试验数据显示:Orforglipron无论是降糖还是减重效果,都明显超过注射的度拉糖肽。
Vertex VX-548
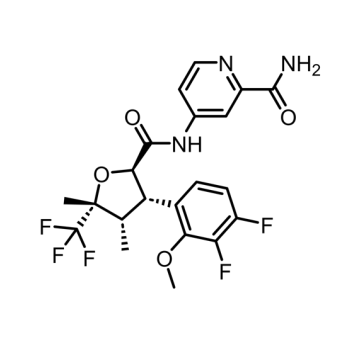
VX-548是一种口服选择性NaV1.8抑制剂,与其它NaV离子通道相比,它对NaV1.8具有高度选择性。NaV1.8是一种电压门控钠离子通道,在周围神经系统的疼痛信号传导中发挥着关键作用。VX-548作用于周围神经,能够避免阿片类药物的成瘾性,缓解中度至重度手术后疼痛。急性疼痛被定义为持续 <3 个月的疼痛,是一种致残性疾病,影响着超过8000万人。
2024年1月公司宣布VX-548在III期试验中成功达到了多个终点。III期试验包括包括两项随机、双盲、安慰剂对照的关键试验,一项是腹部整形手术后的试验,一项是拇囊炎切除手术后的试验,以及一项单臂安全性和有效性研究。VX-548 在所有三项 3 期研究中都是安全且耐受性良好的。
Madrigal Pharmaceuticals Resmetirom

Resmetirom是一种每日一次、口服、甲状腺激素β受体(THR-β)选择性激动剂,旨在靶向NASH的关键基础病因。甲状腺激素通过激活肝细胞中的β受体,在肝功能中发挥核心作用,影响从血清胆固醇和甘油三酯水平,到肝脏中脂肪病理性积聚等一系列健康参数。Resmetirom能够避免激活介导肝脏外(包括心脏和骨骼)甲状腺激素活性的THR-α受体,并在肝脏部位被特异性摄取。既往的研究也证实Resmetirom的安全性,对THR-α受体无活性,对骨骼或心脏参数无影响,同时不影响甲状腺激素通路的其它激素。
Resmetirom是FDA批准的首个NASH创新疗法,也是Madrigal Pharmaceuticals首个获批药物,Evercore ISI分析师预估其2030年全球销售额可能达到26亿美元,销售额峰值可能高达55亿美元。
辉瑞 Ritlecitinib
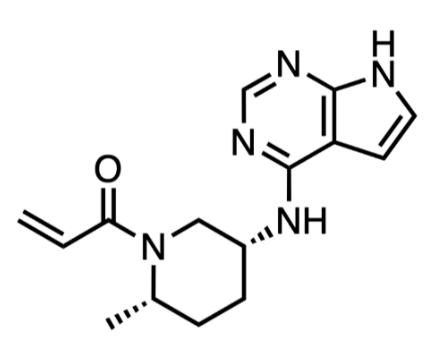
Ritlecitinib是一种口服高度选择性JAK3/TEC抑制剂,能够抑制IL-15和CD8细胞因子信号传导。IL-15与CD8+T细胞表面的受体结合,通过JAK1和JAK3进行信号传导,促进IFN-γ的产生并形成正反馈循环。
2023 年 6月23日, FDA批准辉瑞的JAK3抑制剂Ritlecitinib(利特昔替尼胶囊)上市,用于治疗12岁及以上青少年和成人斑秃。这次批准使其成为治疗斑秃成人和青少年的首创新药。
Ritlecitinib是第二个治疗斑秃药物,与第一个Olumiant不同的是,Litfulo利特昔替尼不仅获批用于成年患者,也获批用于12岁及以上的青少年患者。
Relay Therapeutics RLY-4008
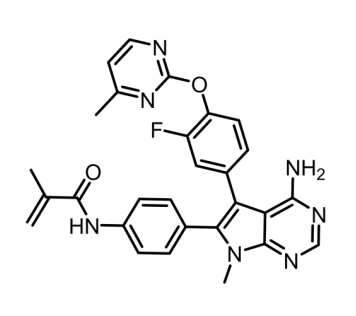
RLY-4008是Relay Therapeutics公司的一种口服生物可利用的成纤维细胞生长因子受体2 (FGFR2) 抑制剂,具有潜在的抗肿瘤活性。口服给药后,lirafugratinib结合并抑制 FGFR2,从而切断FGFR2介导的信号转导途径。这个过程阻断了FGFR2过表达肿瘤细胞的增殖。FGFR2是一种在许多肿瘤细胞类型中上调的受体酪氨酸激酶,在细胞增殖、迁移和存活中发挥着关键作用。
Revolution Medicines RMC-6291
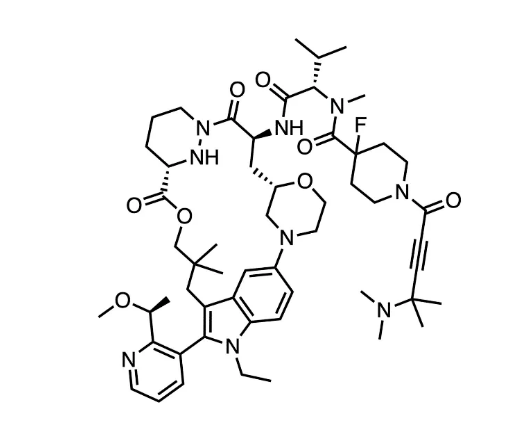
RMC-6291是一种口服、选择性、共价的KRAS G12C(ON) 抑制剂,旨在治疗由KRAS G12C突变体驱动的癌症患者,是该公司第一个进入临床开发的突变体选择性RAS(ON)抑制剂和首次公开报道的KRAS G12C抑制剂,具有高度分化的作用机制。
RMC-6291的I/Ib 期试验是一项多中心、开放标签、剂量递增和剂量扩展研究,评估 RMC-6291 作为单一疗法治疗携带 KRASG12C 突变的晚期实体瘤患者的效果。
截至2023年10月5日,共有23名非小细胞肺癌、33名结直肠癌、7名其他肿瘤类型患者接受了不同剂量的RMC-6291,从每天一次(QD, quaque die)50 mg剂量开始,逐渐增加到 100 mg (QD)、200 mg (QD)、100 mg (BID, bis in die,每天两次)、200 mg (BID)、300 mg (BID) 和 400 mg (BID)。所有患者均接受过三种既往治疗。RMC-6291展示了临床活性的初步证据和可接受的安全性特征,在不同剂量水平下通常具有良好的耐受性。
渤健 Omaveloxolone
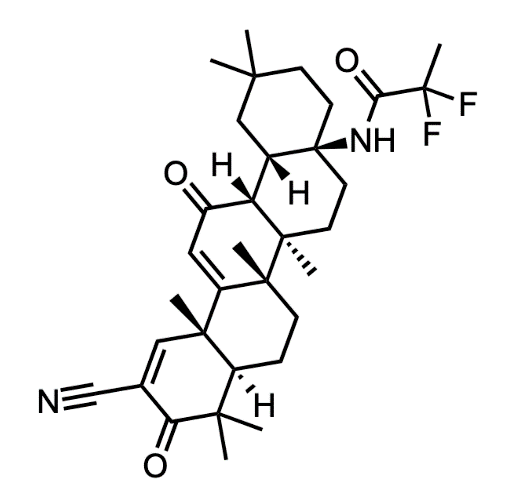
Skyclarys (omaveloxolone) 是由渤健/Reata Pharmaceuticals开发的核因子红细胞衍生 2 (Nrf2) 激活剂。FDA 2023年 2 月批准 SKYCLARYS 用于治疗 16 岁以上患者的 Friedreich 共济失调症。该药物是第一个也是唯一一个被批准治疗这种疾病的药物,并已被 FDA 授予快速通道和罕见儿科疾病资格。根据 GlobalData,到 2029 年将达到 13 亿美元。
SpringWorks Therapeutics Nirogacestat
Ogsiveo(nirogacestat)是一种口服γ分泌酶抑制剂,用于治疗需要全身治疗的进行性硬纤维瘤成年患者,也是FDA批准的第一个专门用于韧带样瘤的药物。该药物曾获得FDA授予快速通道资格、突破性疗法认定与优先审评资格,用以治疗进行性、不可切除复发或难治性硬纤维瘤或深部纤维瘤病成人患者。
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!


















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论