
心血管系统疾病(CVD)是全球死亡率以及发病率较高的疾病,而导致心血管系统疾病一大重要因素为高血脂,高血脂就像血管里的垃圾,容易形成斑块,堵塞血管,造成动脉粥样硬化性心血管疾病(ASCVD)。我国人口健康检查调查的结果显示,我国血脂异常的患病率居高不下,每年因心血管疾病导致死亡人数在400万左右,占总死亡人数的40%以上。根据《中国血脂管理指南2023年》指出,改善血脂异常是预防动脉粥样硬化心血管疾病的一大重要手段。
在聊新型降脂药之前,我们先了解下高血脂的形成因素,高血脂是指脂肪代谢异常或转运异常导致人体血液中的血脂异常超标,血脂异常的表现包括:总胆
固醇(TC)偏高、低密度脂蛋白胆固醇(LDL-C)偏高和甘油三酯(TG)偏高,而血液中胆固醇和TG主要存在于脂蛋白中。其中降低胆固醇的药物首选他汀类药物,而降低低密度脂蛋白胆固醇(LDL-C)可以使用前蛋白转化酶枯草溶菌素 9( PCSK9) 抑制剂,我们来了解下PCSK9,PCSK9 是由加拿大学者 Seidah 于2003年发现的一种前蛋白转化酶,Abifadel等人在对2例家族遗传性高胆固醇血症患者进行遗传病学调查时,发现了PCSK9与 LDL-C 的升高有关,PCSK9通过与肝细胞表面的 LDL-R (LDL-C受体)结合,形成复合体后进入肝细胞,被溶酶体一同降解,因此,PCSK9会大幅减少肝细胞表面 LDL-R 的数量,LDL-R减少后,低密度脂蛋白(LDL-C)无法与LDL-R结合,最终导致血液中残留的LDL-C数量增多。因此降低LDL-C可以通过抑制PCSK9或者直接减少PCSK9生成。
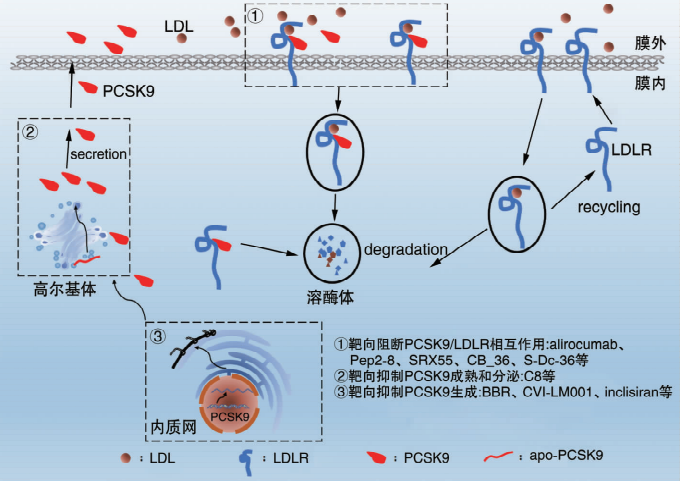
图1 PCSK9 抑制剂的作用机制[1]
截止目前,已上市的 PCSK9抑制剂共有4种,其中三种为单克隆抗体,它们分别是安进的Praluent、赛诺菲/再生元的Repatha、以及信达生物的托莱西单抗(IBI306),前两款药分别2015年7月和 8 月通过了美国食品和药物管理局(FDA)认证,后一款为我国国产创新药,该药于2023年08月15日获CDE批准;在 2020年12月09日欧盟药品监督管理局批准了由诺华开发的新型降脂药(inclisiran),商品名Leqvio ®,该药的用法为皮下注射,首次注射后,3个月再次注射,之后每6个月一次,一年仅用两次,这种给药频率大大提高药患者的依从性。该药次年又被FDA批准上市,是全球也是唯一一个用于降低LDL-C的siRNA疗法(小干扰RNA)。该药物主要作用机制是通过siRNA,减少PCSK9生成,进而增加LDL-R受体数量,从而达到降低LDL-C的目的。

接下来,我们重点讲述下降低LDL-C的siRNA疗法的新型药物Leqvio ®为什么能够长达6个月给药一次,到底是什么因素让它能够达到如此长的效果,难道它进入体内之后就形成了金刚不坏之身?或者它是否采用了某种特殊技术手段?
下面我们先来讲讲siRNA在体内面临的一些挑战,然后再聊聊inclisiran采用了哪些方法?
1.面临挑战
小核酸药物是目前研发热点,与传统药物相比,它可以从基因的角度治疗一些罕见病,然而,将药物准确的达到作用靶点,依然面临很多问题,总结来说,共需面临三大关卡:第一:细胞外面临的关卡;第二:进入细胞过程,面临的关卡;第三:进入细胞后面临的关卡;
1.1细胞外面临的关卡:
siRNA药物进入体内后未进入细胞前,将要面临四大问题:第一;体内中含有核酸酶,药物进入体内后遇到核酸酶,将会被降解;第二:吞噬细胞,药物进入体内会被识别为外来物,因此会被吞噬细胞吞噬;第三:蛋白质相互作用,药物与蛋白质结合后,药物就无法被进入细胞;第四:肾脏作用,药物进入血液,未及时进入细胞内,药物即会被肾脏清除。一项针对肾脏功能损伤的I期临床研究显示,inclisiran皮下注射284mg,在血浆中暴露量随着肾功能的损伤增大而增加。而且通过说明书得知,inclisiran有16%通过肾脏排泄,由此可知,inclisiran可以通过肾脏排泄。
1.2进入细胞,面临的关卡
通过查询inclisiran的分子量得知,inclisiran的分子量为17,284.72 g/mol,分子量太大,药物很难通过细胞膜进入细胞内。根据文献记载,分子量越大的药物,吸收也越慢,大分子(5000~20000)的药物通过细胞壁变的十分困难,这时候药物主要是通过淋巴系统的吸收,而小分子药物通常比较容易通过血管壁的微孔,这主要是因为血管壁微孔通常比较小,仅有3nm,因此分子量较小的药物可以通过。
1.3进入细胞后,面临的关卡
siRNA药物进入细胞后并不是万事大吉,siRNA以内吞体的形式进入后,还需要经历三个考验,第一:部分药物会被细胞通过囊泡融合的方式,排放到细胞外;这会导致最终药物到底靶mRNA的量减少;第二:部分药物会被溶酶体分解掉;第三:药物需要从内吞细胞逃逸,并与目标mRNA结合。
经过这几大关卡,最终能达到目标的药物数量是非常少的,据文献报道,在细胞质和细胞核中,siRNA或ASO等相关小核酸药物最终可能仅有1%~2%达到目标。不过值得庆幸的事,即使小于1%药物达到目标,它所能发挥的作用也是非常强大以及持久的。
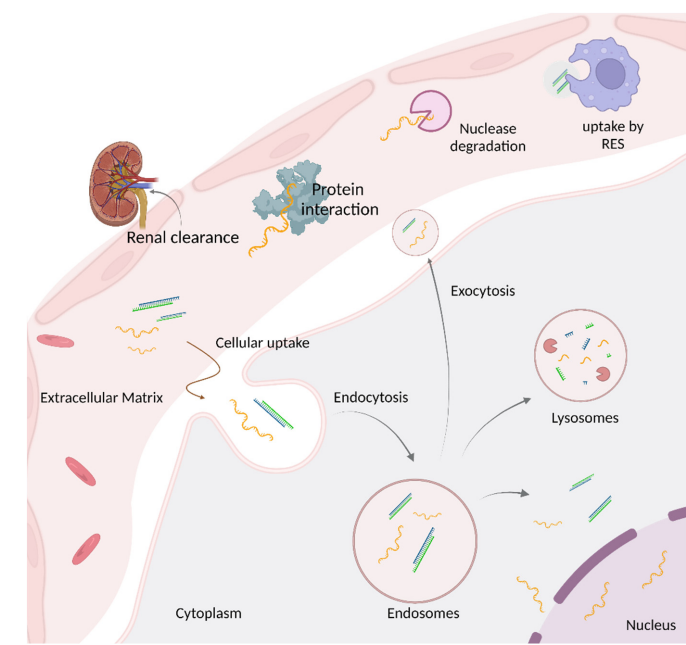
图2 限制寡核苷酸发挥活性的生物屏障[2]
2.inclisiran的解决办法
2.1.结构经过修饰,使得药物更加稳定
inclisiran在外切酶或内切酶的作用下易在血浆中被快速降解,为了提高化合物的稳定性,inclisiran将其分子结构中碱基进行了生化修饰,包含2′⁃氟和2′⁃甲氧基修饰,以及添加4种硫代磷酸盐,这几个结构的修饰,就像给它的分子结构穿上了防弹衣,使其在血液中更加稳定,减少伤亡。据文献报道,在inclisiran结构中添加这几种结构有以下几点优势:第一:增加药物的稳定性,防止降解;第二:增加酶抗性,减少药物被内切酶降解;第三:提高对靶RNA的亲和力;第四:降低免疫原性;目前,应用该结构修饰的药物不止inclisiran,还包括已上市的另外三款siRNA产品,分别为:GIVLAARI® (givosiran) 、OXLUMO® (lumasiran) 、AMVUTTRA®(vuttrisiran)。
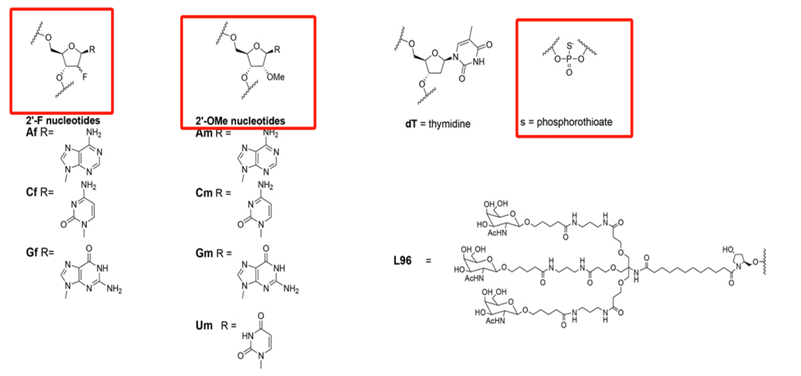
图3 inclisiran的结构式[3]
2.2 结构中共轭结合N-乙酰半乳糖胺(GalNAc),使其更加精准达到靶器官
PCSK9属于前蛋白转化酶家族,全身大部分器官均存在该物质,虽然它存在于大部分器官中,如肝肾脑脾及空肠,只有肝脏中的PCSK9能够分泌入血。早期有研究表明,人体肝脏中PCSK9的含量最高,因此要将药物精准到达肝脏,是提高inclisiran药物活性的重要因素之一。
通过查询文献得知,inclisiran是由21~23个核苷酸系列组成的新型双链siRNA,其分子是由两条互补的核糖核苷酸链组成的,分别为一条正义链和一条反义链,正义链包含21个核苷酸,反义链包含23个核苷酸,反义链包含目标基因的识别信息。而正义链中3'末端通过共轭结合N-乙酰半乳糖胺(GalNAc),N-乙酰半乳糖胺(GalNAc)与肝细胞表面的唾液酸糖蛋白受体结合,迅速被肝细胞摄取,因此能够被精准的作用于靶向器官。下图4为inclisiran的结构式,其中标红为正义链中结合N-乙酰半乳糖胺(GalNAc)的位置,图5为GalNAc递送RNA原理。
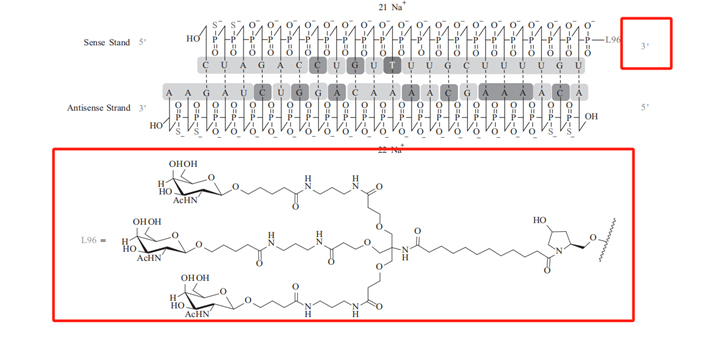
图4 inclisiran的结构式[3]
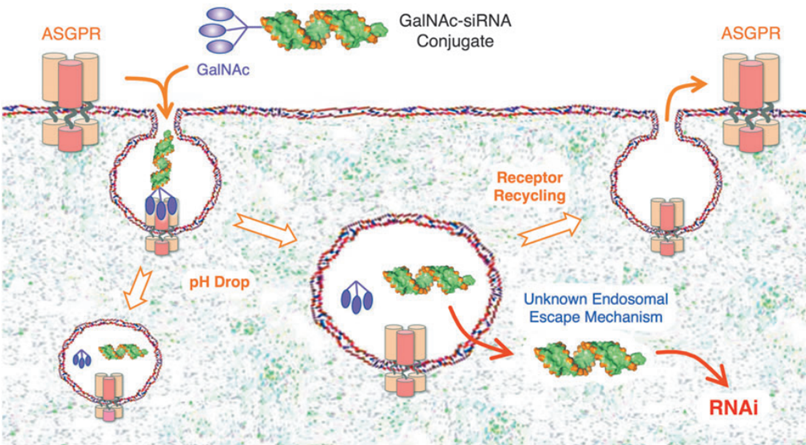
图5 GalNAc递送RNA原理[4]
2.3.内吞入肝细胞后形成沉默复合体(RISC)
siRNA的作用机制是由Andrew Z. Fire和Craig C. Mello这两位美国科学家揭示,并在2006年获得诺贝尔生理学或医学奖。下图是siRNA的作用机制。
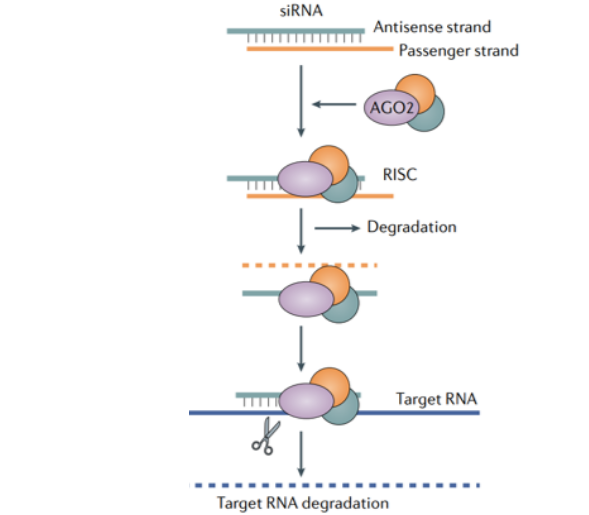
图5 siRNA作用的机制[5]
inclisiran进入体内后,在结构N-乙酰半乳糖胺(GalNAc)的帮助下,内吞入肝细胞,进入细胞后,通过RNA解旋酶与Argonaute (Ago) 等蛋白质因子结合,形成RNA诱导的沉默复合体 (RNA-induced silencing complex,RISC)。RISC中的正义链和反义链被切割开,正义链被降解,反义链与目标mRNA序列结合,阻断了PCSK9蛋白的翻译和合成,从而降低细胞内和细胞外的PCSK9水平。根据文献报道,这个过程可能需要十几小时到几天时间,同时RISC通常情况是比较稳定,根据一项研究得知(如下图),RISC在老鼠肝脏中第35天还可以检测到,由此可见RISC的半衰期是相当长的。令人欣喜的事,RISC不但半衰期长,它还可以重复切割不同的mRNA,就像一名抗战多年的将军,可以稳坐战营的同时,还可以指挥多名士兵作战。
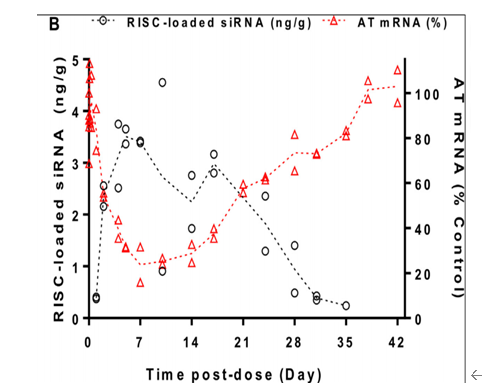
图6 小鼠皮下注射siAT 2.5mg/kg 后,肝脏中RISC-loaded siRNA的浓度以及ATmRNA浓度与时间图[6]
3.临床效果
前面讨论了那么多因素和机制,接下来我们还是有必要讨论下inclisiran的临床效果,正如毛泽东讲的那句话“实践是检验真理的唯一标准”,inclisiran是否真有那么长效,还是需要临床效果给出答案。
首个关于inclisiran降脂效果的Ⅱ期研究[7]是ORION-1,ORION-1是一项多中心、随机、安慰剂对照、多剂量递增的inclisiran试验。研究纳入501例LDL-C水平升高的CVD高风险患者,入组患者随机分配到8个研究组,全部受试者入组后分别给予安慰剂、200mg、300mg或500mg的inclisiran。有4组受试者于首次用药后第90天,再次使用安慰剂、100mg、200mg或300mg的inclisiran。其中第1天和第90天皮下注射300mg给药inclisiran组在第180天时,LDL-C的水平下降幅度最大。该组PCSK9水平平均下降69.1%,LDL-C水平下降52.6%,48%的患者在第180天观察到LDL-C<50mg/dL。
据报道,inclisiran组PCSK9和LDL-C水平降低与临床试验中使用的PCSK9单克隆抗体的降脂作用相比,持续时间更长,240d 随访后LDL-C浓度的下降幅度为26.7%~47.2%,且与药物剂量有关。尽管所有剂量亚组在第240天LDL-C和PCSK9浓度与第180天相比有所升高,但与基线数据相比仍显著降低。这些数据表明为了实现更有效和持久的降脂治疗效果,inclisiran合适的给药剂量间隔为6个月。
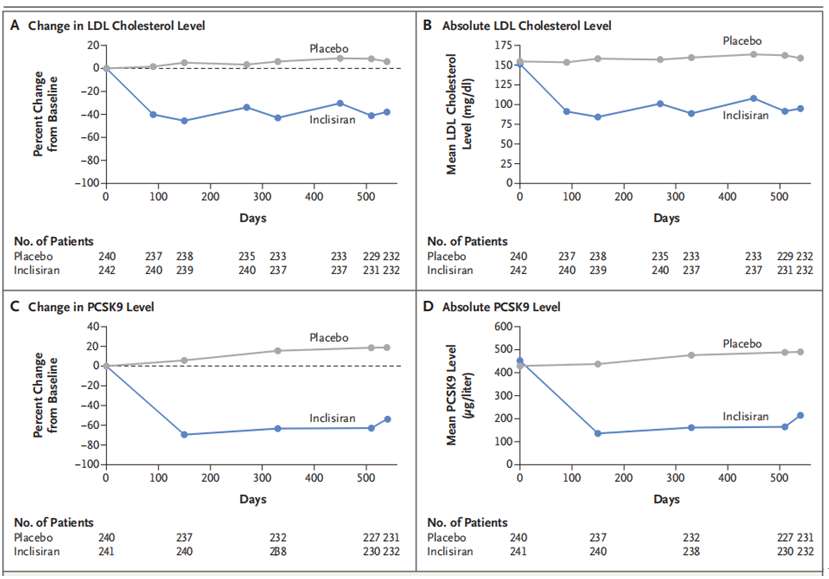
图7 540天试验期间(意向治疗人群)低密度脂蛋白(LDL)胆固醇和PCSK9水平的变化和绝对变化百分比[8]
综上所述,inclisiran通过化学修饰,提高了药物的稳定性,减少了药物的降解;同时又通过在结构中共轭结合N-乙酰半乳糖胺(GalNAc)使其精准定位至靶器官,使得更多的药物进入肝细胞内,提高了肝细胞内的药物浓度;再加上siRNA与蛋白因子结合形成RISC,最终导致药物的作用长时间维持,进而减少了给药次数,给患者带来了福音。
参考文献:
[1] 王伟志等前蛋白转化酶枯草溶菌素9抑制剂的研究进展 中国动脉硬化杂志2022年第30卷第8期
[2] Mangla P, Vicentini Q, Biscans A. Therapeutic Oligonucleotides: An Outlook on Chemical Strategies to Improve Endosomal Trafficking[J]. Cells, 2023, 12(18): 2253.
[3] https://www.accessdata.fda.gov/drugsatfda_docs/label/2021/214012lbl.pdf
[4] Springer, Aaron D.; Dowdy, Steven F. (2018). GalNAc-siRNA Conjugates: Leading the Way for Delivery of RNAi Therapeutics. Nucleic Acid Therapeutics, 28(3),109–118. doi:10.1089/nat.2018.0736
[5] Crooke S T, Baker B F, Crooke R M, et al. Antisense technology: an overview and prospectus[J]. Nature Reviews Drug Discovery, 2021, 20(6): 427-453
[6] Jayaprakash K. Nair等人 Impact of enhanced metabolic stability on pharmacokinetics and pharmacodynamics of GalNAc–siRNA conjugates Nucleic Acids Research, 2017, Vol. 45, No. 19 10969–10977 doi: 10.1093/nar/gkx818
[7]李沙等人小核酸药物 Inclisiran降低低密度脂蛋白胆固醇治疗研究进展心血管病学进展2023年7月第44卷第7期 AdvcardiovascDis,july 2023,vol.44,No.7
[8] Frederick J. Raal, M.D., Ph.D., Inclisiran for the Treatment of Heterozygous Familial Hypercholesterolemia
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!


















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论