
近年来,小核酸药物因特异性强、设计简便、研发周期短、靶点丰富等优点,成为当前生物医药领域研究的热点;小核酸药物专指靶向作用于RNA或蛋白质的一类寡核苷酸分子,包括反义寡核苷酸(ASO)、siRNA、aptamer等;反义寡核苷酸(ASO)通常是由15~25个核苷酸组成,并且进行了某些化学修饰的短链核酸,它的碱基通过(watson-crick)碱基互补配对原则与靶标形成双链结构。siRNA也被称为短干扰RNA 或沉默RNA、非编码RNA;siRNA 是生物宿主对于外源侵入基因表达的双链RNA 进行切割所产生的具有特定长度(21-25bp)和特定序列的小片段RNA,小干扰 RNA被发现以来一直广泛认为能够沉默许多或所有基因的核糖核酸。
目前小核酸药物的递送载体主要分为病毒性载体和非病毒类载体,非病毒类载体主要有:GalNac(N-乙酰半乳糖胺)偶联修饰、脂质纳米颗粒(lipid nanoparticle,LNP)、聚合物类、外分泌体、多肽偶联、抗体偶联等等其他一些偶联修饰。
纵观已上市的小核酸药物我们得知,全球共批准了10款ASO、5款siRNA、1款适配体,其中1款适配体已经退市,通过查询得知,10款ASO均未使用特殊的递送载体,比如:GalNAc或LNP,10款ASO均仅仅是对其序列结构进行修饰;而5款siRNA产品对序列结构修饰的同时,还采用了GalNAc或LNP的递送载体。造成这一现象的原因是什么呢?下面我们分别对ASO和siRNA进行重点分析对比
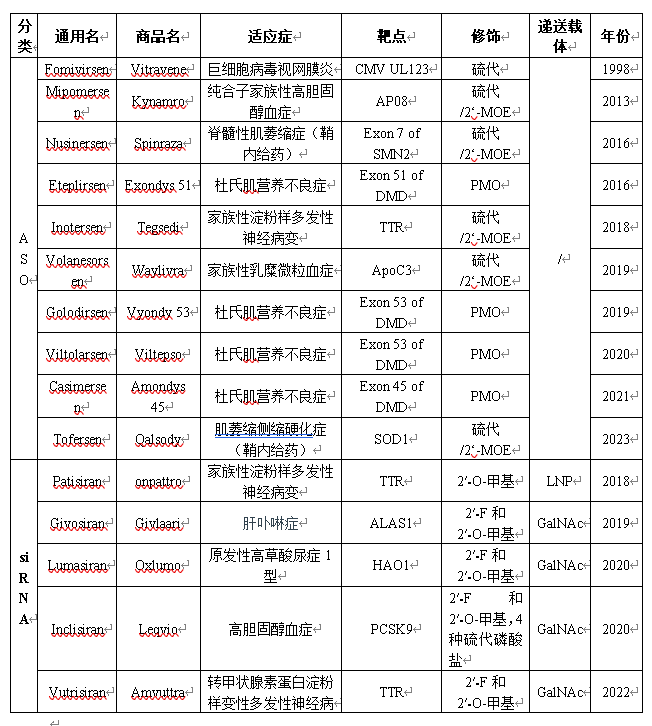
表1 已上市的ASO和siRNA产品
发展历史及作用机制
siRNA是起源于1998年,Andrew Fire 和Craig Mello两位科学家第一次在秀丽线虫中首次揭示了RNAi现象,2003年,多家企业开始着手siRNA药物的开发,然而不辛的是,在第一次进入临床实验时,未经过修饰的siRNA出现很强的免疫相关的毒性,而且它的有效性也遭到了质疑;后来在第二次进入临床实验时,将siRNA通过纳米载体递送至人体,才得以证实它的有效性,但也出现了严重的毒性反应,以及剂量疗效不足等问题,因为这些问题,很多大型企业纷纷退出了这个领域,甚至造成整个行业的经济危机;面对这个挑战,规模较小的公司坚持不懈,对siRNA进行修饰以及利用递送载体,最终创造出了更安全更有效的化合物;在2018年第一款siRNA药物获批上市,商品名为onpattro,用于家族性淀粉样多发性神经病变。
由此可见,siRNA若不通过递送载体,药物的有效性可能会存在很大的风险;通过查询siRNA的作用机制,发现siRNA本身不具备特定器官和组织的靶向性,无法靶向作用于器官;与此同时,siRNA分子量太大,具有亲水性,因此无法被动地穿过细胞膜,难以分布到靶组织中。再加上siRNA是外源性RNAi,容易引起免疫反应,这就造成siRNA药物难以达到靶向部位,造成有效剂量难以达到要求;为了药物的安全性和有效性,已上市的5款siRNA药物均是通过一定的修饰和递送,递送载体主要是LNP和GalNAc,这两种递送载体均是递送至肝脏。
而ASO的发展要早于siRNA,上市的品种也明显要多于siRNA,ASO起源于1978年,哈佛大学科学家Zamecni等人设计合成了一条与劳斯肉瘤病毒基因互补的短RNA,并发现这条短RNA可以在体外培养的组织中抑制病毒的复制,首次提出反义核酸概念。在1993年反义核苷酸首次被证明在体内有效,1996年发现了2′-MOE修饰,1998年第一款ASO产品获批,商品名为:Vitravene,虽然该款产品因各种原因已经退市,但它的意义深远,随着后来研究人员继续研究,并对结构进行各种修饰,慢慢越来越多产品获批,截止目前已经有10款产品获批。
为了提高ASO的稳定性和生物活性,ASO进行了不同程度的结构修饰,其中第一代是在其核酸链的骨架上,对其磷酸二酯键进行修饰,目的是提高它的酶抗性,根据文献记载[1],PS主链修饰有以下几种优势:①硫代磷酸酯的主链修饰,延长了寡核苷酸在血清中的半衰期,促进其与血清蛋白的结合,②增加细胞摄取,指导核糖核酸酶H降解靶标mRNA;③增加酶抗性;④不需要递送载体,可以自发的进入细胞;当然第一代修饰也存在不同的缺点:可能会降低靶标的结合性;由于蛋白质作用,可能导致毒性;为了进一步改进ASO的性质,克服第一代的缺点,人们在PS的基础上,将序列的两翼或中间的核糖上2’位置用其他基团修饰,包括2’-O甲基以及2’-MOE修饰,在该位置修饰有以下优势,①能够增强药物的活性(能够促进靶标结合);②能够减少非特异性蛋白的结合,减少毒性;再后来人们使用了更加先进的结构修饰即第三代,包括锁核酸 (LNA) 、约束乙基BNA(cEt)、2'–O和4' -C-乙烯桥连核酸(ENA)等。随着技术的研究逐渐深入,很多新的化学修饰的分子通常具有不同的改进特性,比如与靶标RNA的亲和力、抗核酸酶的稳定性、与靶标RNA结合后的RNA酶H识别能力和降解能力、以及药代动力学、药效学特性、组织分布、半衰期及毒性等。
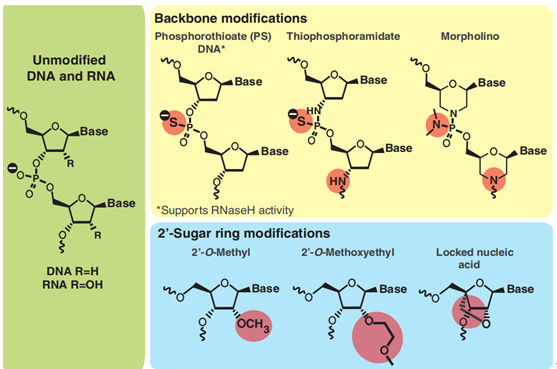
图1修饰ASO的结构式[1]
由此可见,经过不同程度的修饰的ASO,可以通过被动扩散进入细胞,也可与血清蛋白结合,促进它与细胞结合被特定组织吸收;虽然进入细胞后,仅有少量甚至微量的ASO进入细胞核中,但仅仅这少量的药物却能发挥强大和持久的功效。据文献报道,在细胞质和细胞核中,siRNA或ASO等相关小核酸药物最终可能仅有1%~2%达到目标;即使小于1%药物达到目标,它所能发挥的作用也是非常强大以及持久的。因此即使ASO未采用递送载体,仅通过结构修饰,也是可以少量进入目标细胞核中,发挥疗效;而siRNA若无递送载体,较难进入细胞核中,疗效与安全性均无法得到保障。
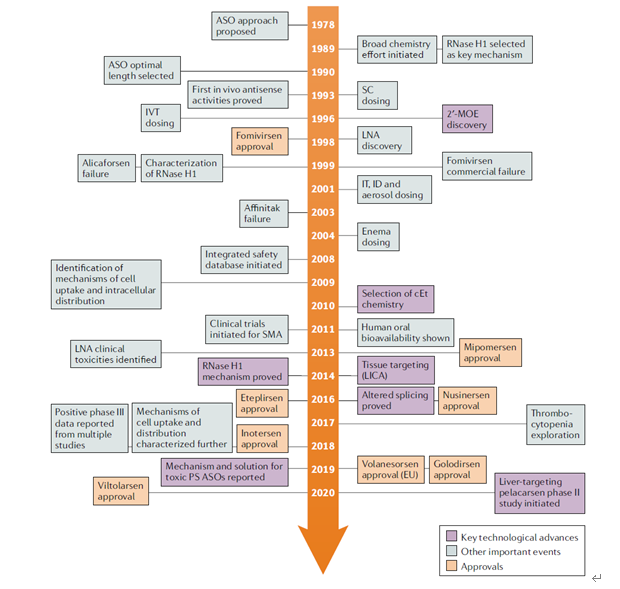
图2 ASO的发展史[2]
进入外周组织,即可发挥作用
通过查询已上市的ASO产品,我们发现有4款药物是用于杜氏肌营养不良症、1款用于家族性淀粉样多发性神经病变、2款用于脊髓性肌萎缩症、1款家族性乳糜微粒血症、1款纯合子家族性高胆固醇血症、1款巨细胞病毒视网膜炎,其中2款的给药方式是鞘内给药,1款为玻璃体给药,其余均是皮下或静脉给药;杜氏肌营养不良症主要是是一种X连锁隐性致死性遗传病,通常由基因突变致病,其发病机制复杂多样。该病的致病基因是人类最大的基因,位于Xp21.2区,编码抗肌萎缩蛋白,抗肌萎缩蛋白是一种细胞骨架蛋白主要布于心肌和骨豁肌肌纤维膜的胞质,最主要是分布在神经肌肉接头处。ASO主要是反义寡核苷酸介导的外显子跳跃疗法,该方法临床试验中恢复DMD患者抗肌萎缩蛋白基因表达功能;由于该蛋白是处于心肌与骨骼肌纤维膜的胞质中,即药物仅进入外周组织即可达到效果,根据文献报道,通过皮下注射或静脉注射被修饰的ASO能够广泛的分布到外周组织[3]。
合适的注射途径
目前已上市的两款采用鞘内给药的药物,商品名分别是Spinraz和Qalsody,适应症分别是脊髓性肌萎缩症和肌萎缩侧缩硬化症,脊髓性肌萎缩症是运动系统隐性遗传病,2018年被国家卫生健康委员会列为第一批罕见病,在新生儿中发病率为1/6 000~1/10000,其特点是前角α运动神经元变性,导致肢体近端和躯干肌肉进行性萎缩和瘫痪,最终因呼吸衰竭而死亡;而肌萎缩侧索硬化(amyotrophiclateralsclerosis,ALS)是一种病因未明、主要累及大脑皮质、脑干和脊髓运动神经元的神经系统变性疾病;两种疾病的作用部位均是大脑;已上市的两款药物都是通过鞘内给药,使药物从脑脊液到中枢神经起作用,ASO由于高电荷并不能通过血脑屏障,若想让药物进入中枢神经系统[4],共有4种给药方式,分别是全身系统给药(通过纳米递送),鞘内注射,脑室内注射以及递送至鼻内给药(见下图3)。
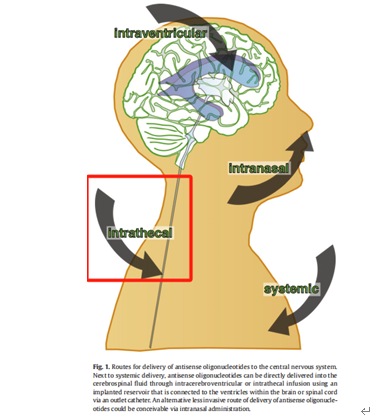
图3反义寡核苷酸药物递送至中枢神经的方式[4]
通过抑制亨廷顿蛋白来治疗亨廷顿氏舞蹈症(Huntington’s Disease)的研究[5],发现通过鞘内注射ASO,该药物在大脑中广泛分布并能够有效抑制亨廷顿蛋白(见下图4),由此可见,通过鞘内注射能够将ASO靶向作用于中枢神经系统。
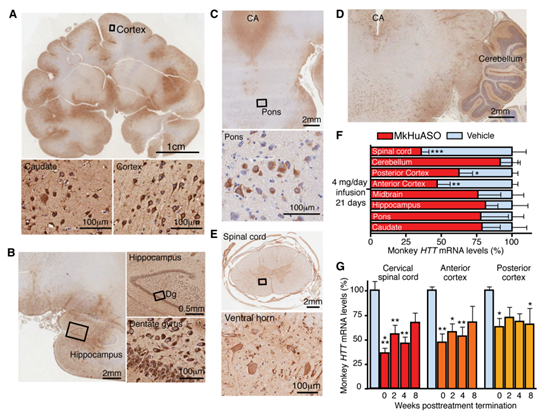
图4:非人类灵长类动物脑脊髓注射后ASO的分布[5]
递送载体的发展
虽然已上市的ASO产品未使用特殊的递送载体,仅仅是采用结构修饰,但并不意味着ASO完全不需采用递送载体,随着人们对细胞摄取ASO机理的认识,以及递送方式的发展,目前有些ASO也采用了递送载体,比如脂质体、GalNAc修饰、链接抗体、链接多肽、共聚体等等,不过大部分产品都是处于临床研究阶段,某些递送载体在siRNA中应用的优势可能更加明显。根据Thazha P[6]研究发现,在ASO链接GalNAc能够有效地将ASO递送至肝细胞,并使活性增强10倍。现在许多其他制药公司,如Dicerna Pharmaceuticals、Silence Therapeutics、Arbutus Biopharma 和 Arrowhead Pharmaceuticals,也在开发 GalNAc 偶联产品。
据不完全统计,全球共超过50个ASO药物正处于临床阶段,其中部分药物采用 GalNAc偶联。
图5 处于临床研究的ASO药物[7]
综上所述;已上市的ASO并未采用递送系统,主要是因为①修饰过的ASO可以吸附于血浆蛋白,促进它与细胞结合并被特定组织吸收;②有些疾病药物进入外周组织即可发挥疗效;③可以通过合适的给药途径即可达到效果;④有些采用递送载体的ASO药物正在进行临床研究阶段。而siRNA大部分产品都是经过递送载体,主要原因是siRNA无法与血浆蛋白结合,无法自发的进入靶细胞,因此需要递送载体将其精准至靶器官,以提高药物的有效性和安全性。
参考文献:
[1]DeVos, Sarah L.; Miller, Timothy M. (2013). Antisense Oligonucleotides: Treating Neurodegeneration at the Level of RNA. Neurotherapeutics, 10(3), 486–497. doi:10.1007/s13311-013-0194-5
[2]Stanley T. Crooke;Brenda F. Baker;Rosanne M. Crooke;Xue-hai Liang; (2021). Antisense technology: an overview and prospectus . Nature Reviews Drug Discovery, (), –. doi:10.1038/s41573-021-00162-z
[3]H.B. Kordasiewicz, L.M. Stanek, E.V. Wancewicz, C. Mazur, M.M. McAlonis, K.A. Pytel, J.W. Artates, A. Weiss, S.H. Cheng, L.S. Shihabuddin, et al., Sustained therapeutic reversal of Huntington's disease by transient repression of huntingtin synthesis, Neuron 74 (2012) 1031–1044.
[4]Melvin M. Evers, Lodewijk J.A. Toonen, Willeke M.C. van Roon-Mom Antisense oligonucleotides in therapy for neurodegenerative disorders.Advanced Drug Delivery Reviews 87 (2015) 90–103.
[5]H.B. Kordasiewicz, L.M. Stanek, E.V. Wancewicz, C. Mazur, M.M. McAlonis, K.A. Pytel, J.W. Artates, A. Weiss, S.H. Cheng, L.S. Shihabuddin, et al., Sustained therapeutic reversal of Huntington's disease by transient repression of huntingtin synthesis, Neuron 74 (2012) 1031–1044.
[6]Prakash, T. P.; Graham, M. J.; Yu, J.; Carty, R.; Low, A.; Chappell, A.; Schmidt, K.; Zhao, C.; Aghajan, M.; Murray, H. F.; Riney, S.; Booten, S. L.; Murray, S. F.; Gaus, H.; Crosby, J.; Lima, W. F.; Guo, S.; Monia, B. P.; Swayze, E. E.; Seth, P. P. (2014). Targeted delivery of antisense oligonucleotides to hepatocytes using triantennary N-acetyl galactosamine improves potency 10-fold in mice. Nucleic Acids Research, 42(13), 8796–8807. doi:10.1093/nar/gku531 .
[7]Islam P Y .Handbook of Lung Targeted Drug Delivery Systems:Recent Trends and Clinical Evidences[M].CRC Press:2021-05-18.
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!


















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论