一、加速推进研发进展
纤维化(Fibrosis)其实是多种类型组织损伤尤其是在慢性炎症性疾病过程中,组织修复反应失调的结局。纤维化几乎发生在所有器官和组织中,例如心、肝、肺、肾、皮肤等,长期以来,人们一直认为纤维化不可逆,但临床前模型和临床试验均表明,它是一个高度动态变化的过程。
常见的与纤维化有关的疾病有:特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)、肝硬化、慢性肾病、心肌梗死、心力衰竭以及非酒精性脂肪肝炎(NASH)等。纤维化还影响肿瘤侵袭和转移、慢性移植物排斥和许多进行性肌病的发病机制。除器官损伤外,纤维化还与癌症进展有关,因为纤维化ECM可刺激细胞增殖并改变细胞极性,从而促进肿瘤发育和生长。

图 | 纤维化损伤过程
肺纤维化(pulmonary fibrosis,PF)是多种弥漫性间质性疾病的最终病理改变,以巨噬细胞活化、炎性介质释放、上皮-间质转化、成纤维细胞增殖、肌成纤维细胞分化为主要病理改变,导致细胞外基质大量沉积引起肺泡结构破坏,最终导致肺功能异常。PF发生机制复杂,尚无有效治疗手段,肺移植费用高昂、风险高,因此研究PF发生机制与防治,一直是临床研究的难点和热点课题。
长期以来,特发性肺纤维化无药可治,受到医药界的普遍关注。今天要介绍的这家企业——Pliant Therapeutics,是一家专门致力于发现和开发用于治疗纤维化新疗法的公司,近年来它在纤维化领域创造了令人瞩目的新突破,真正的源头创新-first in class。
Pliant Therapeutics公司信息(部分,完整内容请登录“药融云数据库www.pharnexcloud.com/?mh”查看)
截图来源:药融云投融资数据库
药融圈旗下药融云数据库显示:Pliant Therapeutics,Inc.是一家处于临床阶段的生物制药公司,总部位于美国加利福尼亚州旧金山南部,由世界著名的科学家Dean Sheppard,Rik Derynck,Bill DeGrado和Hal Chapman于2015年创立。Pliant公司于2020年6月3日在纳斯达克市场上市,证券代码:PLRX。截至2023年5月12日,该公司的股价为22.09美元/股,市值为13.07亿美元。
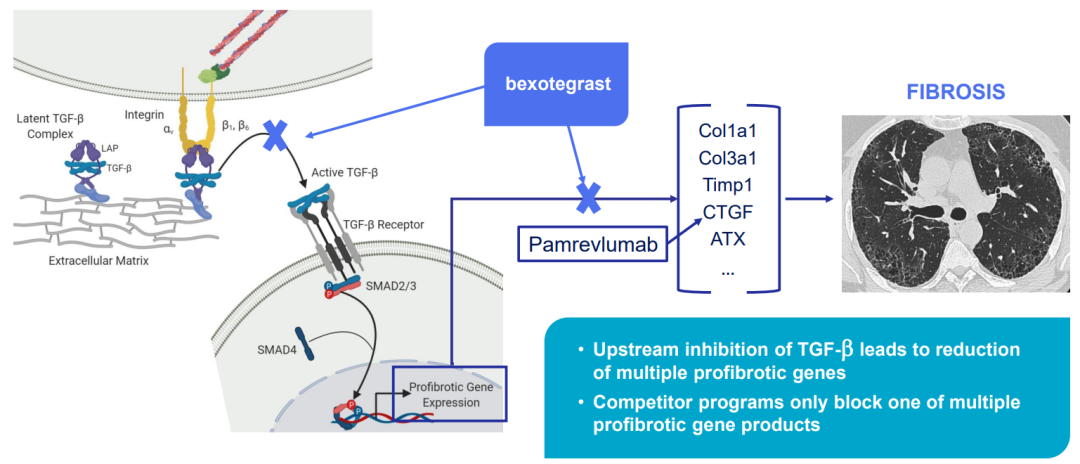
公司致力于发现和开发用于治疗纤维化的新疗法。公司最初的重点是通过抑制整合素介导的TGF-ß活化来治疗纤维化,快速有效地发现和降低候选产品的风险。主要候选产品PLN-74809是avß6和avß1整合素的口服小分子双重选择性抑制剂,该药物用于治疗特发性肺纤维化IPF,和原发性硬化性胆管炎PSC。
截至2022年12月31日,该公司拥有124名全职员工,其中41名拥有博士或医学博士学位,研发人员人数为85人。
二、Pliant公司在研产品进展情况
Pliant全资拥有的主要候选产品Bexotegrast(PLN-74809)是一种口服、小分子、αvß6和αvß1整合素的双重选择性抑制剂,正在开发用于治疗特发性肺纤维化(IPF)和原发性硬化性胆管炎(PSC)。目前,Pliant正在其主要适应症中进行三个2A期试验:IPF中有2个,PSC中有1个。
在2022年7月和2023年1月,Pliant公布了2A期Integris-IPF试验的积极中期数据。预计将在2023年第二季度公布Integris-IPF试验的最终数据,在2023年第三季度公布PSC 2A期试验的中期数据。
Pliant还开发了另一款处于临床阶段的候选分子PLN-1474,这是一种口服小分子选择性αVß1抑制剂,用于治疗与非酒精性脂肪性肝炎(NASH)相关的肝纤维化。PLN-1474已进入2期,在1期试验中表现出极佳的安全性和药代动力学特征。(PLN-1474于2019年授权给诺华,诺华进行战略调整后,现已停止NASH的临床开发,因此停止了PLN-1474的开发。)2023年2月,诺华将PLN-1474的全球权利归还给了Pliant。
2023年1月,Pliant的第三个临床项目PLN-101095(一种整合素αvß8和αvß1的双重抑制剂,用于治疗对免疫检查点抑制剂耐药的实体瘤)获得了FDA批准的研究新药申请(IND)。预计将在2023年第二季度启动PLN-101095的第一阶段试验。
除了以上临床项目外,Pliant目前正在推进一项针对肌营养不良症的基于整合素的临床前项目。
产品研发管线(更新至2023年3月10日):

1.主要候选新药产品-Bexotegrast
Pliant的主要全资候选产品Bexotegrast是一种口服、小分子、αVß6和αVß1的双重选择性抑制剂,正在IPF和PSC中推进。虽然αVß6和αVß1在正常组织中的表达水平非常低,但在IPF患者的肺组织和PSC患者的肝组织中表达上调。它们都是TGF-β的激活剂,导致这些组织中胶原生成增加和纤维化。通过阻断αVß6和αVß1对TGF-β的激活,bexotegrast可以减缓并可能阻止这些患者群体的纤维化进展。Bexotegrast已被美国食品和药物管理局(FDA)和欧洲药品管理局(EMA)授予孤儿药称号,用于IPF和PSC。此外,Bexotegrast已被FDA授予IPF和PSC的快速通道认证。
据药融云数据库显示,目前,bexotegrast针对原发性硬化性胆管炎、特发性肺纤维化以及肝纤维化的适应症进展较快,在美国都已推进到临床二期试验阶段。
Bexotegrast适应症研发现状
截图来源:药融云全球药物研发数据库
1.1 Bexotegrast治疗特发性肺纤维化(IPF)
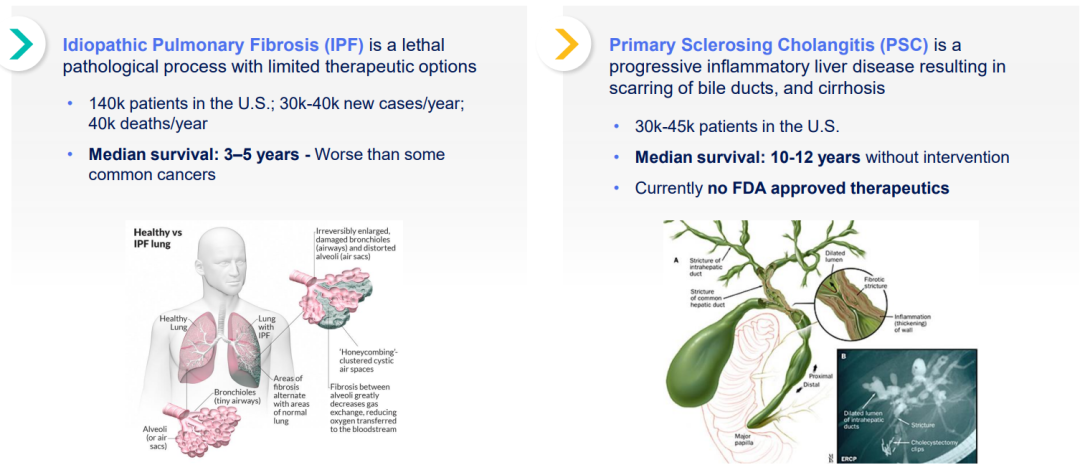
IPF是最常见和最严重的进行性肺纤维化形式,在美国影响大约14万名患者,在全世界影响超过300万名患者。虽然IPF的根本原因尚不清楚,但该疾病的病程已得到很好的证明,随着时间的推移,会出现渐进性瘢痕,破坏肺的结构和功能。确诊的IPF患者的平均预期寿命为3至5年。目前有两种FDA批准的治疗IPF的方法。两者都显示了疾病进展的适度减缓。然而,这两种疗法都提出了显著的安全性和耐受性问题。
Bexotegrast是一种口服小分子,可选择性抑制αVß6和αVß1整合素,Pliant正在将其开发为IPF和PSC的潜在疗法。Pliant已经确定,与IPF和PSC相关的纤维化中的TGF-β激活涉及αVß6和αVß1整合素。研究表明,上皮细胞αVß6和成纤维细胞αVß1的表达均可导致纤维化中TGF-β的过度活化。上皮组织包括排列在身体表面的任何组织,例如肺泡、胆管、尿道、皮肤和胃肠道。这些组织中的每一个都包含多种细胞类型,包括上皮细胞和成纤维细胞。TGF-β级联的一个重要的次级效应是促进上皮细胞上αVß1的上调。这些整合素在细胞表面表达的增加反过来有助于TGF-β驱动的正前馈环中TGF-β的进一步激活。
2022年7月,Pliant公布了Integris-IPF的40mg、80mg和160mg剂量组的阳性中期数据,这是一项多国、随机、双盲、安慰剂对照的Bexotegrast在IPF患者中的2a期临床试验。该试验达到了其主要和次要终点,表明bexotegrast在12周的治疗期内耐受性良好,并显示出良好的药代动力学特征。该试验的探索性疗效终点评估了用力肺活量(FVC)和定量肺纤维化(QLF)成像的变化,结果表明,与安慰剂相比,Bexotegrast治疗的患者在12周内对FVC和QLF的治疗效果呈剂量依赖性。Bexotegrast在12周的治疗中耐受性良好,无药物相关的严重不良事件或SAE,也无因不良事件而中断治疗。
bexotegrast临床试验登记情况
截图来源:药融云全球临床试验数据库
2023年1月,Pliant公布了Integris-IPF 320mg剂量组额外的12周阳性中期数据。320mg组达到了其主要和次要终点,表明Bexotegrast在12周的治疗期内耐受性良好,并显示出良好的药代动力学特征。与安慰剂相比,320mg的BEXOTEGRAST在所有时间点的FVC均较基线有统计学意义的平均增加,超过了所有低剂量组,并且在12周时对FVC预测百分比或FVCPP、QLF和促纤维化生物标志物有很强的治疗效果。在为期12周的320mg治疗中,Bexotegrast耐受性良好,未发生与药物相关的严重或严重不良事件。

(在Integris-IPF中,Bexotegrast 320mg在12周内对FVC的基线变化;混合模型重复测量分析——改良意向治疗人群)
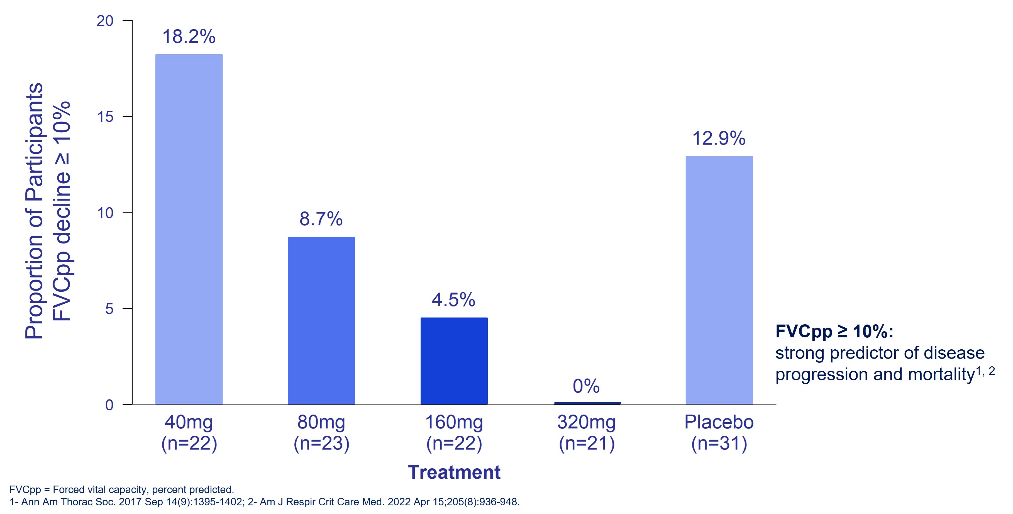
(FVCPP下降≥10%的参与者比例-意向治疗人群)

(循环PRO-C3和整合素β-6生物标志物水平-与安慰剂相比,4周和12周时相对于基线的变化)
1.2 Bexotegrast治疗原发性硬化性胆管炎(PSC)
PSC是一种进行性肝脏疾病,在美国影响约3万~4.5万名患者。该疾病的特征是起源于胆管的纤维化,最终导致胆汁流动阻塞或胆汁淤积,引起肝损伤和肝脏的进行性纤维化。在没有干预的情况下,患者的中位生存期为10至12年,并且一生中发生胃肠道恶性肿瘤的风险很高。目前还没有FDA批准的PSC治疗方法。Pliant目前正在PSC中进行Bexotegrast的2A期试验。该试验是一项为期12周的随机、双盲、安慰剂对照试验,纳入了约84名PSC患者,分为四个治疗组,包括三个Bexotegrast剂量(40mg、80mg和160mg)和一个安慰剂组,将评估安全性、耐受性和PK。此外,Pliant还计划评估探索性疗效终点,包括纤维化生物标志物,如Pro-C3和ELF,以及ALP和肝脏成像。预计将在2023年第三季度公布该试验的数据。
2.PLN-1474治疗与NASH(非酒精性脂肪性肝炎)相关的肝纤维化
Nash发病率很高,在美国影响了大约1650万成年人,包括大约330万F3/F4期纤维化患者。纤维化分期是Nash患者肝脏相关发病率和全因死亡率的最强预测因子。F3和F4纤维化患者的肝脏相关死亡风险分别是无纤维化Nash患者的17倍和42倍。因此,治疗F3/F4肝纤维化将对Nash的肝脏相关发病率和全因死亡率产生影响。目前还没有批准的治疗Nash的方法,迄今为止正在开发的候选药物在已发表的临床试验中仅显示出适度的抗纤维化效果。Pliant已经开发了第二个临床阶段的候选产品PLN-1474,它是一种口服小分子选择性TGF-β抑制剂,通过整合素αvß1激活,用于治疗与Nash相关的晚期肝纤维化。αVß1作为TGF-β的激活剂,其表达在晚期Nash相关肝纤维化的肝星状细胞中上调。
PLN-1474药物研发信息(部分)
截图来源:药融云全球药物研发数据库
PLN-1474已经完成了首次人体、随机、双盲、安慰剂对照的1期剂量递增试验,该试验招募了84名健康志愿者,分为单剂量递增和多剂量递增两组。结果显示,PLN-1474吸收迅速,耐受性良好,未观察到剂量或治疗限制性毒性,不良事件大多轻微,未观察到严重或严重不良事件。
据药融云数据库显示,,2019年10月,Pliant与诺华签署了一份合作和许可协议,根据该协议,诺华将全球权利授权给PLN-1474。根据协议条款,Pliant收到了5000万美元的预付许可费,以及在PLN-1474的1期临床试验中首次患者首剂时支付的2500万美元的或有付款。在诺华进行战略调整后,诺华停止了Nash的临床开发,并因此停止了PLN-1474的开发。2023年2月,诺华将PLN-1474的全球权利归还给了Pliant。
截图来源:药融云全球医药交易数据库
3.PLN-101095用于治疗对免疫检查点抑制剂耐药的实体肿瘤
2022年12月,Pliant为第三个临床项目PLN-101095提交了IND,PLN-101095是一种αVß8和αVß1整合素的口服双重抑制剂,用于治疗对免疫检查点抑制剂(ICIS)反应欠佳的实体瘤。2023年1月,Pliant获得FDA对其开展临床试验的许可。随着TGF-β生物学的阐明,科学文献中越来越多地了解到TGF-β在肿瘤微环境中发挥重要的抗炎作用,防止T细胞浸润并抑制各种细胞因子的释放。这一机制越来越被认为是许多肿瘤对检查点抑制剂(如抗PD-1疗法)产生耐药性的潜在原因。Pliant正在靶向TGF-β激活的整合素αvβ8和αvβ1,它们在某些肿瘤中上调,目的是使肿瘤对检查点抑制剂敏感。Pliant计划在2023年第二季度启动第一阶段首次人体研究,评估PLN-101095在对免疫检查点抑制剂(ICIS)反应欠佳的实体瘤患者中的疗效。
4.PLN-101325用于治疗肌营养不良
除了以上临床项目外,Pliant正在开发一种针对α7β1的临床前变构激动性单克隆抗体,用于治疗肌营养不良,包括杜氏肌营养不良(DMD)。在几种肌营养不良适应症中,α7β1整合素在肌肉细胞上上调,部分补偿了肌营养不良蛋白的缺乏,并有助于将肌肉细胞锚定到细胞外基质上。该程序利用变构激动性抗体来激活靶标,以增强自然发生的代偿机制。因为该抗体不是突变特异性的,所以它可能作为单一疗法或与其他治疗模式联合治疗多种肌营养不良症有效。Pliant的肌肉萎缩症候选产品目前正在进行IND启用研究,预计将于2023年提交IND。
二、治疗纤维化领域产品市场竞争情况
目前有许多生物制药和生物技术公司正在开发治疗纤维化的产品。药融圈旗下药融云数据以及Pliant介绍,通过抑制TGF-β通路的各个部分来治疗各种纤维化适应症的公司包括艾伯维公司(AbbVie Inc.)、阿斯利康公司(AstraZeneca PLC)、百时美施贵宝公司(Bristol Myers Squibb Co.)、Corbus制药公司、Dice Therapeutics,Inc.、Fibrogen,Inc.、默克公司(Merck&Co.,Inc)、Morphic Therapeutics,Inc.
纤维化治疗产品全球研发情况(部分)
截图来源:药融云全球药物研发数据库
勃林格殷格翰公司(Boehringer Ingelheim)的PDE4B抑制剂(BI 1015550)、Fibrogen Inc.的抗结缔组织生长因子单克隆抗体(Pamrevlumab)和联合治疗公司(United Therapeutics)的前列环素血管扩张剂(Treprostinil)是治疗IPF的最先进的开发候选药物。罗氏控股公司最近停止了重组人pentraxin-2单株抗体的3期临床试验。
IPF:目前有两种批准用于治疗IPF的产品;由Roche Holding AG销售的Esbriet和由Boehringer Ingelheim GmbH销售的OFEV。目前正在开发IPF候选产品的公司包括勃林格殷格翰制药公司、Fibrogen公司、Galecto Biotech公司、Amgen公司、百时美施贵宝公司、联合治疗公司、Vicore Pharma Holding、CSL Behring和Endeavor Biomedicines公司。
PSC:目前尚无治疗PSC的批准疗法。目前在PSC开发候选产品的公司包括Dr.Falk Pharma GmbH、Mirum Pharmaceuticals,Inc.、Chemomab Therapeutics Ltd.、Hightide Therapeutics Inc.和Escient Pharmaceuticals,Inc.。
NASH:目前还没有FDA批准的治疗Nash的疗法。有许多公司正在开发治疗Nash的候选产品,包括89Bio公司、艾伯维公司、Akero Therapeutics公司、Amgen公司、阿斯利康公司、勃林格殷格翰公司、百时美施贵宝公司、Cascade制药公司、Cirius Therapeutics公司、Dr.Falk Pharma GmbH、礼来公司、Enanta制药公司、Gannex制药有限公司、Galectin Therapeutics,Gilead Sciences,Inc.,Genfit SA,Genentech,Inc.,GlaxoSmithKline PLC,Intercept Pharmaceuticals,Inc.英华达制药公司,Ionis Pharmaceuticals,Inc.艾欧尼斯制药公司,强生公司,牧歌制药有限公司,默克公司,MetaCrine,Inc.NGM生物制药有限公司,Northsea Therapeutics B.V.,Novo Nordisk,辉瑞公司,罗氏赛诺菲(Sanofi S.A.)、武田制药(Takeda Pharmaceutical Company)、Terns Pharmaceuticals,Inc.、Viking Therapeutics,Inc.和Zydus Therapeutics Inc.。目前正在开发的大多数治疗Nash的药物都侧重于减少肝脏脂肪或改善肝脏炎症,而不是直接的肝脏抗纤维化方法。
三、财务状况
自成立以来,Pliant遭受了巨大的净亏损,并主要通过股权和债务融资以及与诺华的合作为运营提供资金。Pliant还没有从产品销售中获得任何收入。到目前为止,该公司的收入来自与诺华的合作和许可协议(“诺华协议”),该协议于2019年开始执行。
截至2022年、2021年和2020年12月31日,Pliant的净亏损分别为1.233亿美元、9730万美元和4150万美元。截至2022年12月31日,累计赤字为3.384亿美元。
截至2022年12月31日,Pliant拥有约3.312亿美元的现金、现金等价物和短期投资。Pliant预计,公司现有资本资源加上2022年7月和2023年1月公开发行的收益,将足以满足公司到2026年下半年的预计运营需求。

表 | 2022财年三季度报告

截至2022年9月30日的9个月,收入为770万美元,而截至2021年9月30日的9个月,收入为560万美元。收入增加210万美元是由于在2022年第二季度确认了400万美元的研究目标验证费,这部分被与诺华协议相关的研发服务收入减少所抵消。
截至2022年9月30日,前九个月的研发费用为7180万美元,而截至2021年9月30日的九个月的研发费用为5880万美元,研发费用增加1300万美元;总务和行政费用为2570万美元,而截至2021年9月30日的九个月的总务和行政费用为1970万美元,增加600万美元,主要是由于员工相关成本,由工资和股票薪酬费用、咨询和其他专业服务费用以及支持与纤维化相关的学术研究的慈善捐款推动。
表 | 2022财年年度报告

2023年3月9日,Pliant公布2022财年年度报告。2022财年该公司营业收入分别为970万美元和760万美元,增加210万美元主要是由于在2022年第二季度确认了400万美元的里程碑付款,因为诺华公司行使了其选择加入研究计划的权利,并获得了与整合素研究目标相关的化合物的独家许可。这一增长部分被与PLN-1474相关的研发服务收入的减少所抵消。
2022财年研发费用分别为9690万美元和7750万美元;总务和行政费用分别为3990万美元和2760万美元,增加1240万美元主要是由于员工相关成本(包括股票薪酬)增加910万美元,以及法律、会计和其他专业服务增加330万美元。
四、四大战略方向
2023年1月,Pliant完成了公开募股,获得2.699亿美元的净收益,其中包括承销商全额行使其购买额外股份的选择权。Pliant拟将发售所得款项净额连同其现有现金、现金等价物及投资用于开发其正在进行及未来的临床前及临床计划(包括Bexotegrast及PLN-101095),进一步开发其整合素靶向平台,为营运资金、营运开支及资本开支提供资金,以及用于其他一般企业用途。该公司重点关注以下关键战略:
- 1.通过IPF和PSC的临床开发和商业化,快速推进Bexotegrast.Pliant正在开发αVß6和αVß1的主要口服小分子抑制剂,作为IPF和PSC的新疗法,这两个领域都有很高的未满足的医疗需求。IPF和PSC都是罕见病,Pliant期望可以在关键地区实现商业化。
- 2.不论是适应症领域的合作伙伴还是市场地区的合作伙伴,要有选择性地评估,并与其合作。纤维化疾病代表了一组广泛的疾病适应症。Pliant的重点是将公司在纤维化适应症方面的资产商业化,并有选择地与较广泛适应症和北美以外地区的合作伙伴合作。此外,Pliant将评估并可能选择在纤维化以外的适应症中与未合作的候选产品合作。
- 3.探索管线资产在其他纤维化适应症中的机会。Pliant正在评估候选产品在其主要适应症之外的潜在优势。该公司的候选产品已在多种动物模型以及IPF、PSC和Nash以外适应症的人体组织中显示出抗纤维化活性。接下来将继续评估更多的适应症,以最大限度地发挥管线潜力。
- 4.利用行业领先的工具和能力,推进成为领先纤维化公司的使命。目前,Pliant的专有能力包括靶表达图谱、超过10,000个整合素结合分子的扩展文库、整合素筛选分析平台、活体纤维化人体组织程序、PET-配体成像程序和生物标志物分析。该公司计划继续扩大整合素抑制剂文库,并开发工具,如额外的PET配体以及新的疾病生物标志物。
2023预期重大事项:
- IPF患者Integris-IPF 2A期试验320 mg剂量组的24周数据预计将于2023年第二季度公布;
- 预计将于2023年中期启动Bexotegrast在IPF患者中的2B期试验;
- 预计将于2023年第二季度启动PLN-101095在对免疫检查点抑制剂耐药的实体瘤患者中的1期临床试验;
- PSC患者Integris-PSC 2A期试验40、80和160 mg剂量组的顶线数据预计将于2023年第三季度公布。
参考:
NMPA/CDE;
药融云数据,vip.pharnexcloud.com/?h;
FDA/EMA/PMDA;
相关公司公开披露(除标注外,正文图片均来自企业官方);
https://pliantrx.com/;
https://www.sec.gov/Archives/edgar/data/1746473/000174647323000008/plrx-20221231.htm
https://ir.pliantrx.com/static-files/06ef73ad-82e2-4f43-89b5-82a03c4f4f23;
Pliant Therapeutics Receives Orphan Designation from the European Medicines Agency for Bexotegrast (PLN-74809) for the Treatment of Idiopathic Pulmonary Fibrosis , https://ir.pliantrx.com/news-releases/news-release-details/pliant-therapeutics-receives-orphan-designation-european;
https://ir.pliantrx.com/stock-information/stock-quote-chart;
杨欣雨,杨方,徐洪《IL-17A调控肺纤维化研究进展》,Health Protection and Promotion,Apr.2023,Vol.23,Io.8;
https://mp.weixin.qq.com/s/EwbXZN77rPwapjFYdRexVQ;等等。
想要解锁更多药企信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药企公司基本信息、投融资情况、产品管线分布、药物销售情况与各维度分析、药物研发情况、年度报告、最新进展动态、临床试验信息、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!

<END>

















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论