摘要:随着MAH制度的全面实施,药品技术转移越来越被企业和各监管机构重视和关注,但目前国内还未设立针对药品技术转移的法规或指导原则,相关文献报道也较少,多数企业未建立完善的制度和体系去指导如何实践药品的技术转移。本文聚焦药品研发到生产的技术转移过程,通过梳理国内外关于药品生产技术转移的法规,探讨技术转移的分类及实施步骤,结合技术转移的共性问题提出分析方法转移、技术转移风险评估、转移资料交接过程的思考。为监管和企业实施技术转移提供依据。
关键词:技术转移;MAH;过程控制
引言
药品技术转移作为药品生命周期中不可或缺的重要部分,直接关系到产品的安全性、有效性和质量可控性。目前,国内还未设立针对药品技术转移的法规或指导原则,相关文献报道也较少。企业应当始终贯彻“质量源于设计”的理念,建立基于风险和科学的流程和方法设计,最终实现产品受控和数据完整性。结合我公司的具体情况,如各类仿制药新品开发、一致性评价等环节均涉及技术转移情况,本文针对药品技术转移的法规要求和具体实际过程进行了梳理,为提升公司产品质量管理提出建议。
1、技术转移的相关法规介绍
2、技术转移的分类及实施步骤
药品技术转移,是指把实验室研究开发阶段已经确立,但仅适用于实验室规模产品的技术成果向商业化生产转化。技术转移的内容包括处方工艺、中控项目、原辅包和成品标准、检验方法及其它与产品质量相关联的技术、知识等。随着中国MAH制度的实施,越来越多的企业选择将部分药品研发则委托给专业的CRO,导致研究所进入公司生产车间产生二次转移,从而导致技术转移过程越发复杂[1]。按照涉及主体不同,技术转移大体可以分为以下几类(表2)。以同一公司研究所转移至生产车间为例,具体流程主要为:成立技术转移项目组,召开项目转移启动会,指定项目组长。确定需要转移的文件清单。由接收方根据风险评估结果制定,理清转出方和转入方任务清单。实施中试/工艺验证并形成工艺验证报告。工艺验证通过及完成注册申报/申请备案要求的稳定性研究后,按照《化学药品新注册分类申报资料要求(试行)》、《ICH M4人用药品注册通用技术文档》及相关指导原则等要求准备申报/备案资料待资料确认完整无误后进行注册申报或备案。现场核查、技术审评均通过后获得生产批文或完成备案,最终完成资料移交,正式生产。具体流程图参考如图1所示。
3、技术转移的过程控制及思考
3.1重视技术转移的共性问题
在研发产品首次进车间前进行充分的风险评估[2],根据产品的溶解性,研究更适宜产品特性的清洗方式,加强各部门之间的沟通和协作,确保按照正确的清洁验证程序清洗,取水取样器具无污染,关注工艺的合理性和过程控制,分析方法验证和转移的合规性并重视技术转移过程中的人员培训。
3.2分析方法转移方式的思考
分析方法转移的方式通常分为4种:比对测试、两个或多个实验室共同验证、再验证和转移豁免[3]。
3.3技术转移过程中的风险评估管理
在技术转移期间,通常会伴随着变更的发生,变更的范围经常包括物料、设备、质量标准和生产工艺。变更控制是知识管理的重要组成部分,企业应建立适当的变更管理系统,并在项目结束报告中总结相关变更的原因、过程、依据及评估结论。对于合并入工艺或系统中的变更均应清楚记录。变更管理应当确保变更能够按照流程进行追踪、评估、实施和记录。充分的变更控制能够对技术转移过程中的一些调查性工作提供支持。所有关键工艺参数及质量参数必须加以控制,以确保最终药品的质量得到支持。在使用新设备时,通常使用中试批次来收集初始信息,同时最大程度地减少原辅料的使用。设计这些批次时要考虑最终的规模/设备,这一点很重要,有可能中试批次摸索出的工艺参数在商业化规模生产中并不适用,需要重新确定参数。中试批次还可用于解决转移风险评估中确定的差距。团队应共同制定取样方案,包括取样计划、样品需要进行哪些测试以及将样品送到哪个实验室进行检测等。
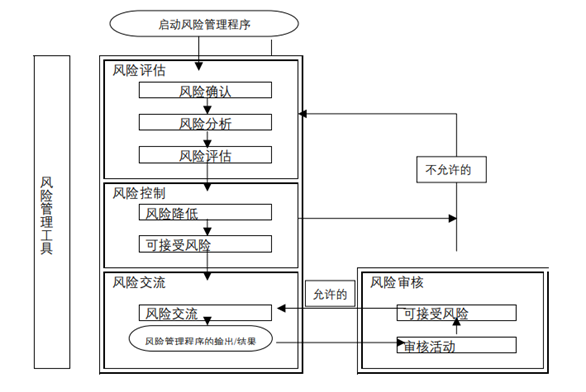
我公司设计的中试、工艺验证过程中的综合评估表包括以下内容(表5),通过找出转出方和转入方在人员、设备、物料、生产工艺和清洁方法、环境、检测等方面的差距和不同,评估对技术转移的影响并给出相应的对策。可参考ICH Q9给出的风险评估方法对以上方面进行评估(图2),找出关键风险点并给出相应的对策[4]。
图2 ICH Q9质量风险管理程序总览
3.4 技术转移资料的移交工作
获得生产批文或完成备案后,研究所应将注册批、工艺验证批等代表批次相关资料如批记录、检验报告、工艺验证方案、工艺验证报告等;申报资料;委托第三方进行研究的相关方案、报告等;批件及附件交技术科存档。根据生产批文、相关附件及移交的其他文件资料等,技术科制订正式的工艺规程,QA制订质量标准等文件。技术科召开生产协调会,准备获批后的首次生产。
技术科负责协调安排各部门工作,药研所、车间、QA、QC配合。生产过程中,药研所工艺研究人员应指导车间操作人员操作,必要时由车间提出再次培训要求;药研所质量研究人员指导QC分析人员分析检测。获批后的首次生产结束后,涉及生产相关部门要将生产时的情况进行汇总。确保转移工作顺利完成。
4. 总结与展望
药品生产技术转移是一个极其复杂的过程,知识和经验的传递是关键要素,传递过程以文件为载体,这些文件包括了药品的生产工艺、控制策略、工艺验证方法,除了在技术转移过程中发生重要作用,在日后的商业化生产和持续性工艺优化过程中,也是重要的参考。参与技术转移的各方应加强对技术转移工作的认识,充分掌握现有药品法律法规,优化技术转移流程,积极有效的应对医药改革带来的机遇与挑战,充分保证我司药品的安全、有效和质量可控。
参考文献
[1]李力,丁满生,路慧丽等.基于风险评估的
技术转移及其管理[J]. 中国医药工业杂志,2020,51(6):795-800
[2]《药品上市许可持有人制度试点方案》政策解读[J].中国制药信息, 2016(9): 10-11
[3]国家药典委员会,《中华人民共和国药典》2020年版 9100分析方法转移指导原则[S].北京:中国医药科技出版社,2020.
[4] 国家药品监督管理局药品审核查验中心.关于公开征求《药品共线生产质量管理指南(征求意见稿)》意见的通知[EB/OL].(2021-11-12).http://www.cfdi.org.cn/ resource/news/ 14085.html
<END>

















收藏
登录后参与评论