
关于糖尿病
国际糖尿病联盟(International Diabetes Federation,IDF)2021年全球糖尿病地图显示,2021年全球成年糖尿病患者数量达到5.37亿例,全球约1/10的成年人受到影响。与2019年相比,糖尿病患者增加了7400万例,增幅达16%。预计到2025年,糖尿病患病率将进一步上升至12.2%,患病人数将增加到7.83亿例。2021年约有670万人死于糖尿病或糖尿病并发症,占到了全因死亡人数的12.2%。糖尿病在全球范围内造成的医疗卫生支出将近1万亿美元,占总医疗卫生支出的9%。
中国是成人糖尿病患者最多的国家,过去的10余年间(2011至2021年),我国的糖尿病患者由9 000万例增加至1.4亿例,增幅达56%,其中约7 283万例患者尚未被确诊,比例高达51.7%。另外,约有1.7亿成人伴有糖耐量受损,约2 700万成人伴有空腹血糖受损,这些人群都是糖尿病人群的“后备军”。预测到2045年,中国糖尿病患者数量将达到1.744亿例。
关于肥胖
与糖尿病同为代谢疾病的肥胖症是指机体脂肪总含量过多和/或局部含量增多及分布异常,是由遗传和环境等多种因素共同作用而导致的慢性代谢性疾病。《中国居民营养与慢性病状况报告(2020年)》显示:我国成年居民超重肥胖超过50%;成年人(≥18岁)中超重和肥胖比率分别为34.3%和16.4%。
我国是全球肥胖人口最多的国家,且呈现逐渐上升趋势。肥胖可以导致一系列并发症或者相关疾病,进而影响预期寿命或者导致生活质量下降。在较为严重的肥胖患者中,心血管疾病、糖尿病和某些肿瘤的发生率及死亡率明显上升。肥胖症是需要长期治疗的慢性疾病,目前缺乏长期有效且安全的治疗手段。
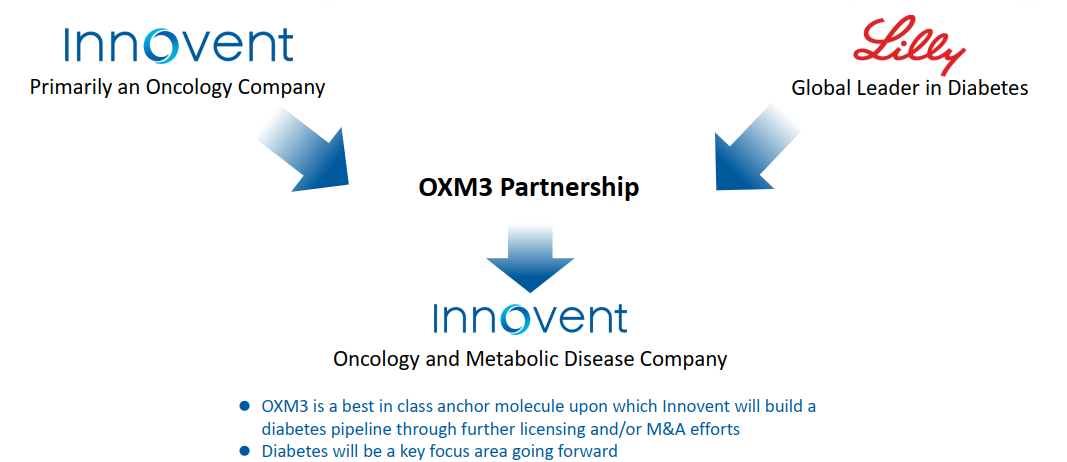
信达生物、礼来制药共同合作开发GLP-1类新药
药融云数据(vip.pharnexcloud.com/?zmt-mhwz)显示:2019年8月,信达生物制药与礼来制药达成一项合作协议,信达生物在中国(中国大陆、香港、澳门和中国台湾地区)开发一款胃泌酸调节素创新化合物(OXM3),是具有同类最优潜力的胰高血糖素样肽-1(GLP-1)和胰高血糖素受体双重激动剂分子LY 3305677。该协议的具体条款尚未披露,信达亦就此机会深度布局代谢疾病领域。(胰高血糖素样肽-1受体(glucagon-like peptide-1 receptor, GLP-1R)/胰高血糖素受体(glucagon receptor, GCGR)双激动剂,信达方面研发代号:IBI362,mazdutide)

2019年08月合作展示PPT
IBI362(mazdutide)是一款与哺乳动物OXM类似的长效合成肽(OXM3),是具有同类最优潜力的GLP-1R和GCGR双重激动剂分子。IBI362利用脂肪酰基侧链延长作用时间,允许每周给药一次。作为OXM类似物,IBI362的作用被认为是通过GLP-1R和GCGR的结合和激活介导的。GLP-1/GCGR的双重激活有望带来多种代谢和心血管益处, 包括:1) 血糖降低和减重;2) 血压和血脂改善;3) 改善肝脂肪堆积、 炎症和纤维化;4) 潜在心血管风险降低。通过开发同时激动多个与代谢相关的靶点来治疗代谢性疾病是目前国际上新药研发最新的趋势。
IBI362药物基本信息
截图来源:药融云全球药物研发数据库

GLP-1/GCGR双重激动效应(文献DOI:10.1111/joim.12837)
拟打造的降糖爆品:IBI362进展

https://investor.innoventbio.com/cn/investors/webcasts-and-presentations/
IBI362适应症研发现状
截图来源:药融云全球药物研发数据库
肥胖:
2022年9月初,IBI362(mazdutide)在中国肥胖受试者中的II期临床研究高剂量 (9.0 mg) 队列完成首例受试者给药。本研究(ClinicalTrials.gov, NCT04904913)是一项在中国超重或肥胖受试者中评估mazdutide疗效和安全性的随机、双盲、安慰剂对照的II期临床研究。
低剂量队列(3.0 mg、4.5 mg和6.0 mg)结果于2022年6月披露。第24周时,与安慰剂相比,mazdutide各剂量均展现出显著的减重疗效,且呈现剂量依赖性,并能为受试者带来多重心血管代谢获益;同时,mazdutide耐受性良好,整体安全性特征与同类药物相似。此外,在Ib期研究(ClinicalTrials.gov, NCT04440345)中,mazdutide滴定至9 mg展现出良好的安全性特征,和优于低剂量组的疗效,用药12周后,体重降幅可达11.7%。基于以上结果,申办方在肥胖患者(BMI≥30 kg/m2)中开展mazdutide高剂量(9.0 mg)的疗效和安全性研究。9.0 mg队列计划纳入80例受试者,按3:1的比例随机接受mazdutide 9.0 mg或安慰剂治疗24周。研究的主要终点是第24周时受试者体重相对基线的百分比变化。
降糖:
2022年7月19日,信达生物宣布:胰高血糖素样肽-1受体(glucagon-like peptide-1 receptor, GLP-1R)/胰高血糖素受体(glucagon receptor, GCGR)双重激动剂mazdutide (研发代号:IBI362) 在中国2型糖尿病受试者中的一项多中心、随机、安慰剂/度拉糖肽对照的II期临床研究达到主要终点。
此项研究(ClinicalTrials.gov, NCT04965506)旨在评估mazdutide在经至少3个月生活方式干预伴或者不伴稳定剂量二甲双胍治疗后糖化血红蛋白(HbA1c)仍不达标的中国2型糖尿病受试者中的有效性和安全性。共入组252例受试者,随机接受mazdutide 3.0 mg、4.5 mg或6.0 mg、安慰剂或度拉糖肽1.5 mg,每周一次皮下注射给药,连续给药20周(含4周或8周滴定期)。研究主要终点为与安慰剂相比,连续给药20周后HbA1c较基线的变化。各组受试者平均糖尿病病史为4.0~5.7年,HbA1c基线平均值在7.94%~8.16%之间。
与安慰剂相比,mazdutide各剂量组均能显著降低受试者HbA1c水平(与安慰剂组相比, p值均小于0.0001)。给药20周后,mazdutide各剂量组HbA1c水平较基线变化的最小二乘均值分别为−1.41%(95%CI:−1.70, −1.13;3.0 mg)、−1.67%(−1.95, −1.39;4.5 mg)和−1.54%(−1.83, −1.25;6.0 mg),度拉糖肽1.5 mg组为−1.35% (−1.63, −1.07),安慰剂组为0.03% (−0.25, 0.31);Mazdutide组HbA1c < 7.0%的受试者比例分别为62.8%(3.0 mg)、74.4%(4.5 mg)和78.3%(6.0 mg);度拉糖肽1.5 mg组为69.8%,安慰剂组为20.0%。
在受试者的体重管理方面,与安慰剂相比,mazdutide各剂量均可显著降低体重,且呈现剂量依赖性。给药20周后,Mazdutide 6.0 mg组体重较基线百分比变化的最小二乘均值为−7.14%(95%CI:−8.49, −5.79),度拉糖肽1.5 mg组为−2.69%(−4.02, −1.37),安慰剂组为−1.38%(−2.70, −0.06),与度拉糖肽组和安慰剂组相比,p值均小于0.0001;mazdutide 6.0 mg 组HbA1c<7.0%且体重较基线下降≥5%的受试者比例高达52.2%(度拉糖肽1.5 mg组为14.0%,安慰剂组为0%)。
GLP-1类新药部分在研情况
药融云数据显示:目前国内布局GLP-1类新药(含多靶点)的企业有:恒瑞医药、豪森药业(翰森制药)、先为达、华东医药及道尔生物、锐格医药、众生睿创、信达生物、奥达生物、硕迪生物、北京质肽生物、甘李药业、安源医药、博瑞医药、石药集团、东阳光、银诺医药、仁会生物、鸿运华宁、闻泰医药、华健未来、诺泰生物、派金生物、昂博制药、禾泰健宇、赛诺生物、麦科奥特、北京东方百泰生物、恒诺康、晟斯生物、乐普医疗、诚益生物、领康Leadermed、派格生物、惠升生物、和煦加医药、中晟全肽、常山生化/常山凯捷健生物等。
此外,不少国内制药企业在开发GLP-1仿制药/生物类似药:如丽珠医药、华东医药、乐普医疗、联邦制药、通化东宝、翰宇药业等等。
友情提示:GLP-1类药物使用谨遵医嘱,勿超适应症使用。
此文仅用于向医疗卫生专业人士提供科学信息,不代表平台立场
参考:
NMPA/CDE;
药融云数据,vip.pharnexcloud.com/?zmt-mhwz;
FDA/EMA/PMDA;
相关公司公开披露;
Recent updates on GLP-1 agonists: Current advancements & challenges;
信达生物 | www.innoventbio.com;
合作协议披露https://investor.innoventbio.com/media/1109/exclusive.pdf;
Ji L, Jiang H, An P, et al. (2021) IBI362 (LY3305677), a weekly-dose GLP-1 and glucagon receptor dual agonist, in Chinese adults with overweight or obesity: A randomised, placebo-controlled, multiple ascending dose phase 1b study. EClinicalMedicine 39: 101088. 10.1016/j.eclinm.2021.101088;
基于临床的肥胖症多学科诊疗共识(2021年版).中华内分泌代谢杂志, 2021,37(11) : 959-972;
https://lillyscience.lilly.com/congress/ada2021;
信达生物2022年度中期业绩汇报_管线进展附录,https://investor.innoventbio.com/cn/investors/webcasts-and-presentations/;
一图看懂 | 信达生物2022半年度业绩进展;等等。
<END>






































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论