
2019年11月,国家药监局药品审评中心组织起草了《突破性治疗药物工作程序》。突破性治疗药物资格认定,是为加快开发针对严重疾病、且已在前期临床试验中显示疗效或安全性方面显著优于现有治疗手段的新药而设计。获得资格认定能够使新药获得CDE快速审评待遇,从而加快药物研发进程,更早解决中国病患未满足的临床需求。
据药监局发布的《2021年度药品审评报告》显示,2021年,有53件(41个品种)注册申请纳入突破性治疗药物程序,覆盖了新型冠状病毒感染引起的疾病、非小细胞肺癌、卵巢癌等适应症。
而截至今年8月31日,2022年目前已有32个药品品种被纳入突破性治疗名单,包括圣和药业的SHC014748M胶囊,百济神州的BGB-3111胶囊、注射用ZW25,正大天晴的TQB2450注射液,信达生物的信迪利单抗注射液、IBI310,再鼎医药的Repotrectinib胶囊,诺华的OAV101注射液,科伦博泰的注射用SKB264等。
2022年纳入突破性治疗品种名单汇总
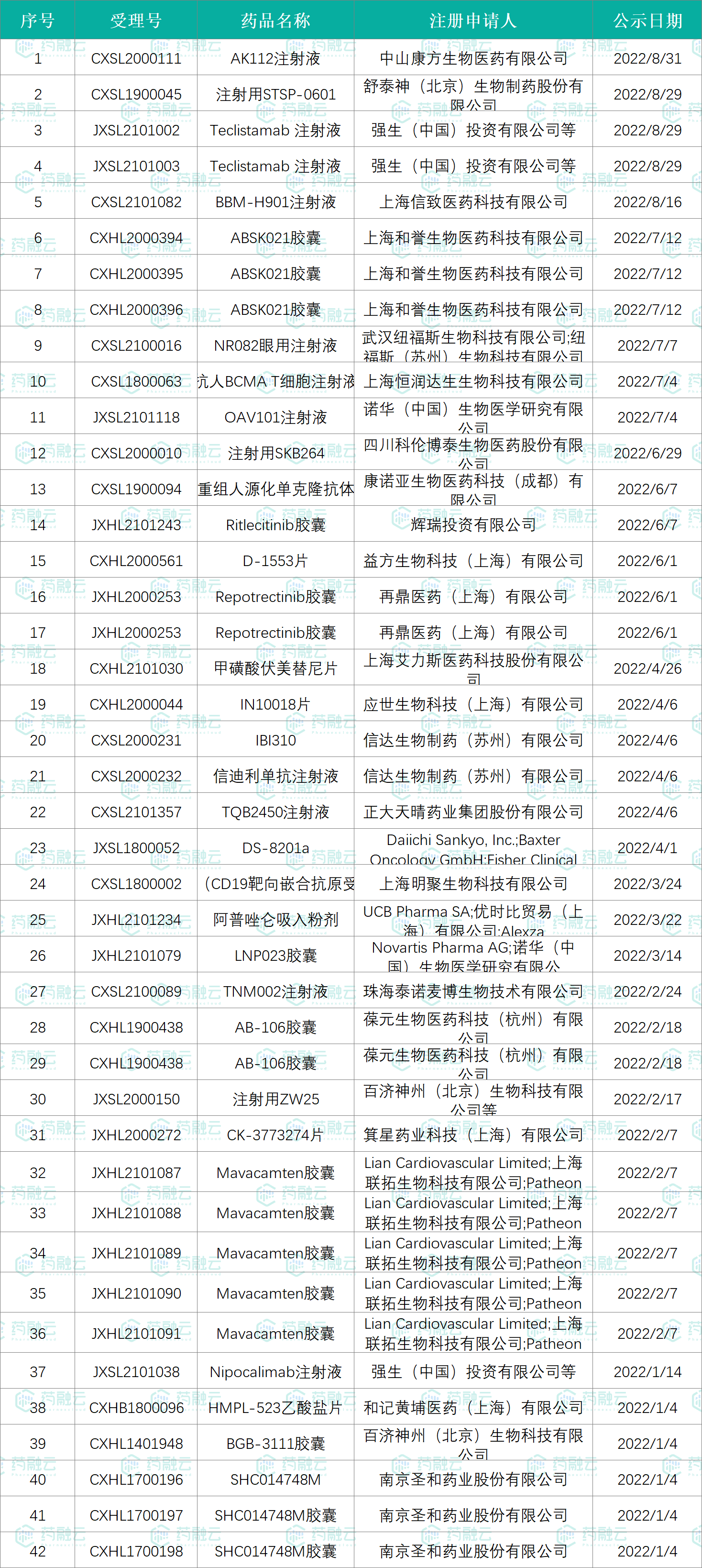
数据整理自:NMPA优先评审公示信息
在鼓励以临床价值为导向的药物创新,加快具有突出临床价值的临床急需药品上市的政策红利大背景下,越来越多的新药被纳入突破性治疗品种名单。其中,8月就有4个药品纳入突破性治疗名单,将加速它们在国内的上市进程。
1.信致医药——BBM-H901注射液
BBM-H901注射液,是上海信致医药科技有限公司(信念医药全资子公司)自主研发的一款用于预防血友病B(先天性凝血因子Ⅸ缺乏症)成年男性患者出血的AAV基因治疗在研药物。通过静脉给药将人凝血因子IX(Factor IX, FIX)基因导入血友病B患者体内,从而提高并长期维持患者体内凝血因子水平,以期达到“一次给药、长期有效”的治疗及预防出血效果。
BBM-H901是国内最早开展临床试验的AAV基因疗法之一,目前全球最高研发阶段为Ⅲ期临床阶段。其临床研究数据显示,该药具有良好的安全性和有效性,AAV基因治疗药物输注后患者体内凝血因子水平提高显著,并长期稳定,且在临床期间未发现明显的不良反应,患者的年化出血率(ABR)显著降低。
BBM-H901基本信息(部分,搜索"药融云小程序"进行相关更多数据查询)

图片来源:药融云全球药物研发数据库
血友病(Hemophilia)是一类X染色体连锁的隐性遗传性出血性疾病,可分为血友病A及B两种亚型。血友病B由凝血因子IX(FIX)基因缺陷引起,患者绝大部分是男性,发病率大约为2.5万分之一,临床表现为关节、肌肉及深部组织的出血等。
目前,血友病B的治疗方法主要通过每周多次输血补充凝血因子,可选用血浆、凝血酶原复合物(PCC)、FIX浓缩物和重组FIX制品等,但部分患者长期注射凝血因子IX会导致体内出现凝血因子抑制物,以致凝血因子失活,并诱发更严重的出血事件。因此,长期输注凝血因子IX不仅可能引起严重不良反应,而且给患者造成很大的经济负担。
据药融云全球药物研发数据库显示,除了BBM-H901,目前全球还有多款在研血友病B基因疗法。比如CSL公司的etranacogene dezaparvovec(CSL-222,AMT-061,AMT-060),当前进展最快,在美国、欧盟已处于上市申请阶段;辉瑞的SPK-9001处于III期临床阶段;天泽云泰的VGB-R04处于II期临床阶段;Freeline公司的FLT180a也同样处于II期临床阶段。
CSL-222全球研发详情展示(部分)

图片来源:药融云全球药物研发数据库
值得一提的是,VGB-R04于2021年12月被FDA授予孤儿药认定,用于治疗血友病B。这是首个中国自主研发用于血友病B的体内基因治疗产品获得美国FDA孤儿药认定。
VGB-R04是天泽云泰研发的首个AAV基因治疗产品,静脉注射后通过AAV衣壳蛋白介导的肝脏细胞转导,将VGB-R04表达盒递送至细胞核。VGB-R04表达盒以游离DNA的形式存在,在肝脏细胞中表达凝血因子Ⅸ高活性天然变体(hFIX Padua)蛋白。肝脏表达并分泌入血的hFIX Padua蛋白替代缺失的先天性凝血因子IX发挥作用,从而纠正血友病B患者的凝血障碍。
VGB-R04基本信息(部分)
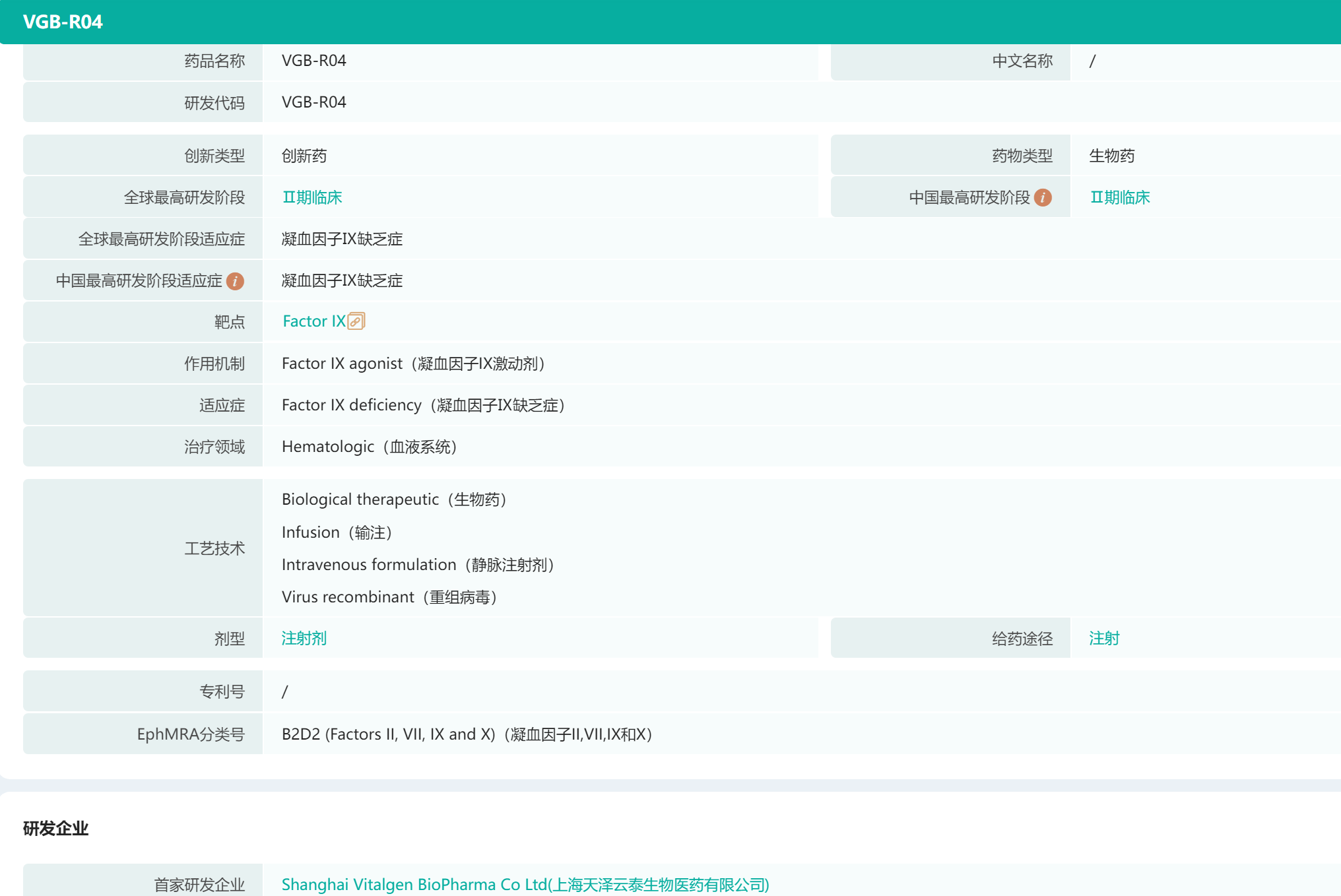
图片来源:药融云全球药物研发数据库
2.舒泰神——注射用STSP-0601
舒泰神的注射用STSP-0601也是一款治疗血友病的药物,用于伴有抑制物的血友病A或B患者出血按需治疗。据药融云中国临床试验数据库显示,注射用STSP-0601于2021年8月完成伴抑制物患者的I期临床试验(CTR20191930),安全性和耐受性良好;同年9月,又启动了注射用 STSP-0601 Ib/II期临床试验(CTR20211762),目前处于II 期临床试验阶段。
2022年7月,国家药监局同意受理了其新增适应症“不伴抑制物的血友病A或B患者出血按需治疗”的临床试验申请。
注射用 STSP-0601 Ib/II期临床试验基本信息(部分)

图片来源:药融云中国临床试验数据库
舒泰神是目前国内少数专注补体靶向药物的生物制药企业,在C5/C5aR赛道上是名副其实的领先者。据药融云数据库显示,其BDB-001是国内研发进展最快的C5/C5aR靶向药物,其治疗新型冠状病毒感染适应症已在西班牙、印度、印尼、孟加拉国等多国开展国际多中心临床试验,目前已进入临床III期末尾。
3.强生——Teclistamab 注射液
Teclistamab注射液是强生(Johnson & Johnson)旗下的杨森(Janssen)公司研发的1类生物新药,一种以B细胞成熟抗原(BCMA)和T细胞CD3受体为靶点的双特异性抗体,用于治疗既往至少接受过3线治疗的复发或难治性多发性骨髓瘤成人患者,其既往治疗包括一种蛋白酶体抑制剂(PI)、一种免疫调节剂(IMiD)和一种抗CD38单克隆抗体。
BCMA是肿瘤坏死因子受体(TNF)超家族成员,在多发性骨髓瘤细胞上表达水平显著升高、CD3参与激活T细胞。Teclistamab将CD3 T细胞重新定向到表达BCMA的骨髓瘤细胞,以诱导针对靶细胞的细胞毒作用。临床前研究结果表明,Teclistamab可杀死来自过度预治疗患者的骨髓瘤细胞。目前,在国内处于III期临床阶段(CTR20221039)。
Teclistamab注射液国内临床试验信息(部分)

图片来源:药融云中国临床试验数据库
近日,强生宣布欧盟委员会(EC)已批准TECVAYLI®(Teclistamab)作为单一疗法用于治疗复发和难治性多发性骨髓瘤(RRMM)成年患者,成为首款获批治疗多发性骨髓瘤的双特异性疗法,也是首款获批靶向BCMA的双特异性抗体,为难治性患者提供了一种“现货型”治疗手段。
多发性骨髓瘤 (MM) 是第二常见的血液恶性肿瘤,约占所有癌症患者的1%,占血液系统癌症的10%,其特征是骨髓中出现产生抗体的恶性浆细胞浸润。目前,FDA已批准了多款新型治疗MM的药物,主要包括4大类,分别是蛋白酶抑制剂(如硼替佐米、卡非佐米、伊沙佐米)、免疫调节剂(如来那度胺、沙利度胺、泊马度胺)、单抗类药物(如Daratumumab 、Elotuzumab)和组蛋白脱乙酰酶抑制剂(如帕比司他)。
多发性骨髓瘤全球批准上市治疗药物(部分)

图片来源:药融云全球药物研发数据库
在国内已获批上市的多发性骨髓瘤 (MM)适应症的药物有10个,用于不同亚型病人,例如葛兰素史克的Blenrep(belantamab mafodotin,GSK2857916)、Onys制药公司的Carfilzomib(商品名Kyprolis)、杨森的Daratumumab、Millennium制药公司的Ixazomib Citrate等。
4.康方生物——AK112注射液
AK112注射液(依沃西)是康方生物的核心产品之一,是一款新型肿瘤免疫治疗药物,也是一款PD-1/VEGF双特异性抗体,用于一线治疗PD-L1表达阳性(TPS≥1%)的局部晚期或转移性非小细胞肺癌(NSCLC)。其适应症涵盖非小细胞肺癌、复发性卵巢癌、妇科肿瘤等。
AK112注射液中国临床试验数据
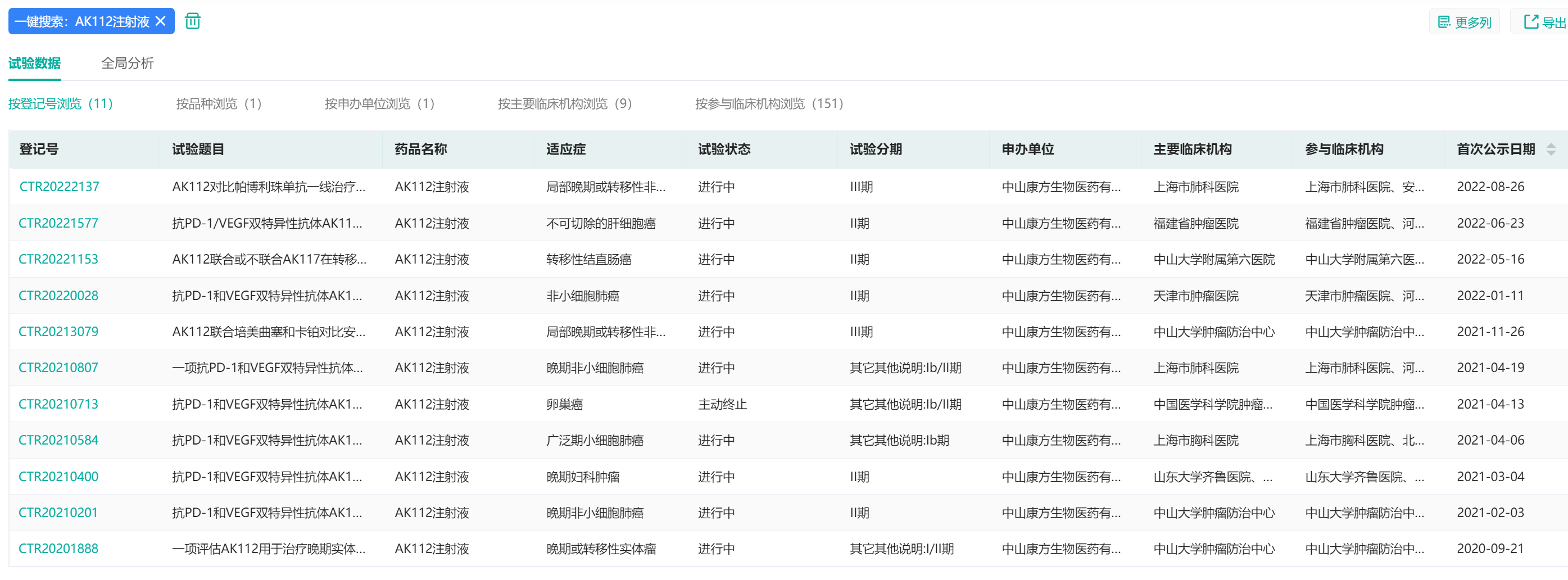
图片来源:药融云中国临床试验数据库
依沃西是康方生物继开坦尼®(卡度尼利)之后,又一个被CDE纳入突破性治疗品种名单的双抗新药。开坦尼®是康方生物研发的PD-1/CTLA-4双抗新药,是全球第一个获批上市的肿瘤双免疫检查点双抗。
目前,依沃西已有2项临床研究处于III期阶段,包括依沃西单药对比帕博利珠单抗单药一线治疗PD-L1表达阳性的NSCLC的III期临床研究,以及依沃西联合化疗治疗EGFR-TKI耐药的EGFR突变的NSCLC的III期临床研究。
想要解锁更多药企创新药信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药企创新药产品布局、药物基本信息、研发阶段、最新进展、申报获批情况、临床试验信息、市场规模与前景等数据!注册立享15天免费试用和虎年首份医药数据大礼包!

<END>

















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论