
中国医药出海已由传统中药、原料药、仿制药,跨进创新药出海时代。
2020年,中国创新药已迈入“出海”爆发期。
一、现状
据BCG分析,国际领先药企海外收入平均占比都超过60%,我国领先药企海外营收只占15%。
2021年,日本武田海外营收占比高达82%(图一),法国赛诺菲、英国阿斯利康(欧洲之外占比)和美国辉瑞海外占比也都超过了60%,分别为74%、70%和63%。瑞士罗氏(含非药品)和美国默沙东海外占比也都超过了一半,分别为58%和54%。
我国只有复星医药的海外占比高些,为35%,主要由复必泰(mRNA新冠疫苗)在港澳台地区的收入以及境外子公司Gland Pharma和复锐医疗科技(Sisram)的销售所贡献。
石药集团和人福医药的国际占比刚超过10%,分别为13%和11%。恒瑞的国际营收只占2%。
目前,我国药企海外营收占比还很小,如果去除海外授权的收入,单纯创新药的海外营收占比就更小。

二、原因
- 1、国内:同质化+灵魂砍价
我国医药研发同质化严重,医保谈判灵魂砍价致药价降低,创新药回报堪忧。
- 2、海外市场大
全球创新药销售主要集中在美国、欧洲及日韩等发达市场。
2021年,美国占了全球创新药市场的一半以上(55%)(图二),欧洲5国(英法德意及西班牙)占了近1/6(16%),日韩合计占8%,我国只占3%。除上述发达国家外,“一带一路”国家等新兴市场也不容小觑。6月14日,信达的达攸同在印尼获批。

- 3、海外药价高
美国是药价最贵的国家,据BCG分析,以目前全球最畅销的25个药品为例,如果以美国药价为100%的话(图三),欧洲13国的药价都只有其1/6~1/4(15%~26%),欧洲药价最贵的德国,药价也只有美国的26%。除阿联酋(为美国的26%)和日本(为美国的22%)外,其他国家的药价都低于美国的1/5,如沙特、阿根廷、巴西和澳大利亚的药价分别只有美国的19%、18%、16%和15%。
创新药在第一上市国的定价决定了在其他国家的价格,美国不但创新药市场规模大而且药价最高,这就是药企出海首选美国的原因。
我国的药价更低,只相当于美国的1/10、其他国家的40%~66%。

国内新药研发同质化,药价又低,海外创新药市场不但规模大而且药价高,创新药出海势在必行。
三、条件
在国务院发布44号文(2015年)、加入ICH(2017年)、新《药品管理法》颁布(2019年)等新政保障,港交所18A和科创板等资本的加持下,我国创新药研发得以快速发展。
创新药“出海”虽屡遭碰壁,但也不乏好消息,继2019年百济神州的泽布替尼首获FDA批准,实现我国创新药出海零的突破后,今年2月,传奇生物的CAR-T疗法——西达基奥仑赛又获FDA批准(传奇生物CAR-T获FDA批准!中国首个进入美国市场的细胞疗法药物)。
2022年上半年,至少有51家中国创新药企推进“出海”业务。5月18日,恒瑞医药宣布设立全资子公司,大举进军海外市场。
- 1、获批新药多
要想出海,必须有足够多且质量高的创新药获批上市。
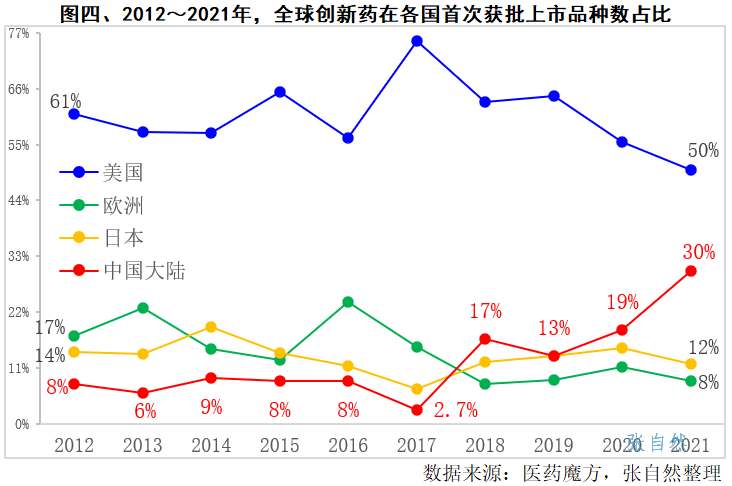
10年前的2012年,我国首次批准上市的创新药只占全球的8%(图四),到2018年之前的六年间都没变化,2018年开始陡然上升,到去年(2021年),我国首次批准上市的创新药已经占到了全球上市新药总数的近1/3(30%),并超过欧洲和日本,跃居全球第二位。
- 2、国际多中心临床试验增多
截至目前,除百济神州的泽布替尼和传奇生物的CAR-T细胞疗法已获美国FDA正式批准外,我国自主研发的创新药还都处于临床试验阶段。
2017年5月底,我国正式加入ICH(国际人用药品注册技术协调会),监管体系与国际接轨,国内外临床试验数据互认,大幅加快了我国开拓海外临床试验的进度。
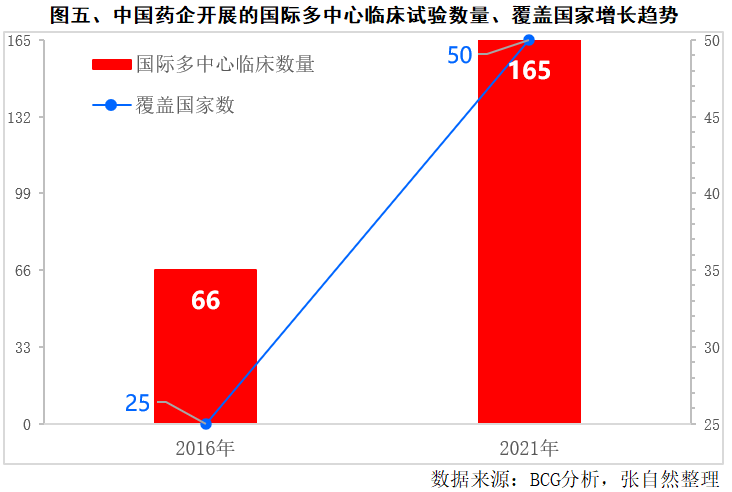
我国药企开展的国际多中心临床试验已由2016年的66个增加到了2021年的165个,增加了1.5倍(图五),覆盖的国家也增加了1倍,由2016年的25个增加到了2021年的50个国家和地区。
截至去年上半年,有9个国产1类新药处于全球Ⅲ期临床阶段,共计41项临床试验。(图六)
百济神州的泽布替尼胶囊(百悦泽)已在全球28个市场开展了35项临床试验,百济神州还有100多项临床研究正在进行或筹备中,试验已覆盖45个国家/地区。
今年5月12日,由13个国家和地区95家中心共同参与的,恒瑞的两个创新药卡瑞利珠单抗联合阿帕替尼片的国际多中心III期临床试验,达到预设优效标准。
亿帆医药的贝格司亭在美国和欧洲开展的两个III期临床试验分别于2018年1月和2020年6月完成,均达到预设目标。
贝达药业的恩沙替尼一线治疗全球多中心的III期临床试验还在进行中。
和记黄埔的沃瑞沙®(赛沃替尼)与阿斯利康的泰瑞沙®(奥希替尼)联合疗法全球III期临床试验,将于2022年年中开始患者招募。

- 3、逐渐被认可
License-out是指企业进行药物早期研发,然后将项目授权给其他药企做后期临床研发和上市销售,按里程碑模式获得各阶段临床成果以及商业化后的一定比例销售分成的合作模式。
近年来,我国通过License-out将创新药权益授权给国外药企的交易不断增多,也意味着国际药企对我国新药研发能力的肯定,成为创新药出海的最大依仗。
我国License-out交易数量已由2017年的12件增加到了2020年的72件(图七),2020年一年的交易数量比之前三年的总和还多,2021年略有下降,为53件,但交易金额仍继续增加,由2020年的125亿美元增加到了2021年的145亿美元,增长了16%。

- 16年前(2006年),鲁先平博士创建的微芯生物将西达本胺海外权益以2800万美元转让给沪亚生物,实现了我国创新药出海“零的突破”。
- 15年后(2021年),同样是授权给沪亚,但交易额提升了10倍,左敏总裁领衔的上海医药将SPH6162海外权益以2.925亿美元转让给沪亚生物(HUYA Bio)。(图八)
近年来,我国创新药license out的单项交易总额屡创新高。
- 2021年8月,房健民博士创立的荣昌生物与Seagen达成全球独家许可协议,共同开发和推广荣昌生物的抗体偶联药物——维迪西妥单抗,荣昌生物获得26亿美元的潜在收入。
- 2021年12月,百济神州将在研新药ociperlimab独家授权给诺华,交易总额为28.95亿美元,创license out交易额之最。
饱受内卷之困,并因纳入医保而两遭“灵魂砍价”的4款国产PD-1悉数出海。
- 2021年1月,百济神州与诺华就在多国共同开发PD-1(替雷利珠单抗,百泽安)达成协议,并获得22亿美元款项。
- 2021年2月,君实生物将PD-1(特瑞普利单抗,拓益)在美国和加拿大的开发和商业化与Coherus达成合作,并获得11.1亿美元款项。
- 2020年4月,恒瑞将PD-1(卡瑞利珠单抗,艾瑞卡)在韩国的权益以8775万美元授权给韩国Crystal Genomics公司。
- 2020年8月,信达生物将PD-1(信迪利单抗,达伯舒)的海外权益以10亿美元授权给礼来。

近年,我国创新药获批上市、开展的国际多中心临床试验、创新药海外授权数量以及交易额都在不断增加,我国创新药出海正在加速。
四、方式
BCG分析经充分调研,对创新药出海总结如下。
1、出海模式:海外授权/许可输出仍是创新药出海的主要途径,商业国际化是发展方向,包括多国尤其美国患者在内的国际多中心临床试验或成为出海必备条件,差异化的产品、扎实的临床/注册能力、适合的商业化模式和国际化人才储备将是创新药出海的制胜因素。百济神州已在美国自建~200人的商业化团队,负责泽布替尼(BTK)的在美销售,和记黄埔在美国将建立84人的商业化和医学事务团队,支持索凡替尼和呋喹替尼上市。
2、出海市场:BIC/FIC产品首选发达市场,Me-too/Me-better要根据产品创新程度和上市时间平衡美国、欧洲和其他市场的投入。
3、出海合作伙伴:成熟市场应优先选择大型跨国药企,新兴市场应同时考虑当地龙头。
我国创新药研发正在不断增量、提质,并集群出海,创新药回报可期。
相关阅读:
<END>











































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论