
综述:分析方法验证的目的是证明我们建立的方法适合于相应的检测要求,在建立药品质量标准、变更药品生产工艺或制剂组分、修订原分析方法时需要对分析方法进行验证,通常是在一个项目的合成实验室小试摸索工艺打通且完成了中试后,才会进行分析方法的验证。分析方法验证的过程就是一个解释说明的过程。比如你说你的方法能够准确检测出被测组分中的杂质含量,凭什么能够说明?而分析方法验证的过程就是这样的一个验证过程。
验证的指标有:专属性、准确度、精密度(包括重复性、中间精密度和重现性)、检测限、定量限、线性、范围和耐用性。在分析方法验证中,须全程用标准物质进行试验。
方法验证的内容如下:
一、专属性
专属性系指在其他成分(如杂质、降解产物、辅料乃至溶剂)可能存在的情况下,采用的分析方法能正确测定出被测物的能力。鉴别反应、杂质检查和含量测定方法,均应该考虑方法的专属性。如一种方法的专属性不强,应采用一种或者多种不同原理的方法予以补充。
1、鉴别反应
应能区分可能共存的物质或结构相似的化合物。不含被测成分的供试品,以及结构像是或者组分中的有关化合物,均应呈阴性反应。
2、含量测定和杂质测定
采用的色谱法和其他分离方法,应附代表性图谱,以说明方法的专属性,并应标明诸成分在图中的位置,色谱法中的分离度应符合要求。
在杂质对照品可以获得的情况下,对含量测定,试样中可加入杂质或者辅料,考察结果是否受干扰,并可与未加杂质或者辅料的试样比较测定结果,对于杂质检查,也可以向试样中加入一定量的杂质,考虑杂质之间能否得到分离。所以在做含量方法学或者杂质含量测定时,需要对已知杂质进行单针定位(溶剂、单个杂质均需要进样),以及杂质混合进样定位(注意:有时在进行杂质混合后,发现某个杂质变大或者变小,可能出现了杂质间的相互反应,这时候需要确定是哪两个或者是几个杂质存在相互反应,然后把这几个杂质单独提出来进行研究或者减小进样浓度以及配置后即刻进样来解决,也可由相对保留时间确定彼此间的分离情况),由相对保留时间来确定每个杂质的位置(注意:做专属性试验时,流动相一定要配够)。
3、破坏实验
做专属性实验,绕不开的一个实验就是破坏实验,通过破坏实验,能及时发现一些潜在的讲解杂质或者样品中以后可能会出现的杂质,然后用现有的分析条件去测试,如果破坏实验后的样品经过你目前确认的分析方法实验,发现能够很好的将各种杂质都分开的话,那么说明你的分析方法专属性很强,足够满足以后检样的需求,如果你的分析方法专属性不强的话,很可能发生杂质之间分不开,或者存在严重的包峰,这说明目前的分析方法专属性不强,建议再重新制定分析方法。
做专属性时候有两种情况,第一种就是原料或者制剂样品中存在相关的杂质。第二种就是样品或者制剂样品中不存在相关的杂质。无论是第一种情况还是第二种,在做专属性时候均应进行杂质强降解实验,我们对样品进行光照、紫外、高温、酸碱、氧化、高湿破坏实验,以研究可能的降解产物,同时考察降解途径对含量测定和杂质测定的影响,根据经验,个人建议做破坏的强度以面积百分比法计算,破坏强度为主峰面积下降5%~10%为宜,不应过度破坏,否则会出现次级降解产物,影响研究。在摸索出破坏的实验强度后,我们需要对破坏后的峰进行峰纯度扫描,建议用有DAD检测器或二极管阵列检测器的高效液相进行实验测定,如果提示峰纯度不纯,则提示是你的检测方法的专属性是有问题的,要么是你的检测波长选择有问题,有末端吸收,要么就是有溶剂峰、鬼峰的干扰,如果能排除上面两个原因,那么剩下的就需要考虑你的检测方法是有问题的,破坏后的峰是存在包峰的,当然要想证明你的检测方法专属性更强,还可以配合其他检测器或者用其他的检测方法例如HPLC-MS法。
关于专属性试验我的一些想法:
1、无论是做制剂还是做API的一些项目,只要前期立项确定了,对照品、前期的资料都查阅完毕了,那么首先就是分析方法的开发与摸索,大致确定分析方法。
2、当分析方法开发摸索完毕后,就要做专属性实验了,这也是在检验你的分析方法是否合适的一个重要过程,因为实践是检验真理的唯一标准,分析方法是否专属,和检测分析方法有很大关系。在检测方法中波长的选择、梯度程序的设定、流动相的配比都会极大的影响你的分析方法。
3、在做分析方法开发的过程中,我个人认为是要以目的为导向的,应该是由已知到未知的一个过程。比如我们的目的是摸索一种检测方法,能够将8种物质分开,那么前期方法摸索的目的就是分开这8种物质。当你的方法确定能将这8种物质分开后,再将你的制剂中的辅料加入,看看是否会影响目标峰的检测,确定你的溶剂出疯、空白出峰、梯度峰是否影响目标峰。如果确定了都不会影响你的目标峰那么再进行下一步实验——破坏实验。
4、破坏实验:破坏实验的目的是一是为了确定你的样品对环境中理化条件的敏感程度,为以后的制备、贮存、样品的检测等等环节提供一些参考依据。例如某个样品在5000Lx的光照条件下照射10天,进样后主成分峰未下降,也未产生任何杂质峰,那么提示该样品对光照不敏感,以后在检测该样品配置供试品溶液的时候可以不用避光。还有就是有些样品加入30%的双氧水1mL氧化10h条件下,任然无任何杂质产生,那么我们可以初步认为,这些样品对氧的耐受性比较强。当然在用光照、紫外、强酸、强碱、氧化等常规的破坏手段破坏完你的样品后,任然无法得到很多的讲解产物。那么我个人建议,就不要再为了破坏而破坏了,可以寻找其他的一些辅助手段,去验证你所用检测方法的专属性,例如用近效期的仿制药样品去进样检测、用未精制的API样品去进样都是不错的替代方法。

二、定量限、检出限
在做完专属性时候后,优化相关检测条件后确定了杂质之间能够相互分离,且不影响主成分含量测定的条件后,随后便开始定量限与检出限的实验。
定量限:系指试样中被测物能被定量测定的最低量(最低浓度),其测定结果应符合准确度和精密度的要求(注:具体要求为在规定范围内取同一浓度(是同一浓度但不能是同一份溶液)的供试品,用至少6份样品的测定结果进行评价,以峰面积计算6份样品的RSD%应小于2%,以保留时间计算RSD%应小于0.5%)。个人推荐定量限做法参照《中国药典》2020年版4部通则9101中定量限做法中的第2法:信噪比法。一般以信噪比为10:1时相应浓度或注入仪器的量确定定量限。(注:在写实验记录时候,要详细写出每一步稀释进样后溶液的S/N值,根据每一步的S/N值来计算接下来需要稀释的倍数。要计算出当信噪比为10:1时的进样浓度,以及计算出相应的量。
某物质定量限=10.45mg/100/200*6ml/10ml*20μL/1000*1000*1000=6.27ng)
同理,检出限也用信噪比法,当S/N=3:1时,我们认为此时的浓度为检出限浓度,一般检出限浓度为定量限浓度的0.3倍,具体做法为取定量限容易的溶液3mL到10mL容量瓶然后定容,此时的浓度为检出限浓度。(注:写记录时,要详细计算出定量限浓度及相应的量)
举个栗子:
杂质C的初始试浓度=12.17mg÷10mL×0.2mL÷10mL×1000=23.340µg/ml
对应的杂质C进样后的峰面积(A)=2716589 S/N=1159.5:1 那么还需要稀释多少倍才能到达杂质C的定量限浓度?答案是约需要稀释160倍。因为我们需要杂质C最终的信噪比S/N要约为10:1,那么需要稀释的倍数=1159.5÷10=159.5,即160倍。S/N就是信噪比,S是目标峰的信号高度,N是一段时间内背景噪音峰的信号高度。这是基础知识,主要讲给小白。当然你的基线噪音选取的时间段一定是要平滑的那一段,如果选取基线不平滑的时间段,你的信噪比会非常的小。检出限的试浓度稀释倍数的计算同上,这里就不再赘述了。
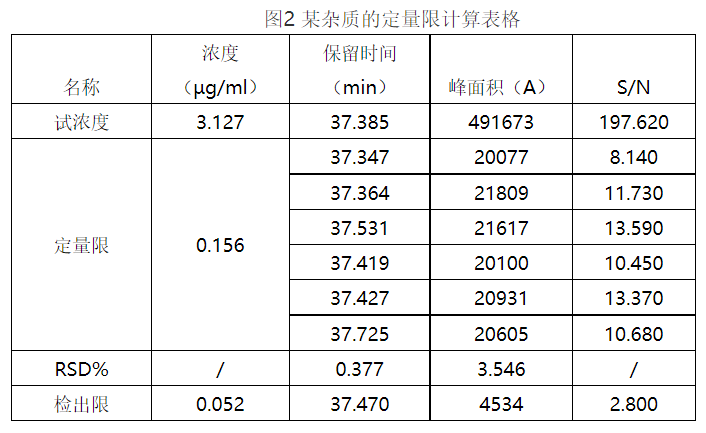
可能你会问,为什么要先做干专属性实验再做定检限?我在此想说的是,干扰实验是前提,只有确认了你的分析方法专属性足够好后,你才能确保以后即使出现降解杂质,你的方法也足够适用。做定检限是为了确定你的主成分的检样浓度,比如你的杂质的定量限为6.27ng(浓度为0.313μg/mL),那么该杂质且为普通杂质,限量暂定为0.1%,那么为了能检出该杂质的最小量,主成分的进样浓度该如何计算呢?
主成分的最小进样浓度=0.313/0.1%/1000=0.313mg/mL,当然这个浓度也可以适当的取大,可以定为0.5mg/mL,当然这里只是列举了一种杂质,当有多种杂质的时候,也要综合考虑其他杂质的定量限,(在0.5mg/mL的基础上)适当扩大或者缩小进样浓度。
<END>











































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论