疫苗每年可挽救200-300万人的生命,在偏远地区,疫苗处方的不稳定性是其广泛使用的主要障碍。会影响疫苗稳定性的因素有很多,但最相关的通常是温度依赖性的降解(热不稳定性)。目前疫苗专用的冷链系统在疫苗的制造、运输、储存和分销过程中将其冷冻或冷藏在-60°C~8°C。但在低收入和中等收入地区和国家维持冷链系统成本高昂且困难,冷链中断是造成全球约50%疫苗浪费的主要原因。
目前,疫苗的首选的制剂形式通常是液体疫苗制剂。然而,疫苗抗原在水性环境中通常不稳定,其保质期通常较短。例如,蛋白质亚单位疫苗在液体制剂中会由于多种物理途径(如变性、解折叠、聚集、沉淀和吸附)和化学反应(如氧化、脱酰胺和水解)而不稳定,这会严重影响疫苗的效力。同样,减毒活疫苗冷冻时很稳定,但在高于8°C的水溶液中稳定性有限,这种不稳定性也是主要由于上述降解途径,这些途径可能会破坏表面蛋白质的稳定性、降解核酸或破坏脂质膜等。因此,通过干燥去除水分可以抑制或干预这些途径来增加减毒病毒、细菌或其他抗原成分的稳定性。干固体疫苗制剂能延长保质期,这将大大提高应对生物疾病或流行病的疫苗储备稳定性。干疫苗制剂还表现出更高的热稳定性,减少对冷链的依赖,减少疫苗浪费,这将有助于向冷链服务条件不足或偏远地区的分发运输。表1中列出部分国外已获得上市许可冷冻干燥疫苗稳定性[1]。

不同于许多液体疫苗在冷冻后会丧失活力和效力,冻干减毒活疫苗不会因暴露于冷冻温度而受到损害。许多冻干减毒活疫苗在2–8 °C以上的稳定性也极低,通常它们只能在室温下稳定几天。研究显示葛兰素史克开发的轮状病毒疫苗ROTARIX,在25°C下能稳定36个月,在37–40°C下能稳定18个月,见表1。其他类型的许可冻干疫苗,包括全灭活疫苗和多糖亚单位疫苗,在室温和更高温度下稳定性大大提高。虽然目前上市的冻干疫苗可在数周到数月的时间内保持足够的活性或效力,但实际上都需要冷藏保存。
A型脑膜炎球菌疫苗 MenAfriVac已获准在A型脑膜炎流行广泛的撒哈拉以南非洲地区使用,该地区冷链维护设施的可及性有限。MenAfriVac 是第一种获得批准在无冷链情况下使用的疫苗,可在40°C的温度下暴露4周,见表1。由于其高热稳定性和易于在偏远地区发运,A 型脑膜炎的流行在撒哈拉以南非洲地区几乎已被消灭。国外研究机构目前正试图使用与MenAfriVac同样的技术应用到完全根除脊髓灰质炎。
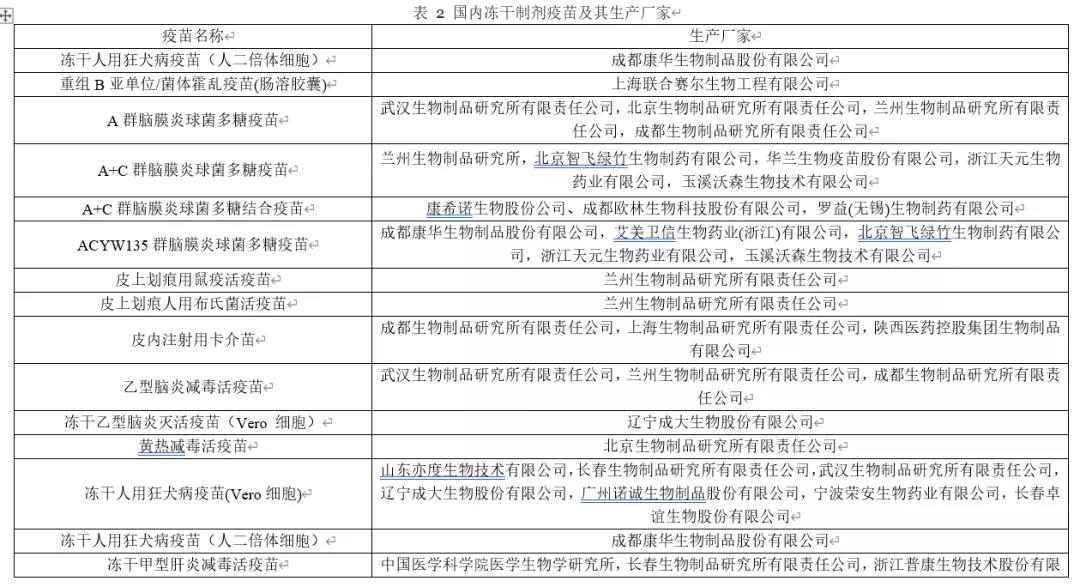
冻干疫苗占FDA批准的疫苗的四分之一。2020年版《中国药典》中收载有包括口服和注射用疫苗共54种,其中21种含有冻干制剂的疫苗[2],见表2。

最近,核酸疫苗因其快速的制造过程和诱导细胞和体液免疫反应的能力而备受关注,BioNTech/Pfizer和Moderna开发的mRNA新冠COVID-19疫苗的效力约为95%,并且获得FDA紧急使用授权和EMA的附条件批准。BioNTech/Pfizer开发的COVID-19疫苗由封装在脂质纳米颗粒(LNP)中的信使核糖核酸(mRNA)链组成。当前mRNA脂质纳米颗粒(LNP)COVID-19 疫苗的一个缺点是它们必须在(超)低温下储存。在2–8 °C的温度下,辉瑞/BioNTech和Moderna疫苗分别可稳定5天和30天,Moderna表示其疫苗在标准–20°C的冰箱中可保持稳定长达6个月,在室温下可保持长达12小时。相比之下,辉瑞/BioNTech疫苗需保持在–70 °C的超低温度。为了在运输过程中保持超低温,专门设计了运输集装箱,如果加满干冰,仅可以使用长达15天;或者选择需要花费超过10000美元的专用冷冻机。辉瑞病毒疫苗研究负责人Philip Dormitzer已经提到辉瑞希望将冻干技术用于mRNA-LNP SARS-CoV-2疫苗[3]。
目前,疫苗开发正在从第一代活的或灭活的全病毒和细菌疫苗转向下一代亚单位、类毒素、DNA和mRNA 疫苗。由于这些疫苗类型不包含完整的病毒或细菌,因此通常需要佐剂来增强免疫反应。对于含有佐剂的疫苗,尤其是最常用的佐剂铝盐(包括氢氧化铝、磷酸铝、硫酸铝钾和混合铝盐),由于它们对冷冻敏感(铝佐剂和其他佐剂如水包油乳剂在冻干过程中容易发生相分离、聚结和聚集),限制了其疫苗冻干制剂的开发。迄今为止上市的疫苗制剂中的使用含铝佐剂疫苗制剂仅限于液体悬浮液。与冻干相比,喷雾干燥的一个优点是没有冷冻步骤,这可能允许将冷冻敏感的佐剂掺入干燥的制剂中,但目前也仅仅停留在临床前研究阶段。在该领域不断扩大的同时,还需要进行更多的研究来开发带有佐剂的冻干或喷雾干燥疫苗制剂,从而减小对疫苗储存和运输操作的负担和依赖。除了已被批准在疫苗中使用的佐剂外,开发新佐剂以生产干疫苗也将成为可行的方法。
冻干是一种批处理操作,涉及三个主要步骤:冷冻,将液态水转化为冰;初级干燥,通过升华去除冰;和二次干燥,其中残留的水通过解吸去除。冻干能在干燥的同时避免高温损坏抗原稳定性。此外,冻干可以作为无菌过程进行操作,这使得最终产品能够满足无菌要求。在冻干循环过程中,会遇到各种可能导致抗原降解的因素,包括冷变性、由于冰晶形成导致界面增加、溶质浓度增加(低温浓缩)会显着改变离子强度和pH、相分离和稳定氢键的丢失。这些问题通常可以通过添加冷冻保护剂和干燥保护剂等赋形剂来改善。

图 1 冻干过程[4]
在冻干过程中,在冰水界面形成过程中,控制冷冻速度对有效稳定疫苗抗原起着很大的作用。尤其是一些缓冲盐成分在冷冻时会结晶,并导致pH值发生剧烈变化,这会导致抗原pH依赖性降解,例如脱酰胺或去折叠。因此,冷冻步骤应使用适度的冷却速率,以最大限度地减少冷冻浓缩状态的时间,并在玻璃瓶内和瓶之间产生均匀的冰结构。通常在冷冻步骤后增加退火工序,退火涉及将产品温度保持在最终冷冻温度以上足够长的时间。退火步骤允许可结晶填充剂结晶,从而避免抗原损伤并提高储存过程中的抗原稳定性。退火步骤还可以通过增加冰晶尺寸、降低非均相升华速率来促进初级干燥,并通过降低干燥层的传质阻力来加速升华速率。
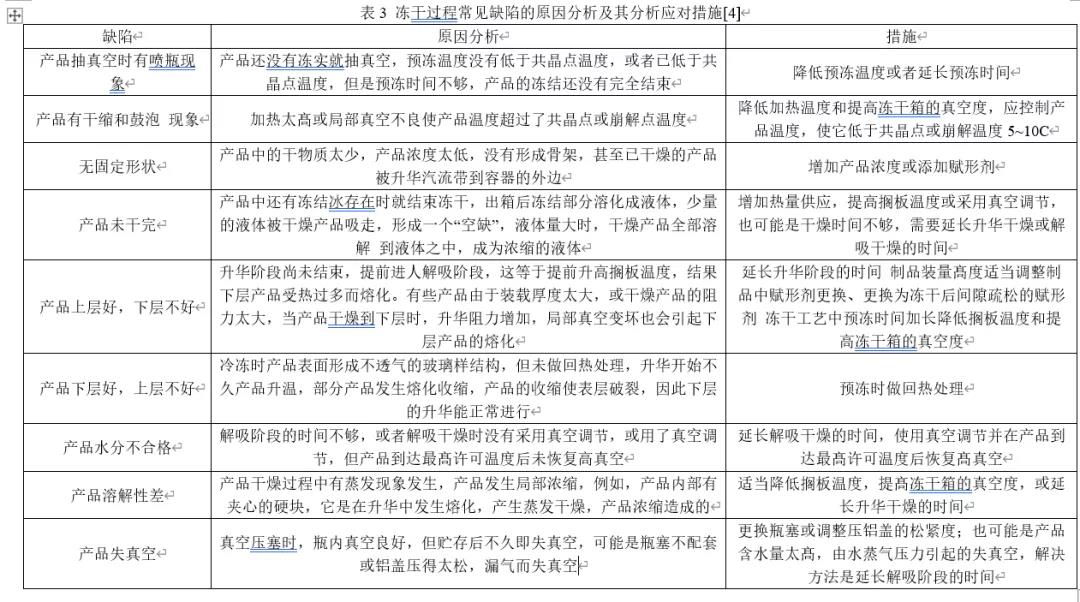
初级干燥步骤通常是冻干过程中最长的步骤,因此需要优化许多因素,包括腔室压力、搁板温度和终点时间,以最大限度地降低过程成本。二次干燥涉及使用更高的温度来解吸和蒸发结合水。缓慢的升温斜率比较合适,以避免冻干体塌陷,最终温度(通常在30-50°C范围内)应保持3-6小时以达到所需的残留水分含量。表3提供了冻干过程常见缺陷的原因分析及其分析应对措施[4]。
正确了解与冻干过程相关的疫苗性质变化的来源、不稳定因素和选择最佳稳定赋形剂对得到质量较好的产品至关重要。虽然冷冻干燥过程中疫苗性质变化的条件不能通过冻干过程中的参数调节来完全克服,但生产过程中控制冰核和冷却速度等可以得到大尺寸冰晶进而最大限度地减少冰水界面,从而控制和改善疫苗的不稳定性。所以,可控的冷冻干燥过程与合适的稳定赋形剂相结合,不仅可以提高疫苗的稳定性,还可以提高冻干疫苗制剂的质量。
参考文献或书籍:
[1]Preston KB, Randolph TW. Stability of lyophilized and spraydried vaccine formulations. Adv Drug Deliv Rev. 2021 Apr;171:50-61. doi: 10.1016/j.addr.2021.01.016.Epub 2021 Jan 21. PMID: 33484735.
[2]国家药典委员会.中国药典[M].北京:中国医药科技出版社,2020:1088.
[3]https://www.nature.com/articles/d41587-020-00022-y.
[4]国家食品药品监督管理局药品认证管理中心编写. 药品GMP指南.无菌药品[M]. 中国医药科技出版社, 2011.
<END>











































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论