摘要
系统适用性是色谱工作中必不可少的部分,国内外标准都对系统适用性试验做了要求。本文是笔者对色谱实验中系统适用性的漫谈,供广大读者在工作闲暇之处讨论,不足之处还望理解。
系统适用性是液相和气相色谱方法的重要组成部分,用来确认色谱系统的分离度和重复性能够满足特定的分析要求。测试是基于将仪器、电路、实验者和样品作为一个整体进行的。
美国药典规定任何色谱试验一定要进行系统适用性测试,否则,这台仪器做出的数据一律无效;ICH提出一定要将系统作为整体来测试;FDA提到应确定一SOP进行测试确保系统可用;英国药典规定建立系统适用性是为了任何使用方法时都是有效的;欧洲药典提出系统适用性测试反映了色谱系统性能,是建立分析方法不可或缺的一部分;日本药典与美国药典叙述基本一致;GMP指出检查分析方法验证过程时,应涉及是否开发了系统适用性试验,并且对每一项系统适用性试验的参数都进行了定义;中国药典并没有单独对系统适用性目的进行叙述,国内色谱工作者往往对系统适用性不够重视,看似简单的系统适用性其实有很多需要关注的地方,其重要性不比方法学中其他验证项差。
一、美国药典系统适用性的要求
美国药典并没有明确对分离度、理论塔板数、拖尾因子、重复性及灵敏度的统一要求,在药典正文中各个品种项下分别规定。当采用标准品或标准品溶液需要重复进样以判断系统的精密度,除非个论中有规定,系统适用性5针的数据的相对标准偏差不得超过2.0%,当超过2.0%时,需要计算连续6针进样的数据。在含量测定中,系统适用性的相对标准偏差与进样次数和含量限度上限有关,表1是USP对含量系统适用性测试相对标准偏差的规定。
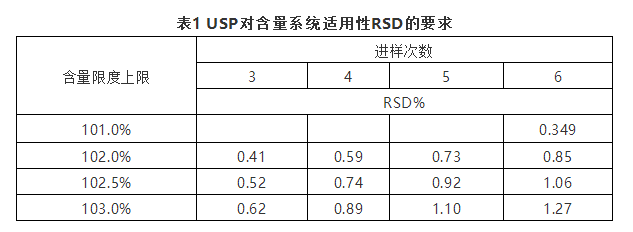
关于对称因子规定参考笔者撰写《拖尾因子、对称因子和不对称因子区别理论》,在此不做赘述。当系统适用性不符合要求时可以适当调整方法参数,不过每个变量的最大值都应该进行验证其系统适用性,对改变后的方法进行重新评价。表2是USP对参数调整的规定。
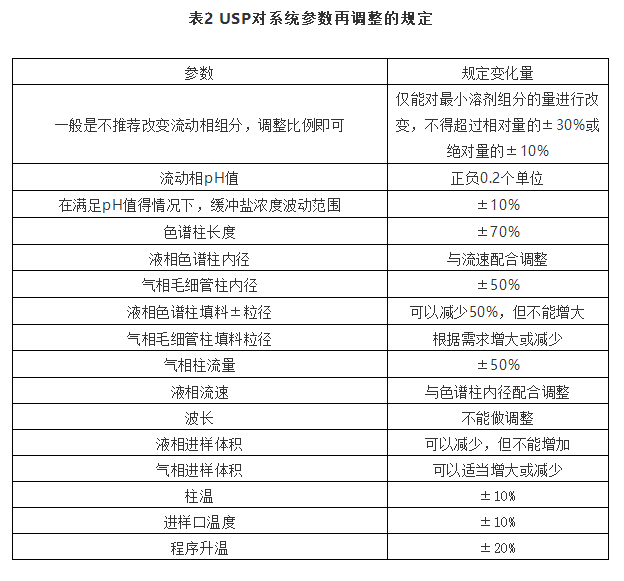
二、欧洲药典和英国药典系统适用性的要求
欧洲药典和英国药典对系统适用性要求也做了非常详细的规定,并且对保留时间、保留体积、死体积、死时间等概念做了详细描述。EP和BP关于对称因子规定参考笔者撰写《拖尾因子、对称因子和不对称因子区别理论》,在此不做赘述。系统适用性5针的数据的相对标准偏差与USP规定基本一致。当系统适用性不符合要求时可以适当调整方法参数,EP和BP对等度洗脱和梯度洗脱分别做了规定,详见表3。
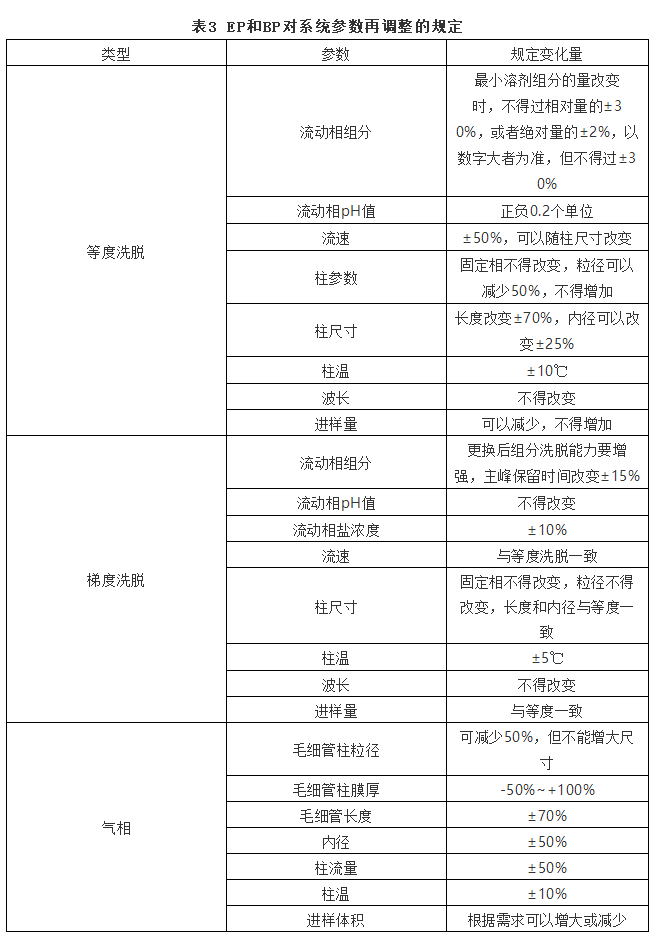
三、日本药典系统适用性要求
日本药典要求在液相中的系统适用性一般重复进样6次,需要根据实际情况确定适合的相对标准偏差。比如6次进样的相对标准偏差不大于1.0%,则要求杂质含量不得大于5.0%,含量应在98.0%~102.0%范围内。杂质含量在0.5%~1.0%范围内,则要求系统适用性的相对标准偏差不大于2.0%。不过,在利用梯度方法或者样品包含强保留组分时,可以适当减少进样次数来确定新的接受限度以满足系统适用性,表4是不同进样次数对应6次进样的限度规定。
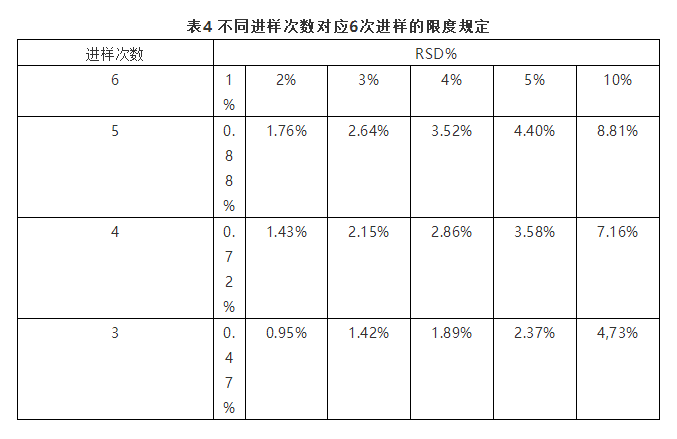
上述要求均指在液相中,对于气相色谱可以适当放宽。JP并没有单独对理论塔板数、拖尾因子及分离进行规定,而是在药典正文各个品种下进行规定。当系统适用性不符合要求时可以适当调整方法参数,JP并没有像USP、EP及BP一样进行详细规定,只是简单叙述可以从色谱柱、流动相、柱温等进行改变以适应系统适用性要求。
四、中国药典系统适用性的要求
中国药典要求定量分析时,分离度应大于1.5。进行重复性分析,采用外标法时,取对照品溶液连续进样5次,峰面积相对标准偏差不大于2.0%,采用内标法时,配制80%、100%和120%对照品溶液,加入规定量的内标溶液,配成3种不同浓度的溶液,分别至少进样2次,计算平均校正因子,其相对标准偏差不大于2.0%。拖尾因子规定参考笔者撰写《拖尾因子、对称因子和不对称因子区别理论》,在此不做赘述。当系统适用性不符合要求时可以适当调整方法参数,ChP同样对参数改变做了要求。表5是ChP对系统参数在调整规定。

五、笔者对系统适用性的要求
笔者在进行系统适用性试验时会依据情况而定,如果含量和有关物质是一种方法,则只需要进行系统适用性试验。反之,则应区别对待。对于含量的系统适用性试验应配制规定样品浓度的主成分,添加所有已知杂质进样6次重复进样试验,首先要求6次进样的杂质与主成分的分离度均大于2.0,并且主成分的拖尾因子应在0.95~1.05之间,理论塔板数可根据实际情况酌情而定(比如色谱柱性能变差则峰形变平等等)。再者就是6次进样的主成分的峰面积相对标准偏差不大于1.0%,保留时间的相对标准偏差不大于1.0%。
对于等度洗脱方法或者已确定各杂质保留时间足够稳定,可以采用上述混合溶液单针进样,考察分离度、理论塔板数及拖尾因子,再以主成分对照品溶液行3次连续进样两两计算峰面积及保留时间的相对标准偏差均不大于1.0%,或者6次连续进样的峰面积及保留时间的相对标准偏差均不大于1.0%以确定系统满足测定要求。有关物质的系统适用性应制备混有至少大于限度浓度杂质的主成分对照品溶液进行1次进样,根据实际情况确定分离度、拖尾因子及理论塔板数要求,再按照含量系统适用性测试中对照品方法进行测定即可。
系统适用性样品
系统适用性应使用经过确认的一级或二级对照品和任何必要的物料进行系统适用性检查,以确保足够的方法性能。一个新批次高度纯化的对照物料(例如来自化学品供应商或自制)应采用一级对照品进行确认。未确认为对照品的制剂或API不应用于系统适用性测试。即使API或制剂经过恰当确认成为对照品,如果是来自待检样品相同批次,则亦不能用于系统适用性测试。所以我们日常药物分析工作中是不能用供试品作为系统适用性样品的,采用供试品进行系统适用性测试具有直到检测合格为止的嫌疑。
系统适用性试验什么时候做
何时进行系统适用性因人而异,每个人都有一套自己的标准,笔者认为在系统发生变动时都要进行系统适用性试验(比如新配制流动相、比如更换同型号新购色谱柱、比如更换气体),还有在长时间进行运行样品时也及时进行系统适用性封针操作。方法验证试验一定包括系统适用性测试。正如前文所说,没有进行系统适用性试验的系统任何数据都是无效的。
结语
系统适用性试验作为分析方法不可分割的一部分,已经被越来越多的监管机构所重视。不过从目前国内整体的药物研发情况来看,药物分析工作者对此还没有足够的认识,未结合分析方法验证情况有针对性地去探索系统适用性试验的要求。在有药典参考标准的情况下,对药典标准的系统适用性要求不够重视,仅仅将色谱条件拿来使用,或者随意更改、降低系统适用性要求,导致方法的重现性差,检测结果不准确。在这方面,药物分析工作者们急需提升观念,提高重视程度,加强研究。
参考文献:
【1】美国药典
【2】欧洲药典
【3】英国药典
【4】日本药典
【5】中国药典
【6】Comparison of System Suitability Test for Liquid Chromatography in Pharmacopoeias [J].,2013,027(012):1305-1307.
【7】《Data Integrity and Compliance With Drug CGMP》
【8】李飞, 李云, 许真玉. 色谱系统适用性试验在分析方法使用中的重要性[J]. 中国新药杂志, 2019, 28(06):30-33.
<END>








































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论