摘要
分析过程中涉及环节较多,人为操作环节也多,所以在实验室发生的偏差、OOS/OOT、异常机率也随之增加。实际工作中,很多人员对于实验室内的偏差、OOS/OOT、异常不能有效识别和区分,发生后是该走OOS调查呢?还是要走偏差调查?还有一些异常状况,不属于OOS、也没有偏离文件要求,该走什么流程调查或者怎么样才能把这些情况记录下来,确保实验室数据可靠性符合要求,确保这些“事情”、“现象”、“数据”可追溯呢?有没有傻傻分不清楚的感觉呢?老王在此分享一下实验室常见的偏差、OOS/OOT、异常的有效识别和区分以及这三者的关系及其应用。
正文
一、实验室“偏差“的识别和常见案例
实验室发现或者发生的异常状况是不是都属于OOS?NO!判定为OOS针对的是检验结果,实验室还会发现或者发生一些偏离文件、偏离程序的事件,比如偏离了验证方案要求、偏离了操作SOP要求、偏离了管理程序要求等,这些通常按照偏差流程管理。
1.偏差的定义
- 《药品生产质量管理规范》2010 年修订版第二百五十条中描述:任何偏离生产工艺、物料平衡限度、质量标准、检验方法、操作规程等的情况均应当有记录”,但没有给出“偏差”的正式定义。
- ICH Q7对“偏差(Deviation)”的定义:偏差---指偏离已批准的程序(指导文件)或标准的任何情况。这里的“标准”指制药企业为实现药品质量而建立的各种技术标准,包括但不局限于物料的分析检验标准。技术标准可以体现为各种文件形式,可以直接是程序文件的一部分,可以是独立的技术标准文件,也可以体现为受控模版或其它适当的形式。
这里的程序(指导文件,instruction)指广义“生产”(Manufacturing)活动的程序文件。
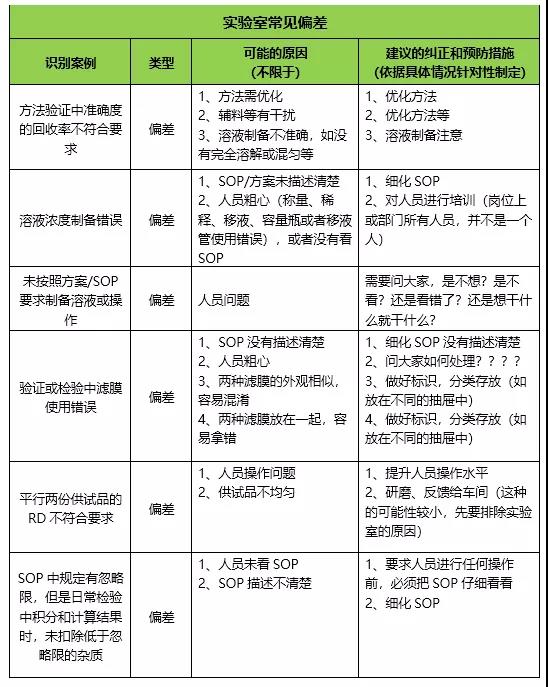
2.实验室常见偏差类型及其可能的原因、纠正和预防措施(供参考)
二、实验室“OOS/OOT“的识别和常见案例
实际工作中,很多人容易混淆OOS与偏差的关系,OOS其实是一种特殊的偏差,是在实验室“发现”的偏差。为什么是“发现”的偏差,而不是发生的偏差呢?因为发生在实验室的异常状况不一定都是OOS,也并非都是实验室原因导致的,只是在实验室发现的检验结果超标的偏差通过OOS系统进行管理而已。
1.OOS/OOT定义
超标结果(Out-of-specificaion,OOS):检验结果超出法定标准及企业制定标准的所有情形。例如包括药品申报文件中的注册标准、药典和其它法定标准,制药企业自行建立的内控质量标准或接受标准,也包括工艺过程控制检验标准。但需要注意,用于监控和/或调整工艺(而非用于生产过程放行)的工艺过程控制检验通常不需要进行OOS 调查。
超趋势(Out-of-Trend,OOT):结果在标准之内,但是仍然比较反常,因为这个结果与长时期观察到的趋势不一致。(可根据年度回顾制定产品OOT限度)
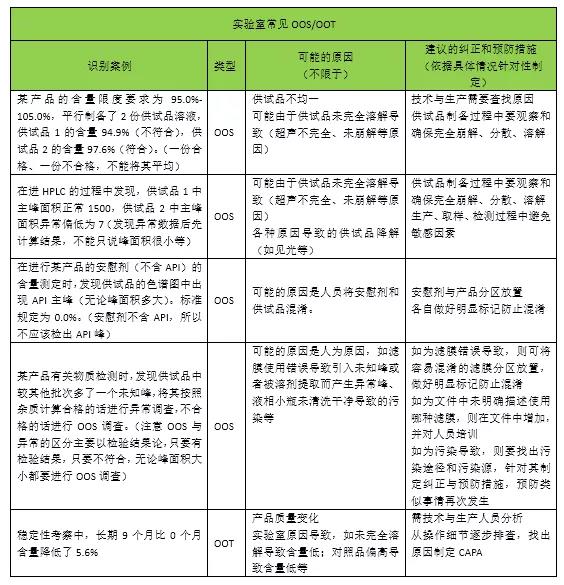
2.实验室常见的OOS/OOT示例及其可能的原因、纠正和预防措施
三、实验室“异常“的识别和常见案例
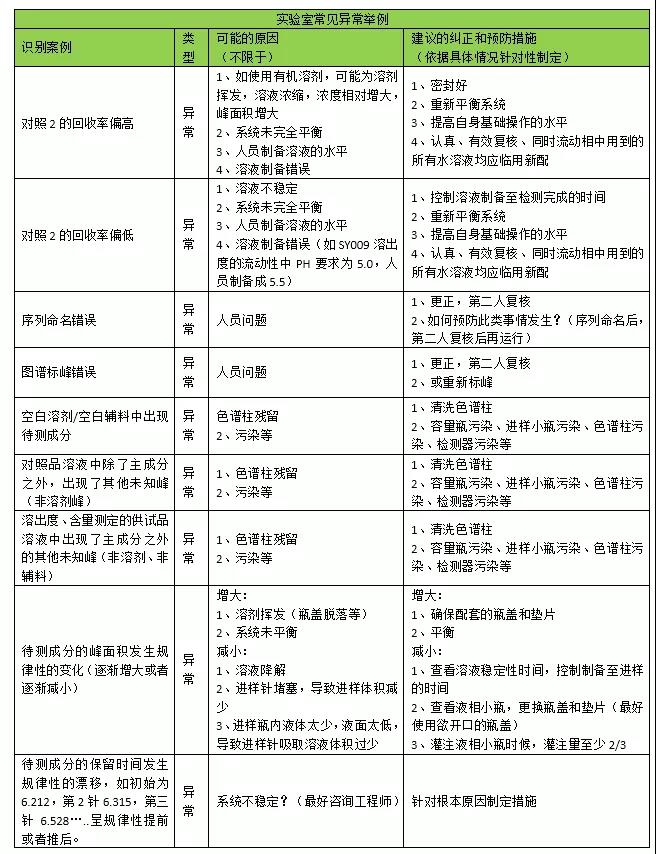
异常是什么?该怎么办?你有没有遇到过不属于OOS、也没有偏离文件要求,但就是出现了异常状况,该走什么流程调查或者怎么样才能把这些情况记录下来?如何确保实验室数据可靠性符合要求,确保这些“事情”、“现象”、“数据”可追溯呢?那么建立一个关于异常的调查流程,或可解君愁呀!通常,异常包括异常现象、异常事件、异常数据。没有确切的官方定义,是游离于偏差和OOS之外的一类。例如,峰分叉、异常峰,序列命名错误、保留时间漂移、供试品洒落需要重新称量等等。

结语
偏差调查和OOS/OOT调查是每次外部审计的重点关注内容,而异常调查也是确保实验室数据可靠性以及各种情况可追溯、可持续改进的一种有效手段。
有效识别偏差、OOS/OOT、异常,分析人员就能快速作出判断,要发起什么调查流程?要填写哪些表格?对于调查的及时性和有效性也会有提升。
有效区分偏差、OOS/OOT、异常,对于实验室管理来说,不易出现调查不彻底或者分类不准确的情况,规避外部检查时留下认识不足的评价或缺陷。
<END>







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论