安斯泰来制药集团(Astellas Pharma Inc.)总部位于日本东京,由前日本山之内制药株式会社与藤泽制药株式会社于2005年4月合并成立,是日本第二大处方药制药企业,在器官移植免疫抑制剂和泌尿前列腺专业治疗领域位居日本市场首位。安斯泰来致力于通过提供创新而可靠的医药产品,为全世界人民的健康做出贡献,凭借先进的科学技术和研发能力,不断挑战目前尚未满足人们需求的医疗领域,立志在目标治疗领域中成为全球专业市场领导者。

一、主要产品
目前,安斯泰来锁定泌尿、移植免疫/感染性疾病、肿瘤、神经科学和糖尿病并发症/肾病五个重点研发领域,并拓展了肌肉疾病、眼科两个新的治疗领域。此外,安斯泰来预见到创新药市场所面临的环境变化,并不断在未被开拓的新领域,积极探寻新的事业机遇。安斯泰来的主要产品有XTANDI(商品名:安可坦,通用名:恩扎卢胺,enzalutamide)、Betanis/Myrbetriq/BETMIGA(Mirabegron,米拉贝隆),新上市产品有FLT3抑制剂XOSPATA(gilteritinib,吉列替尼)、Evrenzo(商品名:爱瑞卓,通用名:roxadustat,罗沙司他)以及PADCEV(Enfortumab vedotin-ejfv)等。
前列腺癌——XTANDI(恩扎卢胺,enzalutamide)是一款雄激素受体抑制剂(AR),2012年首次获美国FDA批准,用于治疗晚期前列腺癌,现已在美国、欧洲、日本、亚洲地区上市,并已获批用于治疗早期前列腺癌,成为首款获FDA批准可同时治疗非转移性和转移性去势抵抗性前列腺癌(CRPC)的口服药物。2019年11月,该药获中国国家药监局(NMPA)批准上市,用于治疗雄激素剥夺治疗(ADT)失败后无症状或有轻微症状且未接受化疗的转移性去势抵抗性前列腺癌(CRPC)成年患者。
急性髓系白血病(AML)——XOSPATA(gilteritinib,吉列替尼)是一款FLT3酪氨酸激酶抑制剂,于2018年在日本和美国获批,用于治疗FLT3突变阳性的复发/难治性急性髓系白血病(AML)成人患者。据报道,约30%的AML患者携带FLT3突变,XOSPATA能够抑制FLT3跨膜区内部串联重复(ITD)以及FLT3酪氨酸激酶结构域(TKD),这是2种常见的FLT3突变类型。2021年2月,国家药监局附条件批准适加坦®(Xospata®,富马酸吉瑞替尼片,gilteritinib fumarate tablets),用于治疗携带FLT3突变的复发/难治性急性髓系白血病(AML)成人患者。
转移性尿路上皮癌——PADCEV(enfortumab vedotin-ejfv)是一款first-in-class抗体偶联药物(ADC),靶向在膀胱癌中高度表达的一种细胞表面蛋白Nectin-4,2019年12月获美国FDA加速批准,用于治疗局部晚期或转移性尿路上皮癌患者,该药由安斯泰来与Seagen合作开发。2021年7月11日,安斯泰来与Seagen宣布Padcev获得了FDA常规批准。同时,Padcev还扩展了适应症标签,用于曾接受过PD-1/PD-L1抑制剂治疗且不符合顺铂治疗的局部晚期或转移性尿路上皮癌患者。
膀胱过度活动症(OAB)——Mirabegron(米拉贝隆)是一种选择性β3-肾上腺受体激动剂,用于治疗膀胱过度活动症(OAB),通过激活膀胱逼肌上的β3-肾上腺受体,从而提高膀胱的充盈以及贮尿能力。2011年,该药以Betanis为商品名在日本首次获批;在美国,该药以Myrbetriq为商品名进行销售;在欧洲、亚洲、大洋洲则以BETMIGA为商品名。
肾性贫血——Evrenzo(roxadustat,罗沙司他)是一种口服小分子低氧诱导因子脯氨酰羟化酶(HIF-PH)抑制剂,可抑制低氧诱导因子(HIF)的泛素化降解,帮助机体产生更多的红细胞,并且不受炎症对血红蛋白及红细胞生成的消极影响。该药是一款口服first-in-class慢性肾脏病(CKD)贫血的治疗药物,由FibroGen(珐博进)发现并与安斯泰来合作开发,于2018年12月在中国率先获批,用于治疗透析依赖性慢性肾病(DD-CKD)成年患者贫血,商品名为爱瑞卓。2019年8月,该药在中国获批新适应症,用于非透析依赖性慢性肾病(NDD-CKD)的贫血治疗。

免疫抑制剂——Tacrolimus(他克莫司,FK506)是一种免疫抑制剂,可与细胞内结合蛋白(FKBP)形成复合物,通过抑制钙调磷酸酶,抑制IL-2转录,从而抑制T细胞活化、抑制TNF-α、IL-1β和IL-6产生及T细胞依赖的B细胞增殖作用,产生强大的免疫抑制作用,被用于抑制器官移植的免疫排斥。该药由安斯泰来的前身之一藤泽制药开发,1994年获FDA批准在美国上市,商品名为Prograf,后陆续在欧盟、亚洲等地区上市,1998年进入中国市场,中文商品名为普乐可复。该药一日一次的缓释制剂于2007年在欧洲获批上市,商品名为Advagraf,2008年在日本获批,以Graceptor为商品名进行销售,2013年在美国获批,商品名为Astagraf XL。虽然该药在主要国家的专利已经到期,但仍在全球被广泛用于器官移植,还被用于治疗自身免疫性疾病,如在日本用于治疗类风湿性关节炎和溃疡性结肠炎。
此外,还有治疗膀胱过度活动症的Vesicare(商品名:卫喜康;通用名:solifenacin succinate,琥珀酸索利那新);前列腺癌药物Eligard(leuprolide acetate,醋酸亮丙瑞林);前列腺增生治疗药物Harnal/Omnic(Tamsulosin Hydrochloride);抗真菌药Funguard/MYCAMINE(micafungin sodium,米卡芬净钠)等等。
二、2020财年业绩
2021年4月27日,安斯泰来公布2020财年业绩(2020年4月1日至2021年3月31日),由于产品结构的变化,部分药物失去市场独占权、销售协议终止及新冠疫情的消极影响,公司全年销售收入12495亿日元(约114.6亿美元),同比下降3.9%;销售及管理费用为5043亿日元(约46.3亿美元),同比增长1%;研发费用为2245亿日元(约20.6亿美元),同比增长0.1%,因受新冠疫情影响,部分临床试验受阻,研发费用有所降低,但对关键的临床开发后期阶段项目开发投入增加,且于2020年1月完成对美国基因治疗公司Audentes的收购使研发总费用增加。研发销售占比为18%,同比增长0.7%;全财年核心营业利润为2514亿日元(约23.1亿美元),同比减少9.5%;营业利润为1361亿日元(约12.5亿美元),同比减少44.2%;税后利润为1206亿日元(约11.1亿美元),同比减少38.3%。
注:一些英联邦和日本公司的财年是每年4月1日至第二年的3月31日;汇率按照2021年4月至6月平均汇率JPY/USD=1/109,下同。
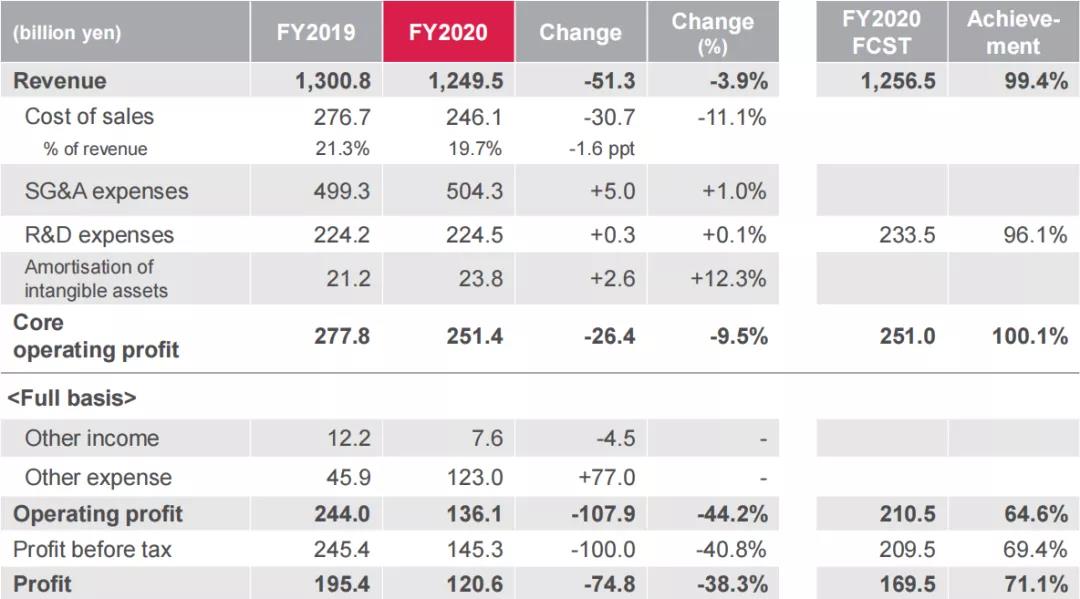
从具体产品来看,XTANDI(恩扎卢胺,enzalutamide)销售额同比增长14.6%,达到4584亿日元(约42.1亿美元),该药在日本、美国、成熟市场、大中华区及国际市场的销售额均有所增长。XOSPATA(gilteritinib,吉列替尼)销售额同比增长67.2%,达到238亿日元(约2.2亿美元)。除了在日本、美国和成熟市场的销售额有所增长之外,2020年8月开始在国际市场进行销售以及2020年12月开始在大中华区进行销售。Betanis/Myrbetriq/BETMIGA(Mirabegron,米拉贝隆)销售额同比增长1.2%,达到1636亿日元(约15亿美元)。在日本、成熟市场和大中华区的销售额均有所增长。PADCEV(enfortumab vedotin-ejfv)在美国联合推广收入大幅增长,同比增长607.3%,达128亿日元(约1.2亿美元)。Prograf(Tacrolimus,他克莫司)销售额同比降低5.3%,为1827亿日元(约16.8亿美元),但大中华区销售额同比增长6.2%,达到342亿日元(约3.1亿美元)。
此外,Evrenzo(roxadustat,罗沙司他)的销售额为11亿日元(约1000万美元),同比增长371.2%;Vesicare(商品名:卫喜康;通用名:solifenacin succinate,琥珀酸索利那新)销售额为316亿日元(约2.9亿美元),同比降低29.3%;Harnal/Omnic(Tamsulosin Hydrochloride)销售额为369亿日元(约3.4亿美元),同比减少13.5%;Funguard/MYCAMINE(micafungin sodium,米卡芬净钠)销售额为256亿日元(约2.4亿美元),同比减少27.3%;Eligard(leuprolide acetate,醋酸亮丙瑞林)销售额为95亿日元(约8700万美元),同比降低33.4%。
注:成熟市场包括欧洲、加拿大、澳大利亚;大中华区包括中国的大陆地区、香港地区和台湾地区;国际市场包括俄罗斯、拉美、中东、非洲、东南亚、南亚、韩国、出口销售额等。
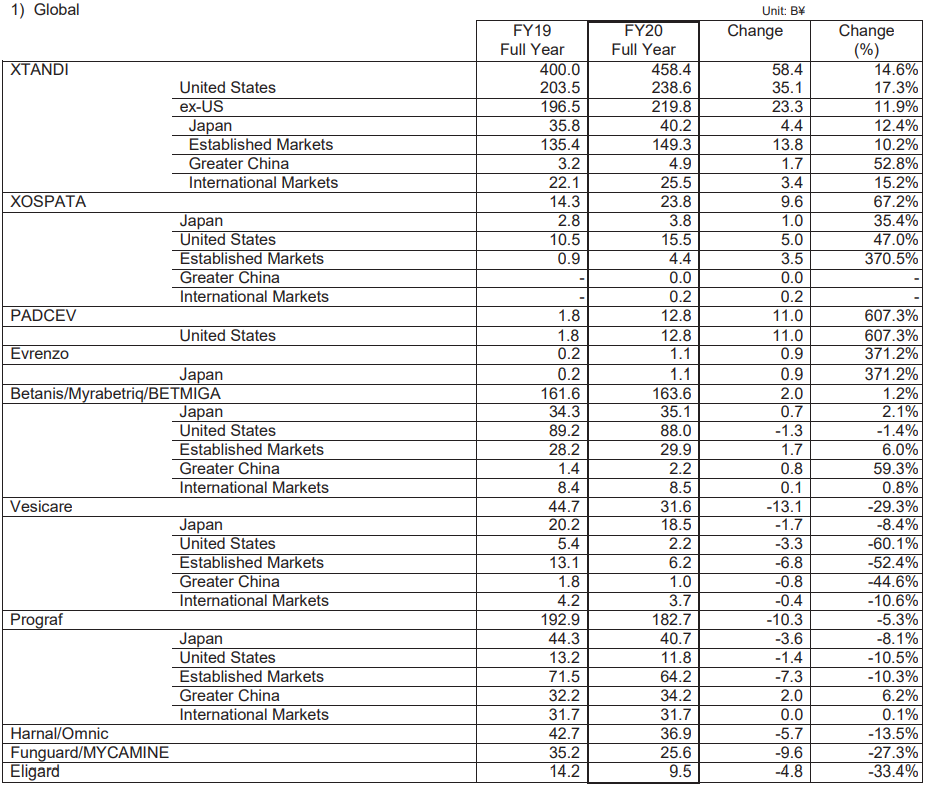
2020财年主要产品业绩图源:安斯泰来财报
按地区分,2020财年公司在日本的业绩为2791亿日元(约25.6亿美元),同比减少19.2%;在美国的业绩为4732亿日元(约43.4亿美元),同比增长6.7%;在成熟市场的业绩为2932亿日元(约26.9亿美元),同比减少1%;在大中华地区的业绩为593亿日元(约5.4亿美元),同比减少1.8%;国际市场的业绩为1111亿日元(约10.2亿美元),同比减少17.6%。
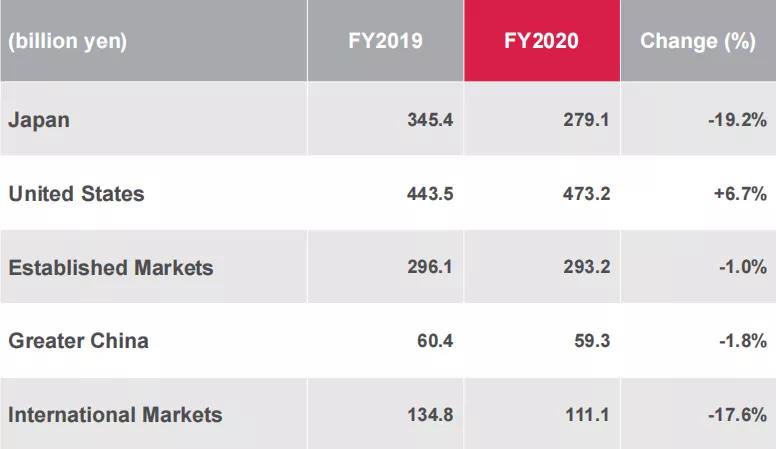
2020财年各地区业绩分布图源:安斯泰来财报
三、2021 Q1业绩
2021年7月30日,安斯泰来公布2021年Q1业绩(2021年4月1日至2021年6月30日),公司第一季度销售收入3261亿日元(约29.9亿美元),同比增长6.2%;销售及管理费用为163亿日元(约1.5亿美元),同比增长13.5%;研发费用为583亿日元(约5.4亿美元),同比增长1.8%,虽然治疗血管舒缩症的fezolinetant在美国和欧洲的3期临床试验已经完成,使该部分费用有所减少,但总费用的增加主要是因为zolbetuximab(抗Claudin18.2单抗)研发费用的增加,和针对遗传调控、细胞疗法和免疫肿瘤学三个主要焦点的研发投资的增长;第一季度核心营业利润为628亿日元(约5.8亿美元),同比减少0.9%;营业利润为361亿日元(约3.3亿美元),同比减少40.7%;税后利润为307亿日元(约2.8亿美元),同比减少39.1%。
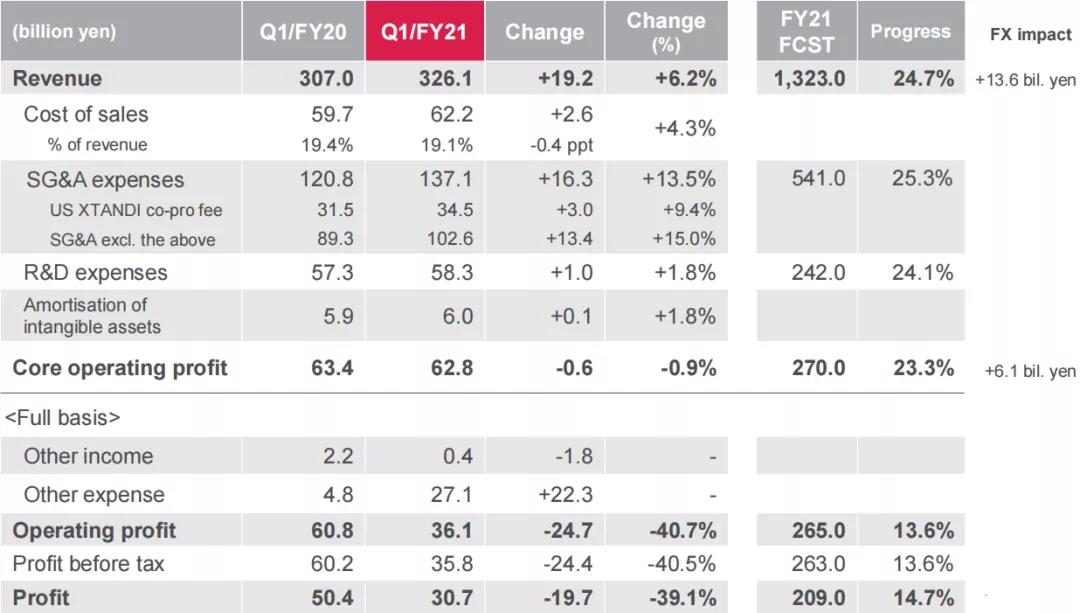
从具体产品来看,XTANDI(恩扎卢胺,enzalutamide)销售额同比增长18.7%,达到1329亿日元(约12.2亿美元),在欧洲,2021年4月批准了转移性去势敏感性前列腺癌(M1CSPC)的新增适应症;2021年6月,英国国家健康与临床卓越研究所(NICE)推荐XTANDI用于治疗M1CSPC;在中国,该药于2020年底纳入医保,新版医保目录从2021年3月起实施,提高了患者的可及性,需求增长高于预期,在大中华地区业绩为19亿日元(约1700万美元),同比增长165.1%。
XOSPATA(gilteritinib,吉列替尼)销售额同比增长47.7%,达到83亿日元(约7600万美元)。该药在美国和成熟市场的业绩大幅增长,分别达到26.9%和99.4%的同比增长率,2020年8月,该药开始在国际市场进行销售以及2020年12月开始在大中华区进行销售,2021年Q1业绩分别为1亿日元(约100万美元)和5亿日元(约500万美元)。
Betanis/Myrbetriq/BETMIGA(Mirabegron,米拉贝隆)销售额同比增长8.8%,达到440亿日元(约4亿美元)。在日本、成熟市场、大中华区以及国际市场的销售额均有所增长。在中国,该药于2020年底纳入医保,新版医保目录从2021年3月起实施。
PADCEV(enfortumab vedotin-ejfv)在美国联合推广收入同比增长41.9%,达42亿日元(约3900万美元)。2021年7月,该药在美国获批新适应症,用于治疗顺铂不耐受且既往接受过至少一次全身治疗的尿路上皮癌患者。
Prograf(Tacrolimus,他克莫司)销售额同比降低0.3%,为452亿日元(约4.2亿美元),但大中华区销售额同比增长22.9%,为96亿日元(约8800万美元),成熟市场业绩为162亿日元(约1.5亿美元),同比增长17%。
此外,Evrenzo(roxadustat,罗沙司他)的销售额为6亿日元(约600万美元),同比增长282.9%;Vesicare(商品名:卫喜康;通用名:solifenacinsuccinate,琥珀酸索利那新)销售额为74亿日元(约6800万美元),同比降低4.4%。
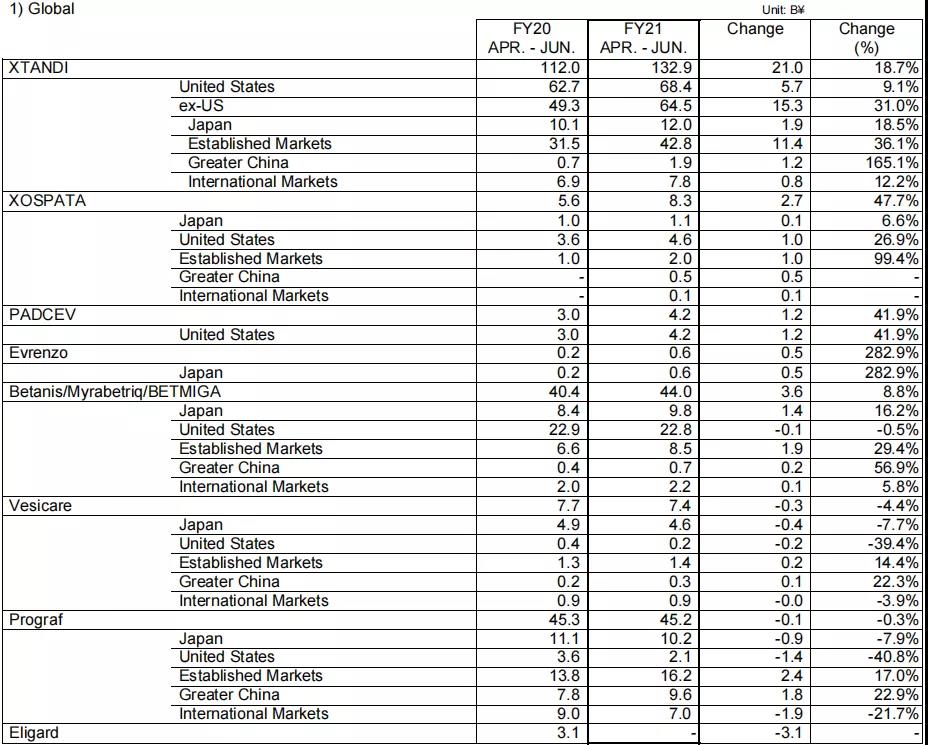
2021年Q1主要产品业绩图源:安斯泰来财报
按地区分,2021年Q1公司在日本的业绩为675亿日元(约6.2亿美元),同比减少13.2%;在美国的业绩为1336亿日元(约12.3亿美元),同比增长14.1%;在成熟市场的业绩为780亿日元(约7.2亿美元),同比增长21.8%;在大中华地区的业绩为164亿日元(约1.5亿美元),同比增长15.5%;国际市场的业绩为278亿日元(约2.6亿美元),同比减少8.1%。
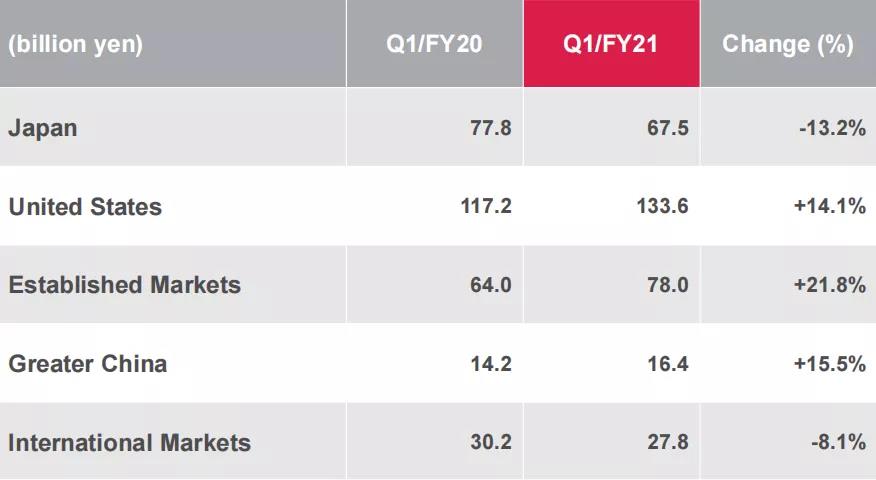
2021年Q1各地区业绩分布图源:安斯泰来财报
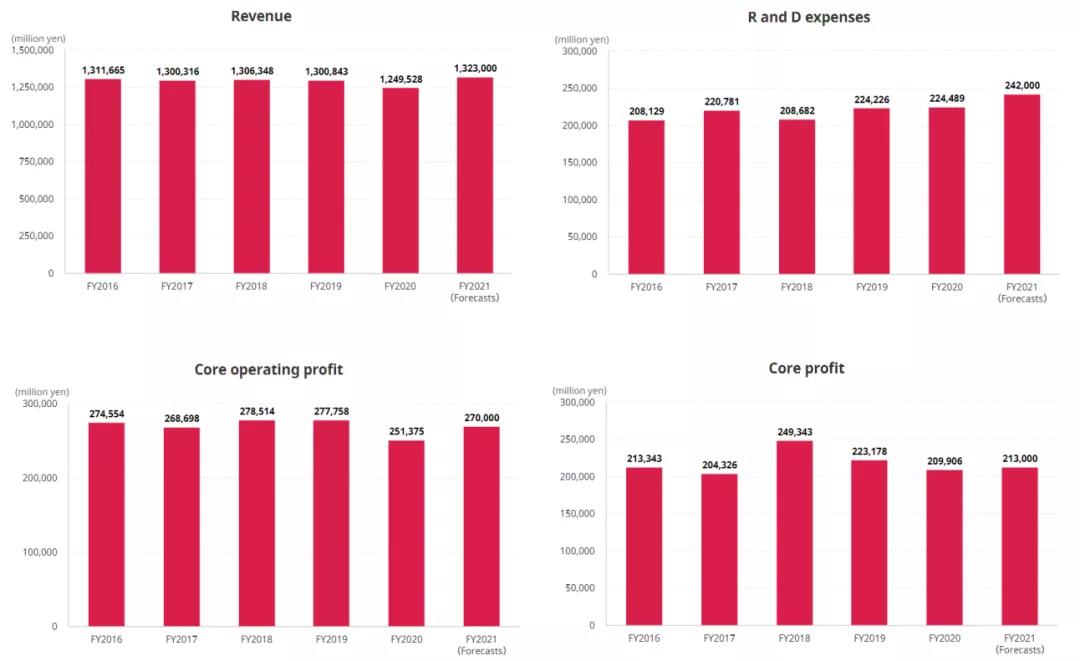
根据安斯泰来官方公布的2021财年业绩指引,预计公司2021财年业绩将达到13230亿日元(约121.4亿美元),研发费用约为2420亿日元(约22.2亿美元),核心营业利润约为2700亿日元(约24.8亿美元),核心利润约为2130亿日元(约亿19.5美元)。
图源:安斯泰来官网
四、技术平台& 研发进展
安斯泰来“立志处于不断变化的医疗行业最前沿,将科学进步转变为患者的价值”。为了实现这一愿景,公司建立起了多个技术平台。其中,细胞治疗平台已经开发了一套可以分化出11种细胞类型的技术,而安斯泰来再生医学研究所(AIRM)可以为所有的细胞治疗项目提供药物,并为药品提供临床所需。2016年收购从事眼科研究的美国生物技术公司Ocata Therapeutics,2018年收购Universal Cells,Inc.,获得具有较低免疫排斥反应多能干细胞的生产技术,为安斯泰来在细胞治疗方面的布局奠定基础,其细胞治疗研究集中于利用同种异体多能干细胞(PSC)来源的即用型分化细胞。在研项目主要涉及眼科领域的年龄相关性黄斑变性、青光眼、视网膜色素变性等,并探索成纤维细胞来源的间充质干细胞应用于自身免疫性疾病、血管祖细胞应用于肢体缺血以及多种细胞应用于癌症的潜力。

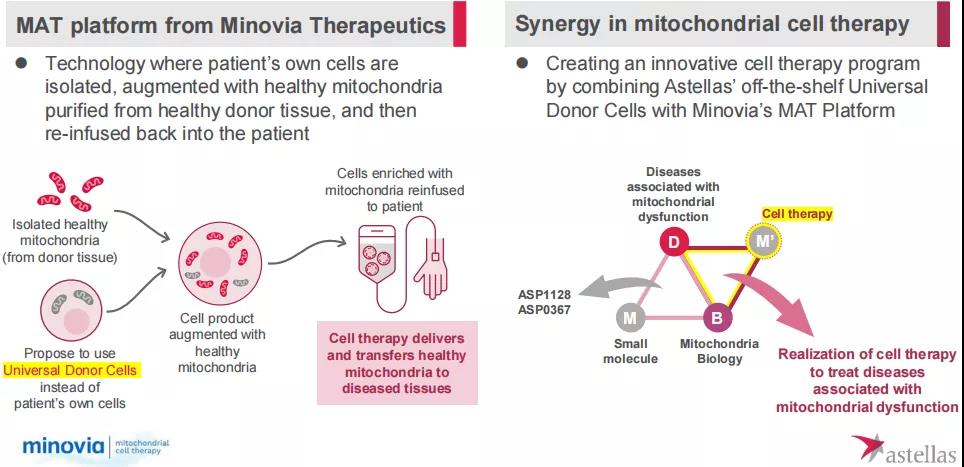
其线粒体生物学平台主要基于2021年7月安斯泰来与Minovia Therapeutics达成合作协议,共同推进治疗线粒体功能障碍相关疾病的新型细胞疗法的研究、开发和商业化。利用安斯泰来基因工程改造的诱导多能干细胞,并使用Minovia专有的线粒体增强疗法(MAT)技术平台,加速开发同种异体线粒体细胞治疗方案,通过移植健康的线粒体来恢复患者组织功能,以治疗线粒体功能障碍引起的疾病。从2018年开始,安斯泰来就开始在线粒体生物学领域布局,先后收购了美国生物技术公司Mitobridge,Inc.以及英国生物技术公司Nanna Therapeutics,在线粒体疾病治疗分子和先进化合物筛选技术方面打下基础。目前的主要治疗领域涉及原发性线粒体肌病(PMM)、杜氏肌营养不良(DMD)等。
其腺病毒载体(AAV)技术平台不仅可用于基因疗法的开发,还为细胞疗法提供基因编辑技术,从临床研究到商业化应用实现了自给自足。该技术助力公司在遗传调控、失明与再生疗法、免疫肿瘤学、线粒体生物学以及免疫稳态领域的研究。
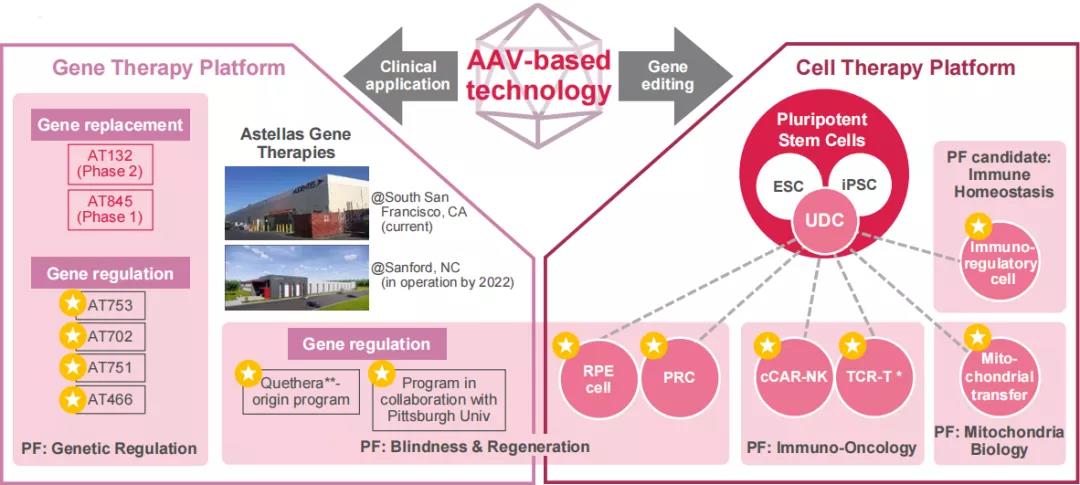
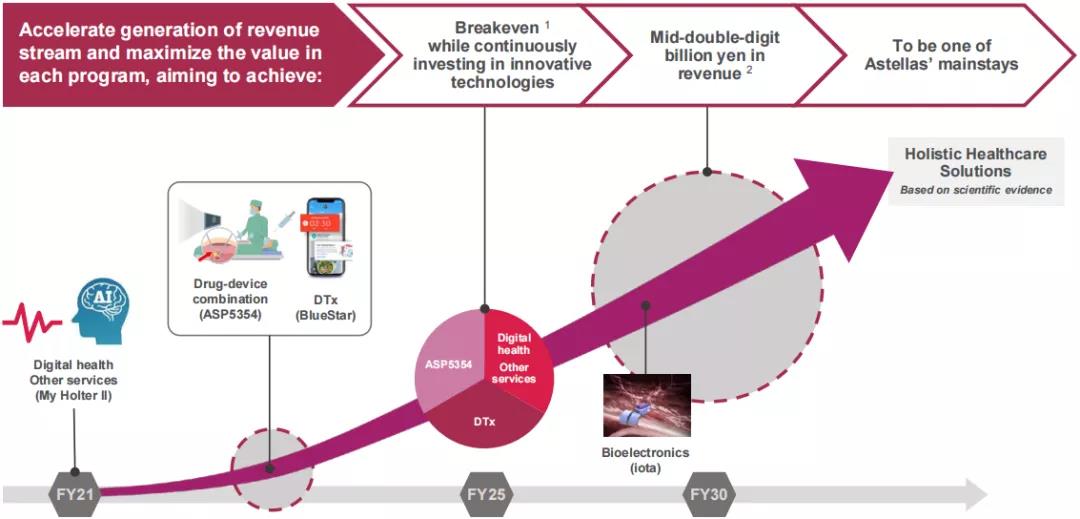
除此之外,公司的Rx+®业务平台利用安斯泰来的专业知识和业务,将创新医疗技术与不同领域的前沿技术相结合,通过“患者旅程”(整体医疗,包括诊断、预防、治疗和预后护理)管理,创造新的收入来源。该平台致力于慢性疾病进展的预防,实现患者预后的最大化,为患者提供基于科学证据的整体医疗保健解决方案。未来,该业务将涉及数字健康服务、药械组合产品、可穿戴设备、微型植入设备及生物传感等,并有望成为公司的支柱业务之一。
根据公司官方披露,安斯泰来目前的研发工作可分为2个主要部分:XTANDI以及战略产品,包括XTANDI、XOSPATA、PADCEV、zolbetuximab、Evrenzo、fezolinetant和AT132;焦点领域项目,包括失明与再生疗法、线粒体生物学、遗传调控、免疫肿瘤学领域等。

安斯泰来Pipeline概览图源:安斯泰来财报
(更新至2021年7月29日)
五、XTANDI以及战略产品
XTANDI(恩扎卢胺,enzalutamide)由安斯泰来与辉瑞合作开发,2012年首次获美国FDA批准,用于治疗晚期前列腺癌。该药于2021年4月在欧洲获批转移性去势敏感性前列腺癌(M1CSPC)新适应症,2020年底XTANDI在国内纳入医保,新版医保目录从2021年3月起实施,用于雄激素剥夺治疗(ADT)失败后无症状或有轻微症状且未接受化疗的转移性去势抵抗性前列腺癌(CRPC)成年患者的治疗。药融云数据(www.pharnexcloud.com)显示,该药正在国内开展一项多中心、随机、双盲、安慰剂对照的3期临床试验,比较恩扎卢胺联合雄激素剥夺疗法(ADT)与安慰剂联合ADT,用于治疗转移性激素敏感性前列腺癌(mHSPC)患者的安全性和疗效。

来源:药融云数据库
PADCEV(enfortumab vedotin-ejfv)由Seagen与安斯泰来合作开发,是一款靶向Nectin-4的first-in-class抗体偶联药物(ADC),2019年12月18日,FDA批准Padcev上市,用于治疗曾经接受过含铂化疗和PD-1/PD-L1抑制剂治疗的局部晚期或转移性尿路上皮癌患者。2021年7月,FDA授予Padcev常规批准并批准其扩大适应症,用于治疗既往接受过PD(L)-1抑制剂治疗且不符合顺铂治疗条件的局部晚期或转移性尿路上皮癌。据悉,Padcev是首款也是目前唯一一款被FDA批准,用于治疗既往接受过免疫治疗且不符合顺铂治疗条件的局部晚期或转移性尿路上皮癌患者的药物。(详情可点击:深耕的魔法子弹:ADC领域先驱Seagen的过去与未来)目前,该药用于一线治疗转移性尿路上皮癌(mUC)的研究已进入3期临床试验,并计划于2021财年第二季度在国内开启一项二期桥接试验。同时,该药用于治疗肌层浸润性膀胱癌(MIBC)的潜力也在3期临床试验中接受检验,并于2021年5月完成首例患者给药。此外,Padcev单药治疗局部晚期或转移性实体肿瘤的研究已进入2期临床试验,公司还计划于2021财年第二季度开启一项针对非肌层浸润性膀胱癌(NMIBC)的1期临床试验。
XOSPATA(gilteritinib,吉列替尼)于2018年在日本和美国获批用于治疗FLT3突变阳性的复发/难治性急性髓系白血病(AML)成人患者。2021年2月,国家药监局附条件批准该药用于治疗携带FLT3突变的复发/难治性急性髓系白血病(AML)成人患者,中文商品名为适加坦®。目前,该药正在国内开展一项多中心、开放标签的随机3期临床试验,以评估该药对比补救性化疗,治疗携带FLT3突变的复发或难治性急性髓系白血病(AML)的疗效。此外,该药用于急性髓系白血病(AML)造血干细胞移植后维持治疗的潜力正在3期临床试验中接受检验,用于治疗可接受强化疗的新诊断急性髓系白血病(NDAML)患者的研究也已进入3期临床试验。
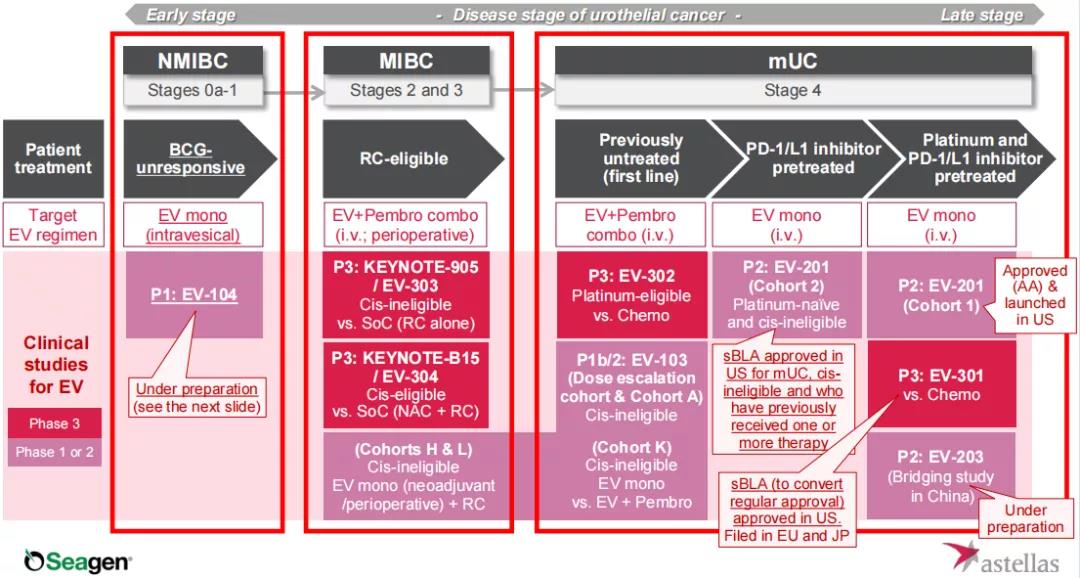
Evrenzo(roxadustat,罗沙司他)由安斯泰来与珐博进(FibroGen)合作开发,该药于2021年8月获欧盟批准用于治疗慢性肾脏病(CKD)相关贫血,包括非透析依赖性(NDD)患者和透析依赖性(DD)患者。值得一提的是,Evrenzo是欧洲批准的首个口服给药的缺氧诱导因子(HIF)脯氨酰羟化酶(PH)抑制剂,用于治疗与CKD相关的贫血,无论患者透析状态如何。同时,该药用于治疗化疗相关贫血的研究已进入2期临床试验。
Fezolinetant是一种神经激肽-3受体(NK3R)拮抗剂,作为一种创新型口服非激素类化合物,被研究用于治疗中重度血管收缩症状(VMS),即更年期相关的潮热。该药原为比利时生物技术公司Ogeda开发,2017年安斯泰来收购Ogeda,获得fezolinetant。2021年2月,安斯泰来宣布,fezolinetant在名为SKYLIGHT1和SKYLIGHT2的两项关键性3期研究取得了积极结果,试验结果显示,两项关键性试验均达到了4个主要的共同终点,与安慰剂组相比,每天接受30mg和45mg剂量的fezolinetant的女性受试者,中度至重度女性血管舒缩症状(VMS)的发生频率和严重程度,从基线到第4周和第12周在统计学上均实现了显著性的降低。此外,公司计划在2021财年第三季度在日本开启针对更年期相关VMS的2期临床试验。
Zolbetuximab原为德国生物制药公司Ganymed开发的一款靶向Claudin18.2蛋白的单克隆抗体,2016年10月,安斯泰来收购Ganymed公司,获得zolbetuximab。在2016年ASCO会议上,Ganymed公布了一项zolbetuximab治疗胃癌患者的2期临床试验数据,研究显示:zolbetuximab+化疗将患者的中位总生存期从8.4个月提高到了13.2个月;在Claudin18.2高表达患者中,中位总生存期更是从9个月提高到16.7个月。这一惊艳数据的公布使zolbetuximab成为了当年ASCO会上的“黑马”,Claudin18.2靶点也引起了业界更广泛地关注。目前,zolbetuximab正在开展针对胃癌或胃食管交界处(GEJ)腺癌的3期临床试验,以及针对胰腺癌的2期临床试验。药融云数据(www.pharnexcloud.com)显示,国内外已有超30家药企布局了Claudin18.2靶向药物的开发。
AT132原为美国基因治疗公司Audentes开发的一款用于治疗X-连锁肌小管性肌病(XLMTM)的基因疗法,XLMTM是一种罕见的单基因疾病,其特征为极端肌肉无力,呼吸衰竭和早期死亡,该病由MTM1基因突变引起的,MTM1基因可以编码肌管蛋白(myotubularin)。肌管蛋白在骨骼肌细胞的发育、维持和功能方面起着重要作用。AT132由AAV8载体装载MTM1基因的功能性拷贝。单次静脉给药后,AAV8可将正常基因递送至骨骼肌,从而增加组织中肌管蛋白的表达。2020年,安斯泰来收购Audentes,获其在研产品管线。ASPIRO是一项开放标签的剂量递增试验,旨在评估AT132用于治疗5岁以下XLMTM患者的安全性和初步有效性。但在2020年,该试验中有3名患者接连去世,FDA不得不暂停该项试验,这3名患者此前均患有肝胆疾病。2021年7月,安斯泰来宣布恢复ASPIRO剂量递增试验,并计划再招募3名患者进行低剂量试验。2021年8月,AT132 基因疗法临床试验中出现了第三起死亡事件。基因治疗领域,任重道远!
六、焦点领域
除了上述产品,安斯泰来的焦点领域涵盖遗传调控、免疫肿瘤学、失明与再生疗法、线粒体生物学等。
ASP1128是一款选择性PPARδ调节剂,原由美国生物制药公司Mitobridge开发,用于治疗冠状动脉搭桥和/或瓣膜(CABG/V)手术后发生中重度急性肾损伤(AKI)风险增加的患者,目前该药正在2期临床试验中接受检验。
ASP-0367是安斯泰来从Mitobridge获得的另一款选择性PPARδ调节剂,用于治疗原发性线粒体肌病(PMM),2021年6月,该药物针对PMM的2/3期研究完成首例患者给药,其针对杜氏肌营养不良的研究已进入1期临床试验。
ASP3772是一款24价肺炎球菌病疫苗,由安斯泰来与Affinivax公司合作开发,利用了Affinivax公司的独创多抗原呈现系统(MAPS)技术平台,可同时呈现蛋白抗原和多糖抗原,从而激发更广泛和强劲的免疫反应。2期研究显示,该疫苗在65-85岁成年人中具有良好的耐受性,并显示出与Prevnar13和Pneumovax23相当或更强的免疫应答。目前,该疫苗针对幼儿(12-15个月)的1期研究正在进行中,并计划开展针对成人的3期临床试验。
FX-322是一款内耳祖细胞激活剂,通过祖细胞活化(PCA)促进内耳毛细胞的生长,用于治疗稳定感音神经性听力损失(SSHL)。这种再生疗法由Frequency Therapeutics与安斯泰来合作开发,安斯泰来拥有该药在美国以外地区的开发和商业化权利。1/2期研究显示,FX-322在单次鼓室内注射后具有良好的耐受性,并且没有严重的不良反应。在多名采用FX-322疗法治疗的患者中,可以观察到听力功能的明显改善。目前该药正在2期临床试验中接受检验。
七、企业历史
- 2005年4月,前日本山之内制药株式会社(成立于1923年)与藤泽制药株式会社(成立于1894年)合并成立安斯泰来,合并后的公司整合了两家前身公司的技术与产品,成为全球制药巨头之一。
- 2006年4月,安斯泰来将非处方药业务Zephama出售给日本第一三共株式会社,将资源集中到处方药业务上。
- 2007年12月,安斯泰来收购美国癌症治疗性抗体研发生物技术公司Agensys。
- 2010年6月,收购了美国生物技术公司OSI,创建肿瘤学研发平台。
- 2013年5月,安斯泰来与安进达成协议,在日本共同创立一家合资公司,名为Amgen-Astellas BioPharma K.K.(AABP)(现已成为安进在日本的全资子公司,更名为Amgen K.K.)。
- 2016年2月,安斯泰来收购从事眼科研究的美国生物技术公司Ocata Therapeutics;12月,安斯泰来收购德国生物制药公司Ganymed Pharmaceticals AG,获其Claudin 18.2靶向单克隆抗体Zolbetuximab,进一步扩大肿瘤学业务。
- 2017年5月,收购比利时药物发现公司Ogeda SA,获其选择性NK3受体拮抗剂fezolinetant。
- 2018年1月,收购美国生物制药公司Mitobridge, Inc.,加速线粒体功能障碍相关疾病的研究;2月,收购Universal Cells, Inc.,获得具有较低免疫排斥反应多能干细胞的生产技术;8月,收购英国基因治疗公司Quethera,获其青光眼新型基因疗法项目,进一步推动眼科治疗领域的创新策略;12月,安斯泰来收购专注于肿瘤学研究的美国生物技术公司Potenza Therapeutics Inc.,获其临床阶段新型免疫肿瘤学项目。
- 2019年12月,收购美国生物技术公司Xyphos Biosciences, Inc.,加速下一代癌症免疫治疗研究。
- 2020年1月,收购美国基因治疗公司Audentes Therapeutics, Inc.;4月,收购从事线粒体功能障碍相关疾病研究的英国生物制药公司Nanna Therapeutics Limited;10月,收购美国生物电子设备开发商iota Biosciences, Inc.,探索运用超小型植入式医疗设备进行生物传感和疾病治疗。

八、安斯泰来在中国
安斯泰来中国总部设在北京,工厂位于沈阳经济技术开发区,在上海、北京、广州、成都、沈阳、青岛和武汉分别设有7个分公司,目前在中国市场销售的产品涉及移植免疫、泌尿、感染、以及风湿过敏等多个专业治疗领域。近年来,中国的药物审评审批改革和医药市场的快速扩张正受到日本医药行业的广泛关注,作为日本在华投资的最大药企之一,安斯泰来将中国视为全球增长战略中至关重要的一部分。2018年开始,安斯泰来加速对中国市场的新药投放,2018年12月,贫血药物罗沙司他在中国获批,先于日本和美国,显示出中国药物审评审批改革取得明显的成效,以及安斯泰来对中国市场的重视与乐观态度。目前,安斯泰来在中国主要销售的药品有普乐可复(他克莫司)、爱瑞卓(罗沙司他)、哈乐(盐酸坦索罗辛胶囊)、卫喜康(琥珀酸索利那新片)、贝坦利(米拉贝隆缓释片)等。2020年12月,安斯泰来与百洋医药就急性髓系白血病(AML)药物XOSPATA®(富马酸吉瑞替尼片)达成进口和总经销相关合作,2021年2月,该药在国内获批上市,为中国AML患者带来了一款创新疗法,填补了国内携带FLT3突变的复发或难治性AML患者无获批靶向药可用的空白。未来,安斯泰来将持续开拓中国市场,提升中国患者的用药可及性。
九、结语
相比于武田制药、第一三共等日本公司,安斯泰来似乎更加低调,但作为一家血统纯正的日本药企,安斯泰来的起点并不低。其前身之一藤泽制药手握免疫抑制“神药”他克莫司(Tacrolimus,FK506),其疗效与安全性均碾压同一作用机制的环孢素(CsA),并成为肝、肾移植的一线用药;其另一家前身公司山之内制药则在泌尿领域处于领先地位,前列腺增生药物“哈乐”、膀胱过度活动症药物“卫喜康”均出自山之内制药,安斯泰来因此成为器官移植、泌尿领域的全球领导者。安斯泰来不但继承了两家前身公司的专业优势,还相继布局了免疫肿瘤学、基因治疗、再生医学、神经科学、线粒体生物学等领域。在未被开拓的新领域探寻新的事业机遇,安斯泰来“立志处于不断变化的医疗行业最前沿”。
十、彩蛋
最后值得一提的是,安斯泰来在2016年收购的Ganymed公司背后隐藏着一对“梦幻组合”。
二战之后,德国从土耳其引进了大批工人,这些工人及其后代都成为了土耳其到德国的第一代移民,UgurSahin就是其中之一,4岁时随家人移居德国,父亲在福特工厂工作,而他从小就想成为一名医生。1990年,Sahin从科隆大学(Universityof Cologne)医学院毕业,后来他遇到了出身于医生世家,同为土耳其移民后代的ÖezlemTüreci。两人专注于免疫系统的研究,尝试从免疫系统着手来攻克癌症。2001年,他们创立了Ganymed公司,并开发出了firstin class抗Claudin18.2单克隆抗体,2016年,该公司被安斯泰来收购,不过当时,他们已经创立了另一家公司——现在的全球mRNA疗法领域的三巨头之一BioNTech,Sahin担任BioNTech的联合创始人兼首席执行官,Türeci担任联合创始人兼首席医疗官。起初BioNTech致力于癌症免疫研究,但是新冠疫情出现后,Sahin认为用于抗癌药物的mRNA研究也可以用于研发新冠mRNA疫苗——“这是一项人道工作”,他在BioNTech迅速启动“光速(Light Speed)计划”,调派近500名员工着力研究新冠病毒疫苗,再与辉瑞和复星医药达成合作,然后就有了后面的故事……
他们对“科学的献身”不止于此,据说2002年他们举行婚礼的那天早上Sahin还在实验室工作,实验室也是他们“度蜜月”的地方。虽然他们现在很富有,但是这对“凡尔赛”夫妇仍然住在一间简陋的公寓里,每天骑自行车上下班……辉瑞的首席执行官AlbertBourla曾表示:“Ugur Sahin是一个非常独特的人,他只关心科学,谈生意不是他的事,他是一位科学家,一位有原则的人,我百分百信任他。”在美因茨大学和Sahin同事多年的肿瘤学教授Matthias Theobald表示:“他是个很谦虚谨慎的人,但是他的梦想,以及实现梦想的决心却一点也不谦逊。”

Ugur Sahin和ÖezlemTüreci
图源:Financial Times

















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论