最近有人问小编,申报一个仿制药需要多少注册费用,一下子还把我难住了,今天分享下吧。药品注册收费到底多少?估计很多不直接做注册的朋友不太熟悉,NMPA对药品注册费用按照药品注册分类情况,进行了规定。近些年发布过2次:
2015年:国家食品药品监督管理总局关于发布药品、医疗器械产品注册收费标准的公告(2015年第53号)。
2020年:国家药监局关于重新发布药品注册收费标准的公告(2020年 第75号)。
2次,药品注册费用没有区别,第二次因为新冠疫情发生后,在新型冠状病毒感染的肺炎疫情防控期间,对进入药品特别审批程序、治疗和预防新型冠状病毒感染肺炎的药品,免征药品注册费。
据《药品注册管理办法》(国家市场监督管理总局令 第27号)、《关于重新发布中央管理的食品药品监督管理部门行政事业性收费项目的通知》(财税〔2015〕2号)和《关于印发〈药品、医疗器械产品注册收费标准管理办法〉的通知》(发改价格〔2015〕1006号),国家药品监督管理局制定了《药品注册收费标准》《药品注册收费实施细则》,现予公布,自2020年7月1日起施行。
对于2020年7月1日前受理的药品注册申请,自7月1日起15个工作日内未按要求缴费的,终止药品注册程序。
根据《关于新型冠状病毒感染的肺炎疫情防控期间免征部分行政事业性收费和政府性基金的公告》(财政部 国家发展改革委 2020年 第11号),在新型冠状病毒感染的肺炎疫情防控期间,对进入药品特别审批程序、治疗和预防新型冠状病毒感染肺炎的药品,免征药品注册费。
以往规定与本公告不一致的,以本公告为准。
特此公告。
附件:
1.药品注册收费标准
2.药品注册收费实施细则
国家药监局
2020年6月30日
附件1药品注册收费标准.docx
附件2药品注册收费实施细则.doc
附件1
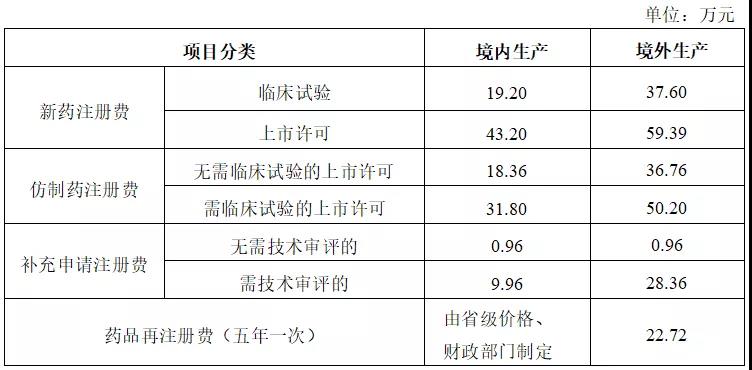
药品注册收费标准
国家药品监督管理局和省级药品监督管理部门依照法定职责,对药物临床试验申请、药品上市许可申请、补充申请和再注册申请开展行政受理、现场检查/核查、技术审评等注册工作,并按标准收取有关费用。具体收费标准如下:
注:
1.药品注册收费按一个原料药或一个制剂为一个品种计收,如再增加一种规格,则按相应类别增收20%注册费。
2.《药品注册管理办法》中属于省级药品监督管理部门备案/报告类变更或国务院药品监督管理部门备案/报告类变更的申请事项,不收取注册费。
3.申请一次性进口药品(药材)的,按照一个药品(药材)收取药品注册费0.20万元。
4.境外生产的药品注册收费标准在境内相应注册收费标准基础上加收境内外检查交通费、住宿费和伙食费等差额。
5.港、澳、台药品注册收费标准按境外生产的药品注册收费标准执行。
6.药品注册加急费收费标准另行制定。
附件2
药品注册收费实施细则
依据《药品注册管理办法》《关于重新发布中央管理的食品药品监督管理部门行政事业性收费项目的通知》和《关于印发〈药品、医疗器械产品注册收费标准管理办法〉的通知》等有关规定,制定本实施细则。
一、药品注册费缴费程序
(一)新药注册申请
注册申请人向国家药品监督管理局药品审评中心提出药物临床试验或药品上市许可申请,国家药品监督管理局药品审评中心受理后出具《行政许可项目缴费通知书》(见附件,下同),注册申请人按要求缴纳。
(二)仿制药注册申请
注册申请人向国家药品监督管理局药品审评中心提出申请,国家药品监督管理局药品审评中心受理后出具《行政许可项目缴费通知书》,注册申请人按要求缴纳。
仿制药需要申报临床的,缴纳临床注册费13.44万元(境内生产的缴纳31.80万元-18.36万元=13.44万元,境外生产的缴纳50.20万元-36.76万元=13.44万元)。临床试验完成后,申报上市许可申请的,按照无需临床试验的上市申请收费,境内生产的缴纳18.36万元,境外生产的缴纳36.76万元;仿制药直接申报上市许可并自行取得临床数据的,境内生产的缴纳31.80万元,境外生产的缴费50.20万元。无需临床试验的,境内生产的缴纳18.36万元,境外生产的缴纳36.76万元。
(三)补充申请注册
注册申请人向国家药品监督管理局药品审评中心提出审批类补充申请,国家药品监督管理局药品审评中心受理后出具《行政许可项目缴费通知书》,注册申请人按要求缴纳。
(四)境外生产的药品再注册申请
注册申请人向国家药品监督管理局药品审评中心提出申请,国家药品监督管理局药品审评中心受理后出具《行政许可项目缴费通知书》,注册申请人按要求缴纳。
二、药品注册费缴费说明
(一)根据《化学药品注册分类及申报资料要求》注册分类,1类、2类的化学药品按照新药注册费标准缴费,3类、4类、5类按照仿制药注册费标准缴费;根据《生物制品注册分类及申报资料要求》注册分类,所有类别的生物制品按照新药注册费标准缴费;根据《中药注册分类及申报资料要求》注册分类,中药创新药、中药改良型新药按照新药注册费标准缴费,古代经典名方中药复方制剂、同名同方药及其他类按照仿制药注册费标准缴费。
(二)补充申请(需技术审评的),是指补充申请事项中需技术审评事项。
(三)补充申请(无需技术审评的),是指申请使用商品名等国家药品监督管理局规定需要审批的其他无需技术审评事项。
(四)药品注册申请受理后15个工作日内按照要求缴纳注册费,申请人缴费时间以国家药品监督管理局收到汇款日期为准。未按要求缴纳的,终止药品注册审评审批。
三、化学原料药缴费
(一)化学原料药注册申请
仿制境内已上市药品所用的化学原料药在原辅包平台登记的,按照仿制药上市许可收费标准缴费,境内生产的18.36万元,境外生产的化学原料药上市许可申请缴纳36.76万元。与制剂一并提交的,在相应制剂的受理号下缴费。
其他化学原料药申请上市时,按相应收费标准的50%缴费。
临床试验申请阶段,与制剂一并提交,只给制剂审批结论,不收取费用;上市许可申请阶段,在原辅包平台登记的或与制剂一并提交申请的,境内生产的化学原料药缴纳21.60万元,境外生产的化学原料药缴纳29.695万元。与制剂一并提交的,在相应制剂的受理号下缴费。
仿制药所用的化学原料药是未在境内已上市制剂所用的化学原料药的,按照仿制境内已上市药品所用的化学原料药缴费。
(二)化学原料药补充申请
化学原料药申报补充申请,在原辅包平台登记的或与制剂一并提交申请的,按照需技术审评的收费标准缴纳。与制剂一并提交的,在相应制剂的受理号下缴费。属于备案和报告类变更的无需缴费。
四、小微企业收费优惠政策
(一)优惠范围
符合国务院规定的小微企业提出的符合下列情形的创新药注册申请,免收新药注册费。
1.治疗艾滋病、恶性肿瘤,且未在国内上市销售的从植物、动物、矿物等物质中提取的有效成份及其中药。
2.未在国内外上市销售的通过合成或者半合成的方法制得的化学原料药及其制剂。
3.治疗用生物制品注册分类1类和预防用生物制品注册分类1类。
此外,符合国务院规定的小微企业,已按规定免收临床试验注册费的创新药,在临床试验期间提出的补充申请免收注册费。
(二)需提交的材料
对符合《中小企业划型标准规定》(工信部联企业〔2011〕300号)条件的注册申请人,申请小微企业收费优惠政策时向执收单位提交下述材料:
1.《小型微型企业收费优惠申请表》(见附表);
2.企业的工商营业执照副本;
3.上一年度企业所得税纳税申报表(须经税务部门盖章确认)或上一年度有效统计表(统计部门出具)。
另外,境内生产药品注册申请在填写注册申请表时,选择相应类别即可。
(三)认定标准及监管
非生产企业按《中小企业划型标准规定》(工信部联企业〔2011〕300号)中“其他未列明行业”来判定小微,生产企业按“工业”来判定小微。提交临床/上市注册申请须要求申请人和生产企业同时符合小微企业认定条件。
申请小微企业的,须与注册申请同时提交,受理后不再受理小微企业申请,申请人应按相应注册费用缴纳。
五、其他问题说明
(一)补缴费用问题。如涉及补缴费用的,按照国家药品监督管理局规定的程序补缴。
(二)退费问题。因申请人原因错汇的,由申请人向国家药品监督管理局行政事项受理服务和投诉举报中心提出,并递交退费申请、汇款凭证、《非税收入一般缴款书》(收据)等有关材料;非因申请人错汇的,由国家药品监督管理局
药品注册管理司向国家药品监督管理局行政事项受理服务和投诉举报中心下发退费通知书,国家药品监督管理局行政事项受理服务和投诉举报中心与注册申请人联系,并由注册申请人提交退费申请、汇款凭证、《非税收入一般缴款书》(收据)等材料,于每年4月底或10月底前按规定办理退费手续。因申请人注册受理后主动提出撤回注册申请的,或国家药品监督管理局依法做出不予许可决定的,已缴纳的注册费不予退回。再次提出注册申请的,应当重新缴纳费用。
(三)药械组合产品。药械组合产品以发挥主要作用的物质为准,相应收取注册费。
附:
1.小型微型企业收费优惠申请表
2.国家药品监督管理局行政许可项目缴费通知书










收藏
登录后参与评论