注:本文不构成任何投资意见和建议,以上市公司或公司公告为准;本文仅作医疗健康相关药物介绍,非治疗方案推荐(若涉及)。
随着各类国内医药企业不断升级、转型、创立;资本不断涌入这个生物医药大健康市场;相信在若干年后,中国新芽/新药也会在全球制药市场上展露头角。目前国内有部分企业已经在瞄准做first in class/first in indication新药;当然这是一条很较难的路。因为可参考的历史/经验太少。时下,fast follow/me-too/me better(也有可能me worse)异常激烈,如何转化前沿靶点、立项选择成了难题。
First in class新药的定义是什么,国内外药监机构并没有诠释。每个读者可能有自己的理解。我们认为不管是什么类型的药物(创新/仿制药),只要能满足患者的需求以及可及,那就是好药。药融圈本篇头条文章仅部分举例一些正在做first in class/first in indication新药的企业,作为参考;欢迎文尾补充留言。
国内这些药企在做first in class新药
学术界部分举例
1.王晓东院士最早于2010年,作为联合创始人参与百济神州的创建。目前公司在中美皆上市,在研发进展及对外合作方面业绩亮眼。

2018年,北生所(NIBS)王晓东院士和北生所张志远博士共同创建维泰瑞隆(Sironax),是一家全球性的专注于研发First-in-class化学药物的生物制药公司。公司针对王晓东院士在细胞凋亡、细胞程序性坏死等多种细胞死亡领域的原创性发现研发小分子抑制剂,致力于多种重大疾病的治疗。这些抑制剂针对的疾病包括神经退行性疾病如阿尔兹海默症、多发性硬化症、帕金森病等;缺血性疾病如脑卒中、肾缺血、心肌缺血;以及炎症性疾病如肠炎、银屑病、脓毒症等。涉及的靶点有RIP1 (张志远博士设计了一款该靶点新药SIR1) 、MLKL 等等。
据悉,王晓东院士实验室通过表型筛选(PhenotypicScreening)找到了一个小分子能够保护线粒体,使线粒体对凋亡信号不响应。用这个小分子在帕金森动物模型上进行了测试,结果显示该化合物能够逆转多巴胺类似物对神经元的损伤。目前该小分子权益已经转给了维泰瑞隆。
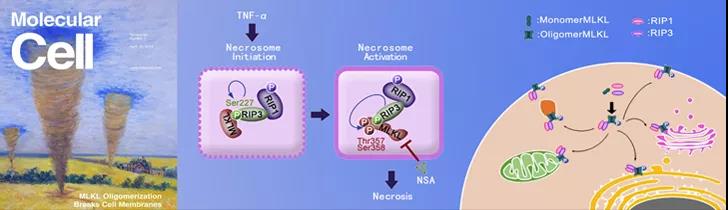
▲北生所官网图片
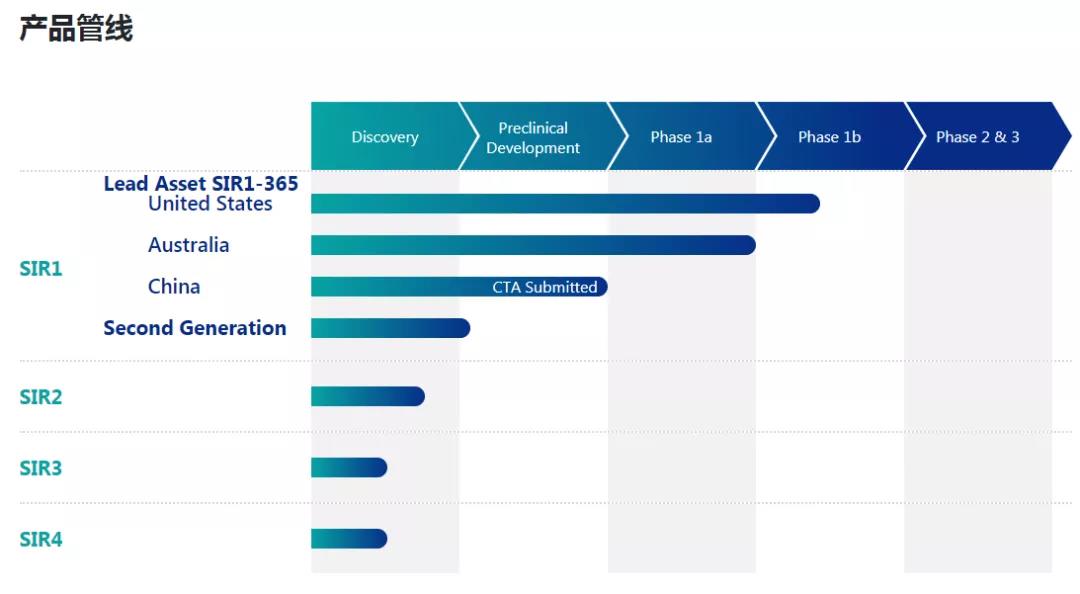
▲维泰瑞隆产品管线
2.2020年10月,炎明生物科技有限公司(Pyrotech Therapeutics)正式完成了注册。

炎明生物(Pyrotech Therapeutics)致力于开发治疗炎症性和肿瘤的革命性创新药物,并以中国科学家领先的科学发现为基础、以原始创新为驱动,打造全球领先的中国生物科技公司。炎明生物选择在炎症疾病和肿瘤领域尚未被攻克的医学关键问题为主要研究内容。
该公司由邵峰院士与邓天敬博士联合创立,目前已经获得超5000万美元的投资。邵峰院士现为炎明生物科创始人兼董事长,43岁当选中科院院士,是当时全国最年轻的院士。他本人主要从事病原菌和宿主相互作用的机理研究,在病原菌毒力机制和抗细菌天然免疫领域,以及细胞焦亡研究领域取得系列重要原创性发现。邵峰院士的发现为探索病原菌感染以及炎症、肿瘤等疾病的治疗提供了新的途径。邓天敬博士现为炎明生物创始人兼CEO。他2006年回国参与了保诺科技的创建。
北生所邵峰院士实验室重点研究的细胞焦亡机制上。最重要的成果之一在于发现执行细胞焦亡的一类关键蛋白—gasdermin家族蛋白。在感知病原或者危险信号后,这类蛋白会释放其膜打孔活性,导致细胞膜破裂,释放出细胞里面的炎症因子。炎明生物将基于发现的一系列与炎症小体或细胞焦亡相关的新靶点分子,搭建了有效的技术平台,以期获得候选药物分子。
3.2020年11月,美国乙肝基金会((Hepatitis B Foundation))宣布:中国学者/北生所资深研究员李文辉博士因发现乙肝病毒入侵肝细胞的受体而获得了2021年Baruch S. Blumberg Prize(巴鲁克•布隆伯格奖),以表彰他在推动乙肝科研和医疗方面做出的杰出贡献。巴鲁克•布隆伯格因发现乙肝病毒而获得1976年诺贝尔生理学或医学奖。巴鲁克•布隆伯格博士是乙肝基金会的共同创立者,于2011年去世。基金会的研究机构-巴鲁克•布隆伯格研究所,也是以他的名字命名。
李文辉2001年从协和医科大学获得博士学位之后,在位于波士顿的哈佛医学院从事博士后研究以及担任讲师。2007年,李文辉博士加入NIBS(北京生命科学研究所),开始聚焦于乙肝和丁肝病毒的感染研究,并最终发现一个在肝脏中表达丰富的多次跨膜的胆酸受体NTCP(牛磺胆酸钠共转运蛋白)是乙肝病毒和丁肝病毒的功能性受体。目前李文辉/隋建华博士创办的华辉安健(Huahui Health),目前正在开发的乙肝抗体新药HH-003,今年将开展Ⅱ期临床。
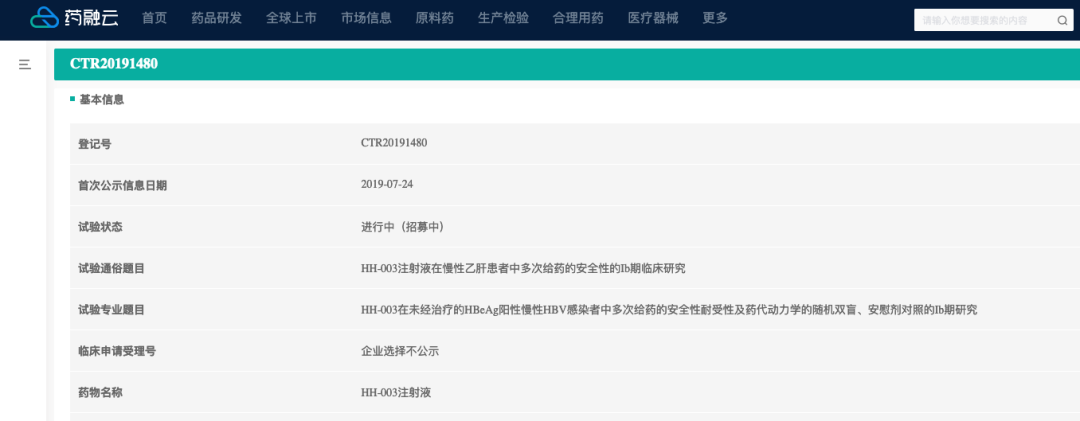
▲华辉安健产品临床信息,登陆www.pharnexcloud.com可查看
4.北生所黄牛博士与智刚博士成立的瑞璞鑫,在研究“老药新用”的同时开发了治疗肥胖相关代谢疾病和肠易激综合征的多款新药,即将进入临床试验。公司主要在研新药为治疗肥胖症的FTO蛋白小分子抑制剂、治疗肠易激综合征的5-HT2B受体拮抗剂和针对多种适应症(肿瘤、自身免疫性和病毒感染等)的α-kG依赖性酶家族蛋白成员。
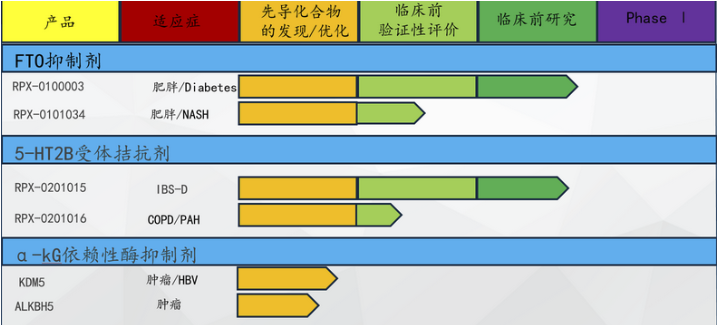
5.此外,北生所高级研究员汤楠博士成立的普沐生物,开发的治疗原发性肺纤维化候选药物,今年将申请临床试验。
制药工业界部分举例
6.2021年3月,德国默克与Debiopharm达成一项高达8.98亿欧元的交易合作,获得后者一款细胞凋亡蛋白抑制因子(IAP)拮抗剂xevinapant(Debio1143)。据悉,本品为亚盛医药前身亚生医药于2011年转让予Debiopharm。
国内亚盛医药研发的另一款IAP拮抗剂APG-1387当前也已正处于2期临床开发中,是目前国内研发进展最快的IAP拮抗剂。
7.西达本胺是微芯生物首个已上市产品,是中国药企独家发现且具有全球专利保护的新分子实体药物,也是全球首个亚型选择性组蛋白去乙酰化酶(HDAC)口服抑制剂。2006年,微芯将西达本胺的国际专利使用权以2800万美元的价格授予美国HUYA生物。
8.劲方医药是一家致力于“全球新”药物开发的创业公司,由资深海归药物开发专家携手专业风投机构于2017年在张江注册成立。劲方医药以免疫学为核心,聚焦肿瘤、自身免疫性疾病等多个治疗领域。高选择性CDK9抑制剂GFH009注射剂目前获得国家药品监督管理局(NMPA)签发的《临床试验通知书》,同意开展其针对复发性/难治性恶性血液肿瘤的临床试验。GFH009美国临床也已经启动。
9.纽福斯是中国首家专注于眼科疾病的基因治疗公司,作为一家面向临床阶段的高科技创新企业,公司致力于为全球眼科疾病患者探索和开发新疗法。纽福斯已建立丰富的产品管线,包含针对遗传性视神经萎缩、视神经损伤疾病、血管性视网膜病变等多种眼科疾病的10余个在研项目,从眼科罕见病逐步扩展到眼科常见病。公司最前沿的候选药物NR082(NFS-01项目,rAAV2-ND4)是用于治疗ND4突变引发的LHON的基因治疗药物,目前已经获准开展国内临床。
10.从在研项目来看,加科思围绕RAS、MYC、RB、I/O等肿瘤信号通路布局,拥有开发蛋白磷酸酶、KRAS和其他转录因子的变构抑制剂技术,专注于全球首创新药的自主研发。JAB-3068和JAB-3312是加科思自主研发的SHP2抑制剂,目前已有项目进入临床二期试验,与PD-1抗体、MEK抑制剂的联合用药的临床试验已经获得批准。2021年,针对不同适应症的Ib/IIa期临床试验将陆续有病人入组。
11.和记黄埔医药的苏泰达® (索凡替尼)(surufatinib/HMPL-012)上市 —— 于2021年1月中旬,获批后3周内在中国上市,用于治疗晚期非胰腺神经内分泌瘤(NET)患者。苏泰达®上市后首两个月(2021年1月至2月)未经审计的销售额为490万美元;以及建立了美国商业化团队 —— 于美国新泽西州招募了高级管理团队,负责索凡替尼在美国的上市前的准备工作。索凡替尼有可能在2021年底或2022年初于美国获批。
12.广州再极医药创始人王玉光博士将在大湾区(广州)生物医药创新者峰会:数千名医药人齐聚,即将开始的峰会发布主题为,研发First-in-Class 新药的实例分享;敬请关注。当然本次峰会也将有数十位资深的目标研发First-in-Class 新药的科学家分享。
13.君实生物成立于2012年12月,公司具有丰富的在研产品管线,包括28个创新药,2个生物类似物,覆盖五大治疗领域,包括恶性肿瘤、自身免疫系统疾病、慢性代谢类疾病、神经系统类疾病以及感染性疾病。目前君实生物布局的First-in-Class靶点新药有BTLA、IL-21、CD112R等等。
国内这些药企在做first in indication新药
1.恒瑞医药2021年4月收到国家药品监督管理局(以下简称“国家药监局”)核准签发关于 HR19042 胶囊的《药物临床试验批准通知书》,将于近期开展临床试验。
药品名称:HR19042 胶囊
受理号:CXHL2100013

审批结论:根据《中华人民共和国药品管理法》及有关规定,经审查,2021 年 1 月 7 日受理的 HR19042 胶囊符合药品注册的有关要求,同意开展临床试验, 适应症:用于治疗原发性 IgA 肾病。2020 年 12 月 31 日,公司向国家药监局提交本品临床试验申请,拟用于治 疗原发性 IgA 肾病。经查询,国内外尚无同类药物获批用于治疗原发性 IgA 肾病,亦无相关销售数据。截至目前,HR19042 相关研发项目累计已投入研发费用约为 557 万元。
2.开拓药业近期市值大涨,相比于去年年末。主要得益于新一代雄激素受体(AR)拮抗剂普克鲁胺(Proxalutamide)治疗新冠的积极临床研究。2021年3月4日,美国FDA同意普克鲁胺在美国开展治疗轻中症新冠男性的III期临床试验。
3.奥全生物 是一家以制剂改良型新药为主营业务,致力于创新药研发和产业化的国际化生物医药公司。奥全围绕患者的临床需求对药物进行针对性改良,探索新的治疗方法,包括新剂型、新适应症和新给药方案,产品通过505(b)(2)或二类新药途径报批美国FDA及中国NMPA,并引入市场,以满足国内外患者未被满足的临床需求。目前公司在研究阶段的ASN001活性成分为一种非选择性β-肾上腺素受体阻断剂,临床上用于治疗眼压升高或开角型青光眼患者的眼压升高,奥全开发的ASN001用于治疗新的皮肤适应症婴幼儿血管瘤。该产品已经获得NMPA的临床批件,已完成一期临床试验,目前正在中国开展多中心二期临床研究。
4.2020年11月4日,江阴贝瑞森制药有限公司提交的孟鲁司特钠凝胶临床申请获得CDE承办受理公示,本品首个按2.2/2.4类申报的孟鲁司特钠改良型新药。拟开展临床的适应症为:缓解痔疮引发的炎症、水肿等症状,促进创面愈合。

5.关于first in indication,中国药科大学的杨劲教授/博导将在大湾区(广州)生物医药创新者峰会:数千名医药人齐聚,即将开始分享为“新适应症,改良型新药的另一片蓝海”主题报告将部分涉及。







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论