
2024年3月,首个MASH药物Resmetirom获批,正式揭开了这一百亿级市场的序幕。在Q2-Q3期间,该药物实现了累计6000万美元的销售额,展现出强劲的市场潜力。同年10月,司美格鲁肽公布了针对MASH的F2-3患者群体的三期临床试验数据,并计划于明年提交上市申请。与此同时,FGF21和PPAR类药物也正在三期临床中快速推进,市场竞争日益激烈。面对这一充满机遇与挑战的市场,现有管线的临床数据有哪些亮点?未来的竞争格局将如何演变?治疗逻辑又会发生怎样的变化?
一、疾病简介
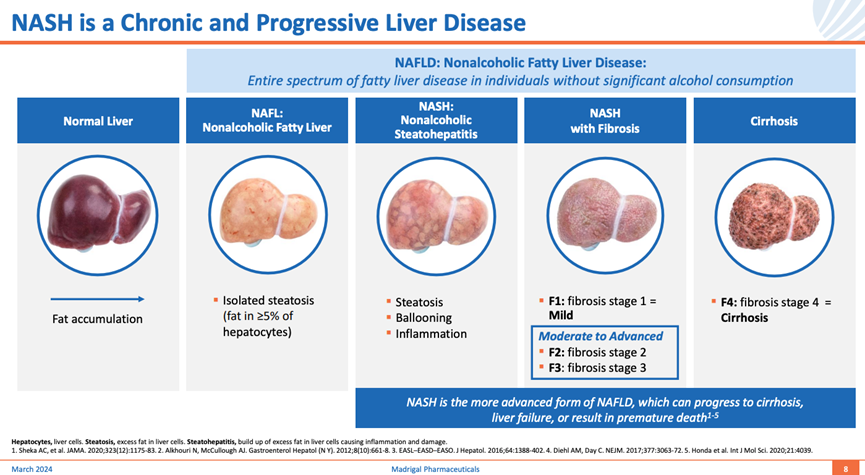
代谢功能障碍相关脂肪变性肝病(MAFLD)是一类肝脏中多余脂肪堆积(非酒精摄入)导致的疾病。脂肪在正常肝脏堆积超过5%的时候,形成非酒精性脂肪肝。随着疾病进展,肝脏产生炎症,导致不同程度纤维化或瘢痕的产生,进入代谢功能障碍相关脂肪性肝炎(MASH)。如果病情得不到有效控制,长期处于MASH状态可能导致肝硬化,并引发一系列严重并发症,如肝功能衰竭和肝细胞癌(HCC)。常见风险因素包括超重、代谢综合症、高胆固醇、高血压、高血糖、胰岛素抵抗/糖尿病、甲状腺功能低下等。
二、流行病学
MAFLD在全球范围内的患病率高达 30%,已成为一种广泛存在的健康问题。而在MAFLD患者中,约 5.27% 的人群进一步发展为MASH。按照纤维化进展的不同阶段,MASH患者的分布情况如下:F0(无纤维化)占比 10%-15%,F1(轻度纤维化)占比 30%-35%,F2(中度纤维化):占比 20%-25%,F3(重度纤维化)占比 15%-20%,代偿性肝硬化(F4C)占比 10%-15%,失代偿性肝硬化(F4D)占比 5%。
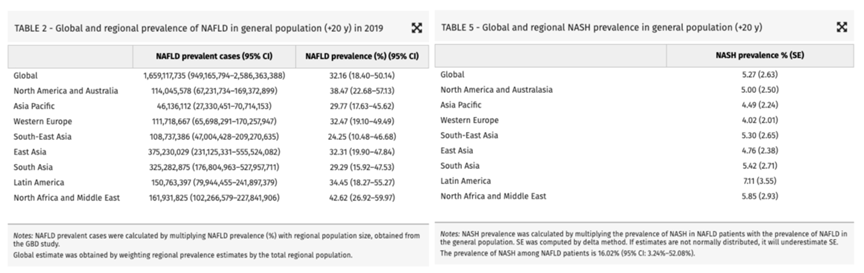
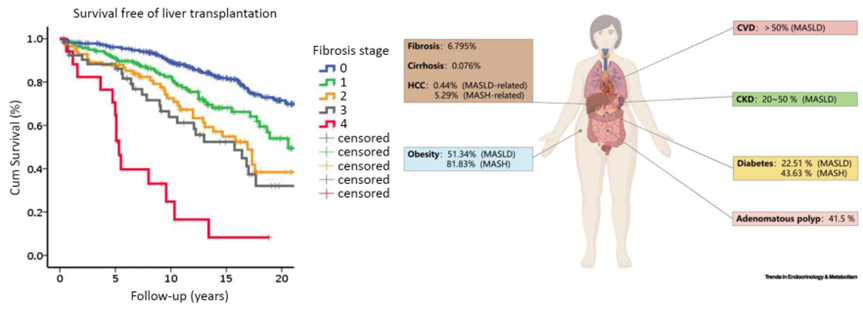
研究表明,在未干预的情况下,每7年纤维化程度可能增加一个等级,尤其在进展至中重度纤维化(F3或F4)时,患者的死亡风险显著升高。此外,MAFLD和MASH常伴随多种代谢性并发症,显著增加患者的疾病负担与管理难度。以下是常见并发症及其发生率:肥胖最为普遍,发生率高达 51%-81%;心血管疾病(CVD):发生率为 20%-50%;糖尿病发生率为 22%-43%。这些代谢性并发症不仅加速了肝病的进展,还进一步增加了全因死亡率。
三、疾病评分系统
在 MASH 的诊断和分级中,评分系统起着关键作用。目前,临床上广泛使用以下两种主要评分方法:
1. NAFLD活动评分(NAS)
由美国国立卫生研究院NASH临床研究网络(CRN)提出,NAS评分是临床试验中最常用的系统,主要基于以下指标:NAS < 3分,定义为非MASH;NAS ≥ 4分:定义为 MASH
NAS 3~4分,定义为 MASH可能。此外,NAS评分还结合肝纤维化分级(F0-F4),用以评估疾病的严重程度,F0-F1为轻度纤维化,F2-F4为中至重度纤维化。
2. SAF评分法
2012年,由欧洲脂肪肝研究小组提出的 SAF评分法,通过定量评估以下三项指标来诊断MASH:S(脂肪变性),A(炎症程度),F(纤维化程度)。当脂肪变性、肝细胞气球样变性和小叶炎症的评分均≥1时,即可确诊为MASH。
尽管NAS和SAF评分在MASH诊断中表现出较高的一致性,但NAS评分系统存在低估风险,尤其对边缘病例(NAS 3~4分)的判定偏保守。研究显示,约50%的NAS“边缘性”患者在使用SAF评分后被确诊为MASH。
因此,SAF评分法因其更全面的评估维度,在实际诊断中的应用正逐渐增加,成为更为敏感的MASH诊断工具。

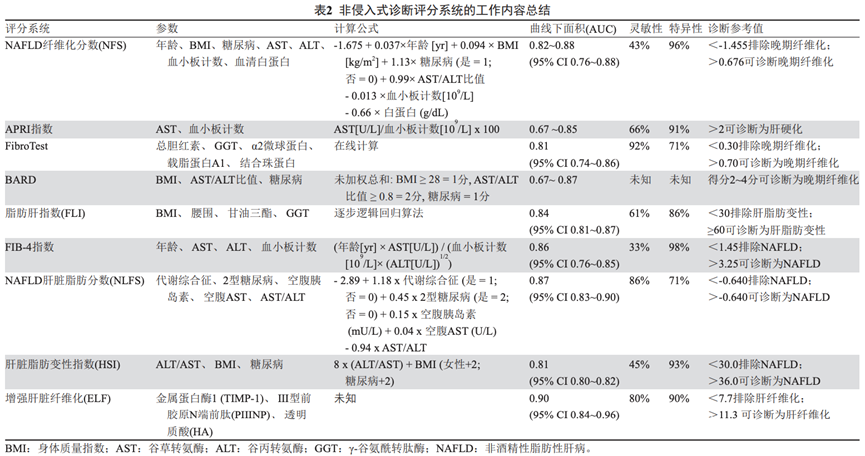
此外还有一些非侵入性的诊断评分方法。
四、市场潜力
MASLD的经济负担巨大,已成为全球医疗体系的重要挑战。2016年数据显示,美国每年的直接医疗成本高达 1030亿美元,远超德国、法国和意大利三国总和的 277亿欧元,以及英国的 52.4亿英镑。未来10年,美国MASLD的总经济负担预计将达 1万亿美元,欧洲则为 3340亿欧元。2024年,首个MASH药物 Resmetirom 上市后展现了显著市场潜力,其Q2和Q3的销售额分别为 1400万美元 和 4800万美元,累计 6200万美元,目标覆盖 31.5万名美国患者,截至Q3已有 6800名患者使用,并覆盖了 40%的顶级医生。当前其单片定价为 138.96美元,投行Evercore预测其峰值销售额可达 50亿美元。随着市场渗透加深、新药上市和治疗方案的完善,MASLD/MASH领域正迎来爆发式增长,未来潜力不可限量。
五、监管要求
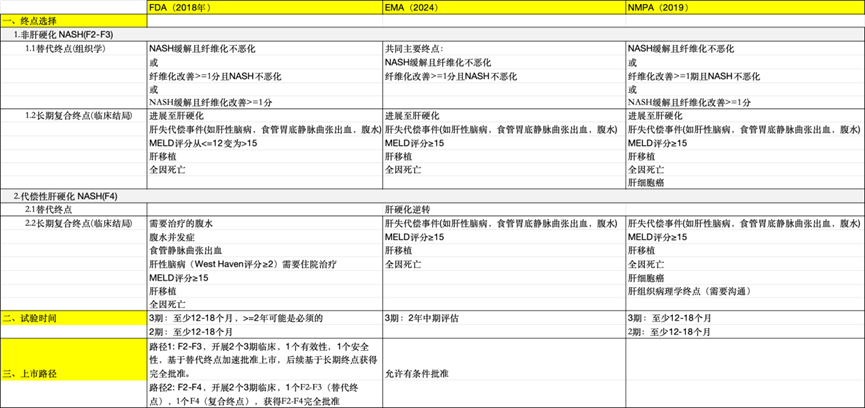
美欧中监管机构都支持替代终点上市,其中FDA给出了加速批准和完全批准上市的具体路径。在终点的选择上,FDA和EMA略有不同。
在 美、欧、中 三大地区的监管框架中,各机构均支持以替代终点作为上市审批的依据,这为MASH药物的开发提供了重要机遇。其中,FDA 明确制定了加速批准和完全批准的具体路径,为药物快速进入市场提供了便利。在终点选择方面,FDA和 EMA存在一定差异。
六、现有治疗手段
目前,治疗 MAFLD 主要依赖三种方式:生活方式干预、手术治疗和药物治疗。生活方式包括减少高热量食物摄入、运动等,手术包括减重手术和肝移植,药物治疗包含减肥、降血脂、降血压等多种药物。
其中,国内外指南推荐MASH药物治疗选择如下:AALSD推荐使用维生素E、噻唑烷二酮类(吡格列酮)、GLP-1激动剂(利拉鲁肽、 司美格鲁肽、替尔泊肽)、sglt-2抑制剂进行治疗。中华医学会推荐使用以下一种肝损伤治疗药物,水飞蓟素(宾)、多烯磷脂酰胆碱、双环醇、甘草酸制剂(异甘草酸镁、复方甘草酸苷、甘草酸二铵等)、还原型谷胱甘肽等。
2024年3月,FDA加速批准了 Resmetirom用于治疗 F2-F3 纤维化的MASH患者,成为美国首个获批的MASH药物,但目前尚未列入指南推荐。
从疾病严重程度来看,MASH无纤维化/轻度纤维化,依赖生活方式改善、手术或部分药物进行治疗,中度/重度纤维化,可使用Resmetirom进行治疗,代偿性肝硬化目前没有好的治疗手段,非代偿性肝硬化只能进行肝移植。
七、潜力疗法
目前,全球仅有 2款MASH药物 已上市,分别为 Resmetirom(美国上市)和 Saroglitazar(印度上市)。与此同时,全球目前共有超过500款MASH药物处于研发阶段,其中有 5款药物已进入3期临床试验,并且这些药物的试验结果表现积极,预计在未来几年内有望获得批准上市。

1. 作用机制
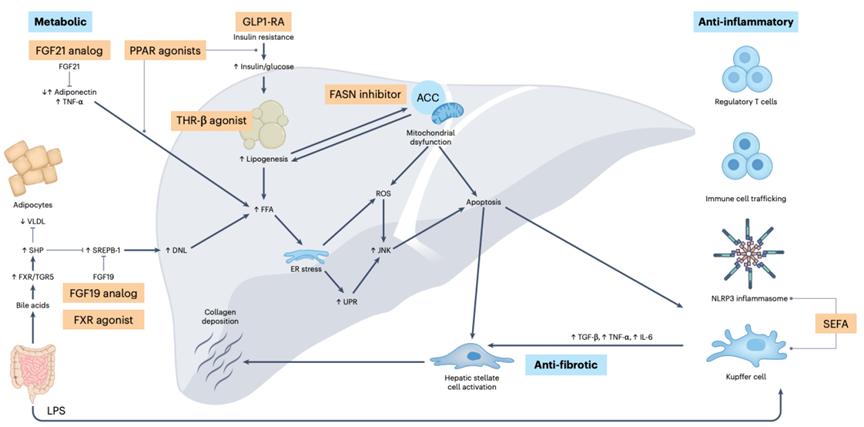
目前MASH的在研药物主要聚焦于改善代谢、抗炎和抗纤维化作用。FGF21、THRβ和PPAR在这些机制中发挥直接作用。FGF21和PPAR在全身组织中广泛表达,能够有效改善脂肪代谢、减轻炎症反应和纤维化进程;而THRβ则主要在肝脏中发挥作用,主要通过降脂作用对代谢产生影响。GLP-1主要在肠道和胰腺等部位发挥间接作用,能够调节血糖、抑制食欲、降低体重,并具有一定的肝脏保护作用。
2. MASH F2-F3临床数据
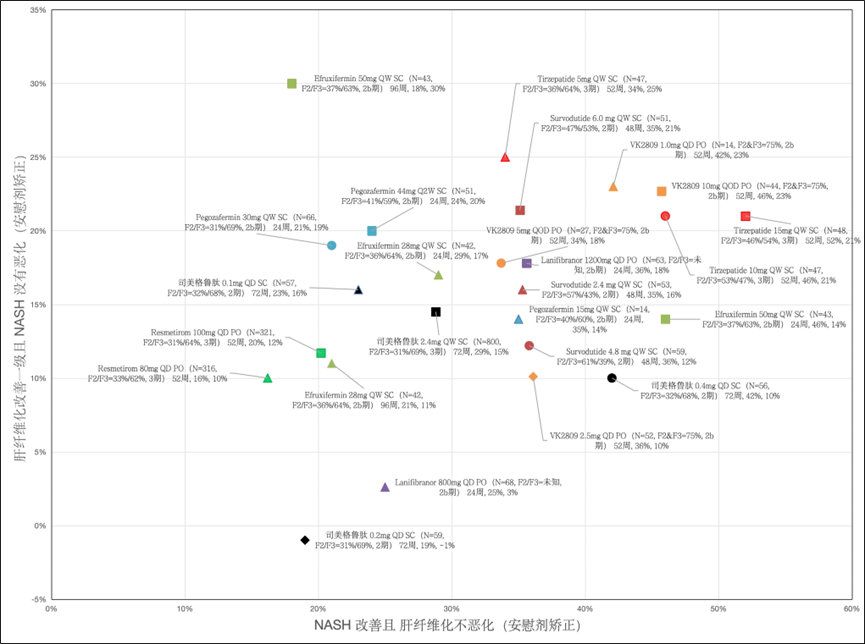
除司美格鲁肽和Resmetirom已公开3期临床数据外,其余药物均为2期临床结果。根据2项关键终点结果来看,Tirzepatide 15mg 对于MASH改善效果最好,52周时安慰剂校正后的MASH改善且纤维化不恶化的患者比例为52%,而Resmetirom 100mg 52周比例为20%。而Efruxifermin 50mg抗纤维化效果最好,96周时安慰剂校正后的肝纤维化改善1分且MASH不恶化的患者比例为30%,而Resmetirom 100mg 52周比例为20%。
从靶点来看,GLP-1单靶点抗纤维化效果有限,引入GCGR和GIPR后,可以进一步增强,Tirzepatide比Survodutide效果更优。THR-β药物中,VK2809效果远超Resmetirom,部分原因可能是基线差异大,VK2809试验中F2+F3比例75%,Resmetirom中比例为95%。
PPAR药物表现中规中矩,Lanifibranor 1200mg 24周在两项指标中处于中位,但是f2+f3人群占比最佳。FGF21药物抗纤维化效果好,起效快,Pegozafermin在24周时肝纤维化改善1分且MASH不恶化的患者比例为20%,两项数据略好于Efruxifermin,长期数据暂未公布。
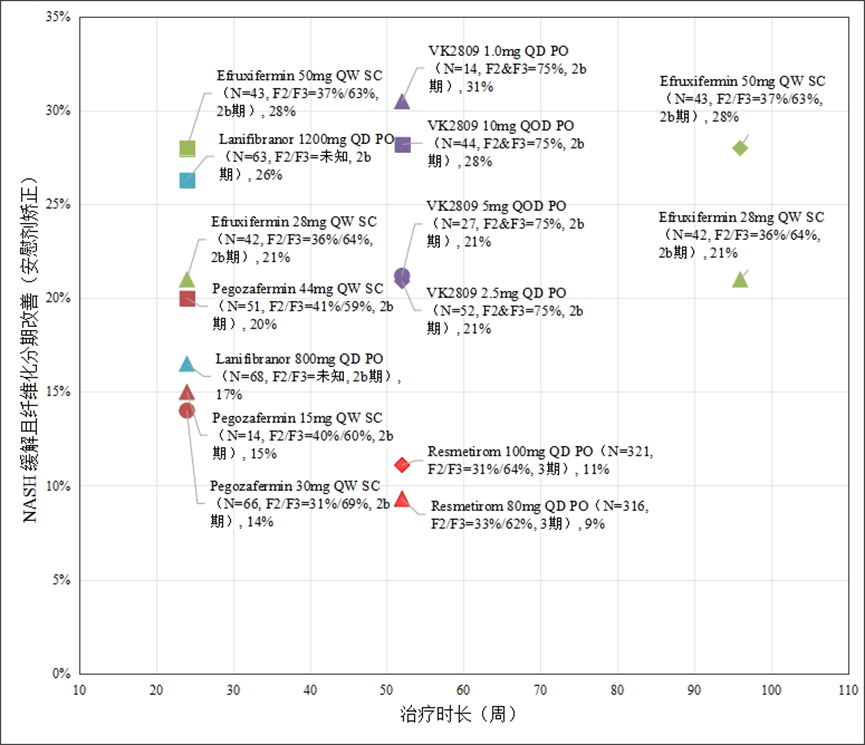
在MASH缓解且纤维化改善的指标上,Efruxifermin效果优于Resmetirom。在50mg剂量下,在24周和96周时的经安慰剂校正患者比例能维持在28%,而Resmetirom 100mg为11%。一项由Inventiva开展的样本量为95人的调查(包含支付方和医生)显示,99%的受访者认为,理想的药物应同时具备改善MASH和纤维化的能力。这对于Efruxifermin是显著优势。
所有药物均对胃肠道有一定影响,其中GLP-1类药物的不良反应发生率较高。以Survodutide 4.8mg为例,恶心发生率为68%,腹泻为56%,呕吐为46%。FGF21类药物的不良反应发生率较为中等,Efruxifermin 28mg的腹泻发生率为40%。THR-β类药物对胃肠道的影响较小,Resmetirom 100mg的腹泻发生率为33.4%。PPAR类药物对胃肠道的影响最轻,Lanifibranor 1200mg的腹泻发生率为12%。
GLP-1类药物抑制食欲,而FGF21类药物则可能增加食欲。在MASH疾病控制过程中,饮食因素起着一定作用,因此FGF21类药物在这一方面可能存在劣势。此外,FGF21类药物在注射部位容易引发不良反应,例如注射部位红斑、瘀伤和皮疹,发生率在10%-20%之间。
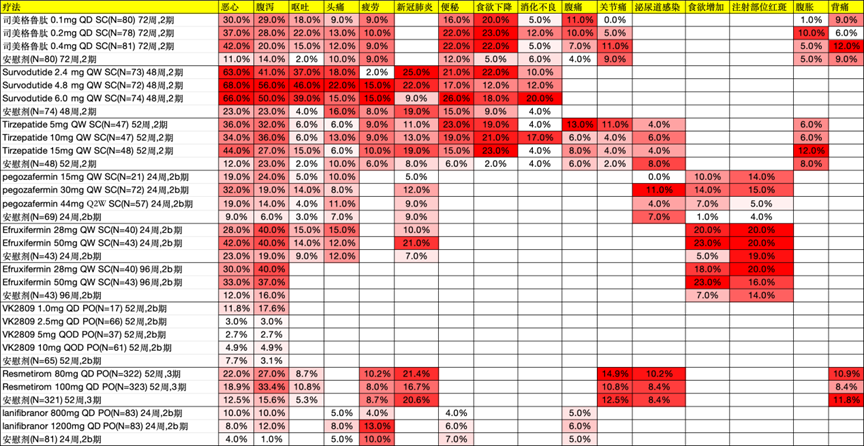
PPAR类药物在临床中报道了一些不良反应,包括转氨酶升高、体重增加和水肿,发生率在10%及以下。
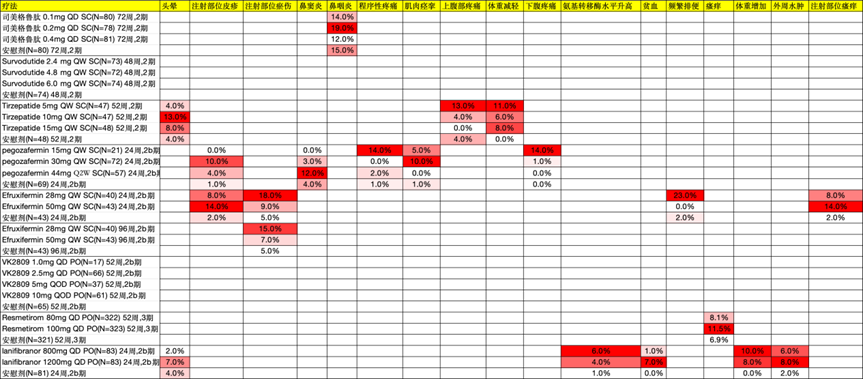
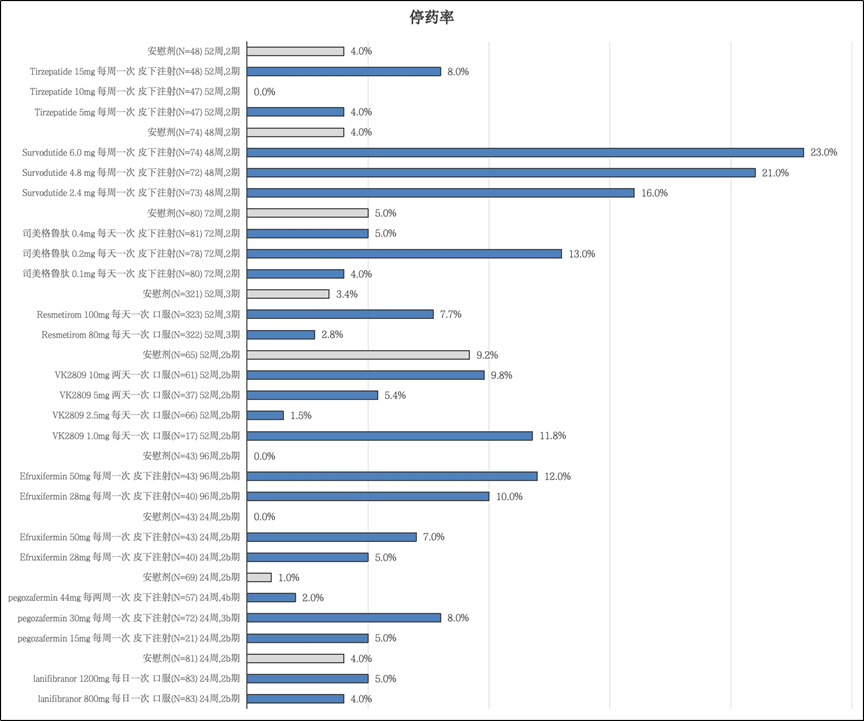
在GLP-1类药物中,司美格鲁肽(Semaglutide)和 Survodutide 的停药率相对较高。具体来说,Survodutide 6mg在48周时的停药率达到了23%。与之相比,Tirzepatide的停药率控制得较好,15mg的剂量组停药率仅为Survodutide 的三分之一。在THR-β类药物中,停药率普遍较低。对于FGF21类药物,Efruxifermin 和 Pegozafermin 在24周时的停药率都接近10%。而PPAR类药物的停药率则相对较低。
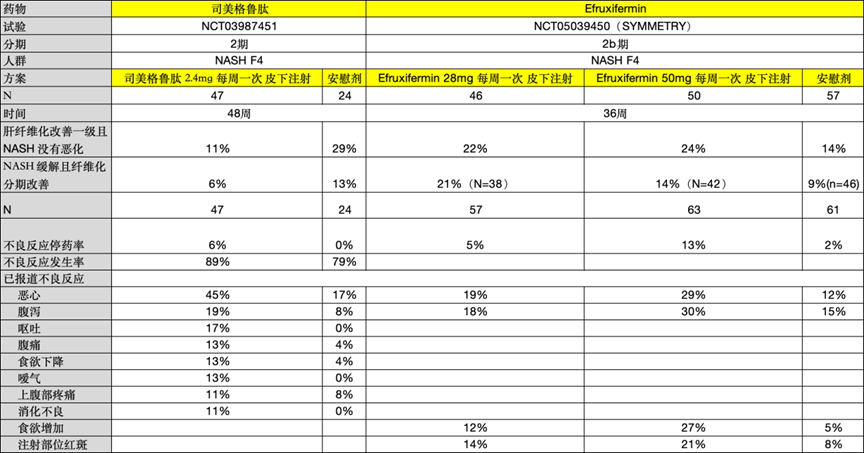
3. MASH F4临床数据
目前,司美格鲁肽 和 Efruxifermin 已报道MASH F4 2期试验结果。对于F4患者,司美格鲁肽的疗效较差,从两个临床指标来看,效果未见明显改善,甚至低于安慰剂组。相比之下,Efruxifermin在F4患者中仍表现出一定疗效。在肝纤维化改善一级且MASH未恶化的指标中,50mg组的比例为24%,经安慰剂校正后仍为10%。在安全性方面,Efruxifermin的停药率约为10%,各类不良反应的发生率与F2/3患者群体相似。
八、未来竞争格局
Resmetirom 已于2024年通过加速批准上市,如果F4试验结果为阳性,预计最早在2027年获得FDA完全批准。司美格鲁肽目前已获得72周的数据,预计将在明年提交上市申请,最早可能于2025年获得加速批准,完全批准预计要到2029年。而根据目前的开发进度,Survodutide、Pegozafermin、Efruxifermin和 Lanifibranor 预计最快可于2027年获得加速批准,完全批准可能需要等到2029年以后。Tirzepatide 和 VK2809 暂时未公布开展MASH 3期临床试验的具体计划。到2027年,预计将有6款药物在MASH领域展开激烈竞争。
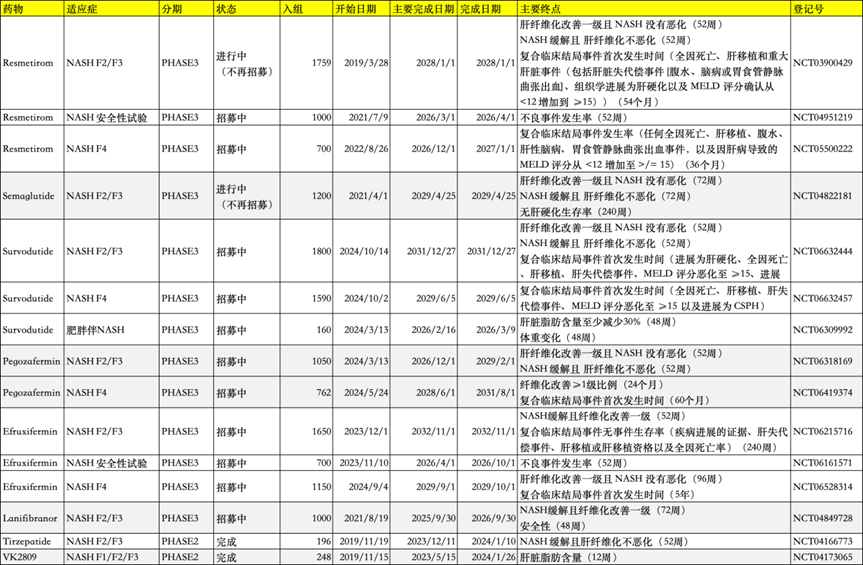
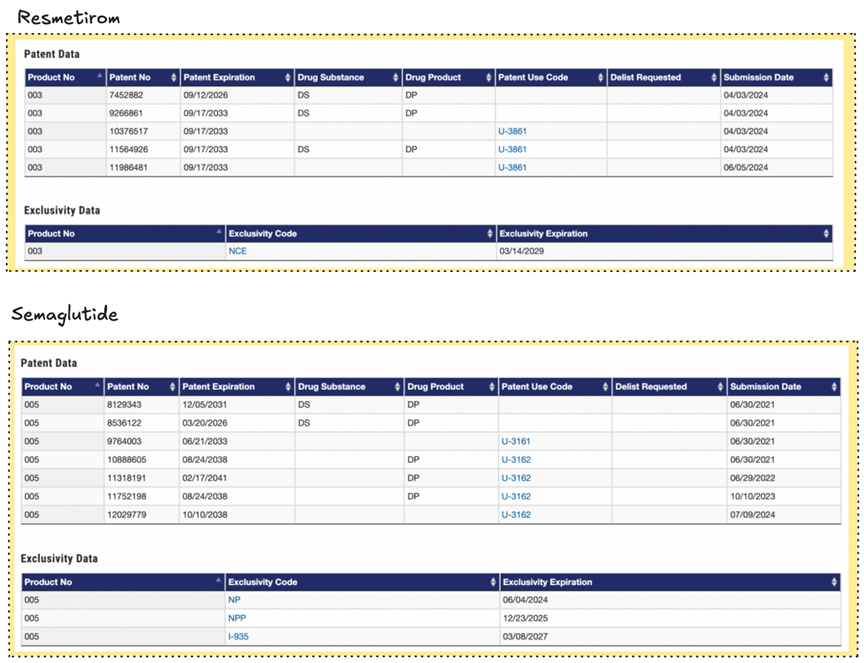
Resmetirom的化合物专利2026年到期,NCE市场独占权在2029年。司美格鲁肽化合物专利2026年到期,NP市场独占权2024年已到期。因此除了新药的竞争外,还需要考虑仿制药竞争。
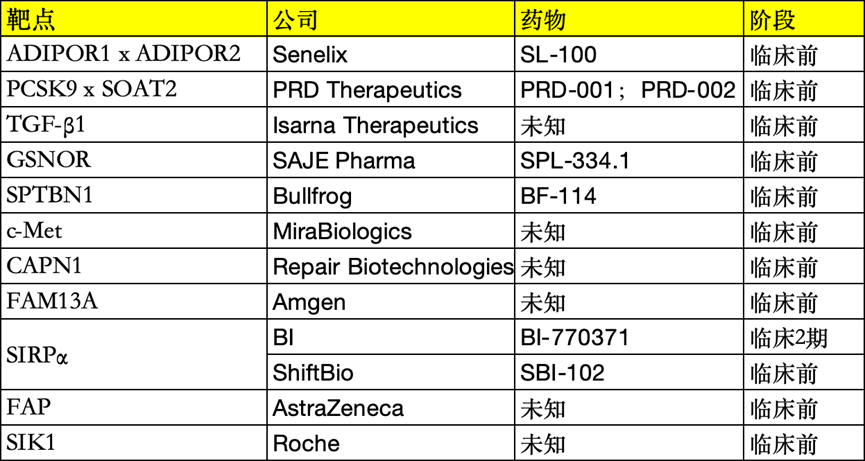
九、新靶点的探索
今年新披露的MASH治疗靶点中,进展最快的是BI的SIRPα拮抗剂 BI-770371,预计将在2024年11月开始针对因MASH导致代偿性肝硬化患者开展静脉注射治疗的安全性、耐受性和药效学的2a期临床试验。其可能的作用机制是,SIRPα拮抗剂通过抑制肝细胞中的CD47,增强肝巨噬细胞对坏死性凋亡肝细胞的摄取,从而降低肝星状细胞的活化,抑制肝纤维化的进展。
十、未来用药逻辑
MAFLD和MASH的常见合并症包括肥胖(51%~80%)、糖尿病(23%~44%)、高脂血症(70%~72%)等,因此GLP-1类药物可以作为基础治疗方案。在轻度阶段,可以通过改善生活方式并联合使用GLP-1类药物进行治疗;当仅出现NAS评分增加时,可通过GLP-1类药物改善脂质代谢和炎症反应;若伴随纤维化进展,可结合GLP-1类药物和FGF21类药物来改善纤维化。在中度至重度阶段,可将GLP-1类药物与FGF21、THR-β及PPAR类药物联合使用,以实现更全面的治疗效果。

结语
MASH(代谢相关脂肪性肝病)作为全球普遍存在的疾病,影响着约1.5%的人群,疾病负担超过万亿美元,市场潜力巨大。经过数十年的研发,虽然许多药物未能成功,但首个MASH治疗药物Resmetirom的获批标志着这一领域从“无药可治”迈向“有药可治”。随着研发的不断推进,针对降脂、抗炎和抗纤维化的药物,如GLP-1多靶点药物和FGF21药物,已显示出显著疗效。预计在未来3-5年内,将有6款新药竞相上市,这些药物不仅要面对彼此的竞争,还将面临Resmetirom和司美格鲁肽仿制药的激烈竞争。因此,差异化竞争仍需通过新靶点的探索加以推动,尽管新靶点的开发仍在路上,药企依然充满信心。随着药物选择的逐步丰富,未来的治疗方式大概率将以联合治疗为主,覆盖MASH的全阶段患者群体,为患者带来更多的治疗希望。
参考资料:
1. Novo Nordisk、Madrigalpharma、Akero网站
2. https://my.clevelandclinic.org/health/diseases/22988-nonalcoholic-steatohepatitis
3. The global epidemiology of nonalcoholic fatty liver disease (NAFLD) and nonalcoholic steatohepatitis (NASH): a systematic review. Hepatology 77(4):p 1335-1347, April 2023. Current status and future trends of the global burden of MASLD. Trends in Endocrinology & Metabolism, Volume 35, Issue 8, 697 - 707
4. 非酒精性脂肪性肝病诊断——病理的重要性. 临床肝胆病杂志, 2023, 39(3): 491-497.
5. 非酒精性脂肪性肝病诊断方法研究进展. 生命科学, 2023
6. Expert Panel Review to Compare FDA and EMA Guidance on Drug Development and Endpoints in Nonalcoholic Steatohepatitis. Gastroenterology, 162(3), 680–688.
7. MASH-Webinar-January-2021
8. FDA、NMPA、EMA指导原则
9. Semaglutide 2·4 mg once weekly in patients with non-alcoholic steatohepatitis-related cirrhosis: a randomised, placebo-controlled phase 2 trial. The Lancet Gastroenterology & Hepatology, Volume 8, Issue 6, 511 - 522
10. A Placebo-Controlled Trial of Subcutaneous Semaglutide in Nonalcoholic Steatohepatitis. N Engl J Med 2021;384:1113-1124
11. Randomized, Controlled Trial of the FGF21 Analogue Pegozafermin in NASH. N Engl J Med 2023;389:998-1008
12. A Phase 2 Randomized Trial of Survodutide in MASH and Fibrosis. N Engl J Med 2024;391:311-319
13. A Randomized, Controlled Trial of the Pan-PPAR Agonist Lanifibranor in NASH. N Engl J Med 2021;385:1547-1558
14. Tirzepatide for Metabolic Dysfunction–Associated Steatohepatitis with Liver Fibrosis. N Engl J Med 2024;391:299-310
想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!











































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论