
· 在这项开创性的研究中,替尔泊肽也改善了心力衰竭症状和身体功能受限
· 经替尔泊肽治疗的患者的运动能力得到改善,体重减轻更多,并且全身性炎症减轻
· 礼来已开始向全球监管机构递交替尔泊肽治疗射血分数保留的心力衰竭(HFpEF)合并肥胖患者的适应症申请
2024年11月16日,礼来宣布SUMMIT 3期临床研究的详细结果,研究结果显示替尔泊肽显著降低了射血分数保留的心力衰竭(HFpEF)合并肥胖成人患者的心力衰竭事件恶化风险。接受替尔泊肽治疗的患者在心力衰竭症状和身体功能受限方面也得到了显著改善。该研究结果已刊登于《新英格兰医学杂志》,同时在2024年美国心脏协会(AHA)科学会议上进行了发布。
声明:
1. 本文中所述药物的相关适应症尚未在中国大陆获批
2. 本文中所述相关临床研究结果尚未在国内注册审批
3. 礼来不推荐任何未获批的药品/适应症的使用
SUMMIT研究达成了两个主要终点。与安慰剂相比,替尔泊肽降低心力衰竭事件风险(通过复合终点进行评估)达38%,降低心力衰竭住院风险达56%。此外,替尔泊肽治疗组患者的堪萨斯城心肌病问卷-临床总结评分(KCCQ-CSS,用于评估与心力衰竭相关的症状和身体功能受限)1 改善了近25分,而安慰剂组的改善为15分。2
达拉斯贝勒大学医学中心心血管科学杰出学者、伦敦帝国理工学院客座教授Milton Packer医学博士(指导委员会主席)表示:
许多研究表明,肥胖通过促进全身性和心肌炎症,成为导致HFpEF进展和加重的主要原因。SUMMIT研究为医护人员在改善HFpEF合并肥胖患者的临床进程和生活质量方面如何产生有意义的影响提供了重要参考。
同时,SUMMIT研究达成了所有关键次要终点,替尔泊肽组的患者表现出运动能力的提高,在6分钟内比安慰剂组多行走约30米(38.2米vs7.9米)2。此外,替尔泊肽组患者的体重平均减轻了15.7%,而安慰剂组为2.2%。2替尔泊肽组的超敏C反应蛋白(hsCRP)(反应全身性炎症的关键指标)显著降低,降幅达43.4%,而安慰剂组降幅为3.5%。
完整研究结果

*患者可能被计入下列多个类别之一。
**在替尔泊肽组的10人中,有7人已经停药超过30天。
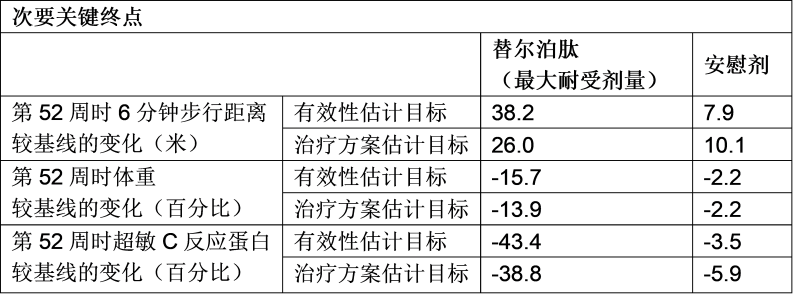
礼来产品研发高级副总裁Jeff Emmick博士表示:
心力衰竭和肥胖等心脏代谢疾病是密切相关且经常共存的。我们需要新的治疗方法来应对这些疾病之间的相互关联性。在礼来,我们希望通过更好地理解这些疾病的根本原因以及它们是如何相互影响的,从而能够更有效地治疗它们。目前,在美国尚无专门针对肥胖相关 HFpEF的治疗方案。SUMMIT研究数据表明,如果获批,替尔泊肽将可能为这些患者的治疗提供重要的突破,并建立新的治疗标准。
在SUMMIT研究中,替尔泊肽的总体安全性与此前报告的替尔泊肽研究一致。最常见的不良事件为轻度至中度胃肠道相关不良事件。与安慰剂相比,替尔泊肽治疗组的患者最常见不良事件分别为腹泻(18.4% vs 6.3%)、恶心(17.0% vs 6.5%)和便秘(14.8% vs 6.0%)。因不良事件停止治疗的参与者中,23人来自替尔泊肽组, 5人来自安慰剂组。
SUMMIT研究的其他数据将在AHA会议期间发表,并刊登在同行评议的期刊上。礼来已向美国食品药品监督管理局(FDA)和欧洲药品管理局(EMA)递交了替尔泊肽用于治疗HFpEF合并肥胖的申请,并计划于今年晚些时候向其他监管机构递交申请。
关于SUMMIT研究
SUMMIT研究(NCT04847557)是一项多中心、随机、双盲、平行、安慰剂对照的3期研究,比较替尔泊肽与安慰剂在HFpEF合并肥胖的成人参与者(伴有或不伴有T2DM)中的有效性和安全性。该研究以1:1的比例随机分配来自美国、阿根廷、巴西、中国大陆、印度、以色列、墨西哥、波多黎各、俄罗斯和中国台湾地区的731名参与者,接受替尔泊肽MTD 5mg、10mg或15mg或安慰剂治疗。该研究的两个主要终点为降低首次发生心力衰竭相关事件的风险,以及第52周时堪萨斯城心肌病问卷-临床总结评分(KCCQ-CSS)较基线的变化,以评估对心力衰竭症状和身体活动受限的改善作用。这是一项针对HFpEF合并肥胖患者的开创性研究,将心力衰竭事件风险的降低和和功能改善作为主要终点。此项长期研究的中位随访时间为104周,部分患者的药物暴露时间长达3年。
SUMMIT研究中,替尔泊肽MTD分别为5mg、10mg或15mg。起始剂量为2.5mg,每4周增加2.5mg,直至达到MTD。耐受15mg的参与者将接受15mg作为MTD。耐受10mg但不耐受15mg的参与者将接受10mg作为MTD,耐受5mg但不耐受10mg的参与者将接受5mg作为MTD。
关于替尔泊肽
替尔泊肽是每周一次注射的葡萄糖依赖性促胰岛素多肽(GIP)/胰高糖素样肽-1(GLP-1)受体激动剂。替尔泊肽是一种单分子,可激活人体天然肠促胰素受体GIP受体和GLP-1受体。GIP受体和GLP-1受体均表达于大脑中调节食欲的重要区域。替尔泊肽已被证实可以减少能量摄入,该作用可能是通过调节食欲来实现的。替尔泊肽针对慢性肾脏病(CKD)和肥胖患者发病率和死亡率(MMO)的研究正在进行中。今年,礼来已向美国食品药品监督管理局(FDA)和其他全球监管机构递交替尔泊肽治疗肥胖伴中重度阻塞性睡眠呼吸暂停(OSA)的研究数据。
替尔泊肽于2022年5月13日获得FDA批准,用于改善成人2型糖尿病患者的血糖控制;2023年11月8日,FDA批准替尔泊肽适用于肥胖(BMI≥30kg/m2)或伴有至少一种体重相关合并症的超重成人(BMI≥27kg/m2)的长期体重管理。
替尔泊肽是唯一获批用于长期体重管理的GIP/GLP-1受体激动剂。替尔泊肽获批的两种适应症,均在饮食控制和运动的基础上进行。
Lilly
关于礼来制药
礼来制药是一家致力于通过科学创新改善人类健康水平,惠及全球患者的医药公司。作为医疗健康行业的领军者,礼来制药拥有近150年的历史。今天,我们的药物已帮助全球数千万人。运用生物技术、化学和基因医学的力量,我们的科学家正在积极推动新的医学进展,以应对严峻的全球健康挑战。重新定义糖尿病与肥胖疗法,减少肥胖对人体的长期影响;助力阿尔茨海默病的防治行动;为一系列威胁人类健康的免疫性疾病提供解决方案;以及将难以治愈的癌症转变为可控的疾病。礼来制药迈向健康世界的每一步,都源自于我们“致力于让数百万患者生活得更美好”的信念。这包括致力于解决全球多重挑战的创新临床试验,同时确保药物的可及性和可负担性。如果需要了解更多关于礼来制药的信息,请登录:www.lilly.com.cn。
参考文献

PP-MG-CN-3759




































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论