
衣壳设计是为不同临床应用开发定制rAAV的主要策略。它主要包括三种方法:鉴定自然存在的AAV变体、理性设计和定向进化(图1)。最近,AI辅助进化已成为rAAV衣壳设计的新工具。
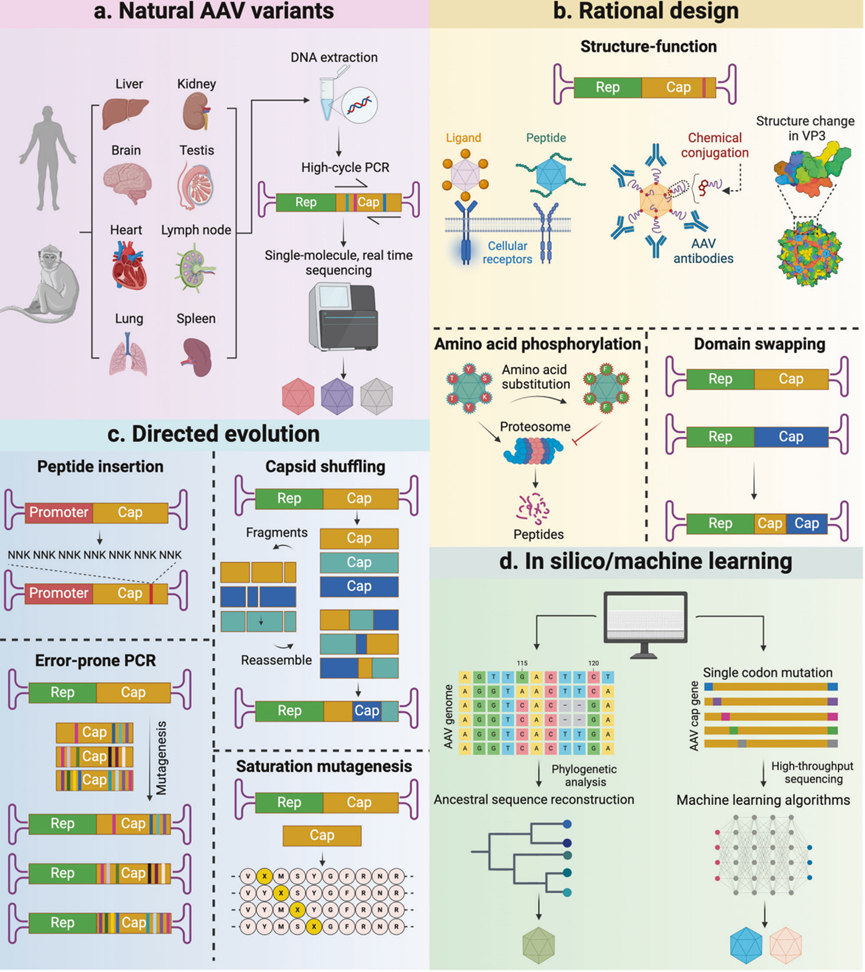
图1 开发新型AAV变体的策略。a 可以从人类和小鼠等非人灵长类动物(NHP)组织中通过多轮PCR和高通量测序分离出自然存在的AAV变体。b 利用AAV生物学的知识进行合理设计,修改AAV衣壳中的相关氨基酸,以增强转导能力或逃避免疫监视。c 定向进化是一种工程方法,用于开发具有特定组织/细胞特异性的新型AAV变体,包括随机或特定的肽段插入、衣壳重组、易错PCR和饱和突变。d 通过计算机模拟方法利用已知的衣壳序列重建AAV衣壳氨基酸序列。通过对大量AAV变体转导样本数据集的学习,预测AAV基因组中特定序列与包装能力和组织靶向性之间的关系。
01
鉴定自然存在的AAV变体
在早期阶段,人体组织是发现新AAV的关键来源。从1965年到2004年,有限数量的AAV主要从人类临床样本中分离出来,随后被转化为载体并进行了测试。AAV9最初是从人类肝脏组织中发现的,但由于其能够穿越血脑屏障(BBB),且对大脑有强烈的嗜性,因此成为中枢神经系统(CNS)转导的常用载体。AAV7和AAV8是从恒河猴的心脏和淋巴结中分离出来的,对骨骼肌和肝脏有出色的嗜性。
研究表明,40-80%的人对已知的野生型AAV血清型有抗体,这强调了发现更多血清型AAV的必要性。研究人员已经在人类和非人灵长类动物之外的物种中筛选AAV血清型,以找到新的衣壳,避免人类AAV预存抗体的中和效应,但这些AAV在人类中的转导可能有限。因此,发现人类来源的AAV变体,并筛选转导效率高,具有特定组织嗜性的候选者已经成为一种常见的方法。AAVv66,一种通过长读长测序从人类样本中分离出来的AAV2变体,具有比AAV2更高的产量和CNS转导效率。这些发现表明,鉴定自然存在的AAV变体可以为改善组织特异性转导提供有价值的工具。虽然只有少数团队还在鉴定和评估自然衣壳变体作为基因治疗的潜在载体,但源自野生型AAV血清型的rAAV仍然是当前临床研究中的主要选择。
02
理性设计
理性设计方法涉及对rAAV衣壳的特定位点进行结构修改,需要对rAAV的结构和生物学有一定的理解,常用的三种关键方法包括:遗传突变、插入功能结构域以改善组织亲和力,以及化学修饰。有研究探索了特定氨基酸残基对rAAV转导效率的贡献,发现rAAV2衣壳表面的酪氨酸残基的磷酸化会导致它们在入核前被降解,而将这些残基修改为苯丙氨酸(Y444F/Y500F/Y730F)可以增加rAAV2在中枢神经系统中的基因递送效率。虽然rAAV2不能通过玻璃体内注射转导光感受器,但含有特定残基替换(Y272F/Y444F/Y500F/Y730F/T491V)的变体实现了高达25%的光感受器细胞感染。此外,改变表面暴露的残基可能实现组织去靶向,从而提高安全性。例如,在黑猩猩组织样本中发现了H527Y和R533S的替换,如果将这种替换引入至rAAV9衣壳,在新生小鼠和一种致命性儿科白质营养不良症小鼠模型中,当AAV的导入方式为静脉注射时,rAAV9在外周组织的感染更少。
另一种理性设计方法是将功能结构域引入rAAV衣壳的特定位点。一项研究通过插入人类黄体生成素受体(LH-R)的15个氨基酸结合域,成功地在卵巢癌细胞中实现了与HSPG无关的通过LH-R的转导。另一项研究通过在rAAV9衣壳中插入细胞穿透肽,成功鉴定出两种变体,它们能够在系统给药后穿越血脑屏障(BBB),并改善了中枢神经系统的感染。宿主免疫反应是rAAV能够诱导有效和长期转基因表达的主要障碍。结构研究表明,rAAV衣壳上的中和抗体(NAbs)识别位点可能是保守的。根据冷冻电子显微镜(cryo-EM)图像显示的rAAV1衣壳与三种小鼠单克隆抗体复合物的结构信息,工程化的rAAV变体能够逃避小鼠、非人灵长类动物和人类血清中的NAbs。将rAAV衣壳与生物素-聚乙二醇(PEG)和N-乙酰半乳糖胺(GalNAc)结合可能有助于逃避NAbs,尽管这可能会改变rAAV的组织嗜性,降低感染效率。一项研究使用域交换技术从rAAV2和rAAV8生成了27个嵌合体衣壳,并证明了rAAV8的肝脏嗜性与第四环域相关。此外,在AAVrh10的可变区域VIII中插入精氨酸-甘氨酸-天冬氨酸(RGD)整合素结合基序,可提高心脏特异性感染效率并减少肝脏分布。
不改变rAAV衣壳氨基酸组成的化学修饰是衣壳工程的一个有前景的方法。对表面氨基酸的微小修改可以改变受体结合亲和力,从而影响感染和嗜性。一项研究使用带有亲电性琥珀酰亚胺丙酸功能团的聚乙二醇-N-羟基琥珀酰亚胺(PEG-NHS)与rAAV2衣壳上的赖氨酸残基交联,以逃避中和抗体(NAbs)。研究发现糖化的rAAV2与肝素和单克隆抗体A20的结合减少,导致其在肌肉中的转基因表达显著提高。一项研究将抗骨骼肌特异性蛋白CACNG1的抗体共价结合到rAAV9衣壳的可变区域,导致工程化的衣壳能够在小鼠肌管中特异性表达转基因,与未结合抗体的rAAV9相比,肝脏靶向性降低。同样,另一项研究工程化了一个rAAV9和rAAVrh74的混合衣壳,可以特异性结合在骨骼肌表达丰度较高的受体整合素αVβ(AVB6)。一个由此产生的变体,LICA1,在人类肌管和小鼠杜氏肌营养不良症(DMD)模型的骨骼肌中显示出更强的感染性。此外,还可以通过遗传密码扩展技术来实现对rAAV衣壳的化学修饰。遗传密码扩展技术允许研究者在蛋白质中特定位置引入非天然氨基酸(ncAAs),从而赋予蛋白质新的或改变其原有的功能。最近的一项研究使用了这种方法,通过工程化的正交原核tRNA/tRNA合成酶(正交意味着这些tRNA和tRNA合成酶对不会与宿主细胞中已有的tRNA和tRNA合成酶发生相互作用,从而避免了非目标氨基酸的掺入)插入单个ncAAs来工程化一类新的rAAV,称为Nε-AAVs。这些突变的Nε-AAVs成功地与功能分子结合。体内研究表明,在异种移植动物模型的目标细胞中,与Nε-AAVs结合的功能分子导致了高度特异性的摄取。另一项研究还表明,在AAV5衣壳的D374位置整合一个ncAA可以增强其在小鼠肺部的特异性感染。尽管取得了这些进展,但理性设计方法仍受到我们对rAAV结构和生物学不完全理解的限制。
03
定向进化
定向进化通过模仿自然进化的过程,人为设计的实验条件分离具有优势属性的衣壳变体,如更高的rAAV产量和感染效率、免疫逃逸或特定的细胞/组织嗜性。一种定向进化策略涉及诱导随机、无偏倚的突变,并对衣壳施加病毒适应性的选择压力。有研究通过使用易错PCR然后通过交错延伸以生成VP1-3的Cap突变体库,筛选对肝素亲和力发生改变且能实现免疫逃逸的变体。此外,基于DNA重组的方法,通过组合来自不同亲本AAV血清型的衣壳氨基酸序列,也被用来生成多样且广泛的随机嵌合体库。用这种技术构建的大量AAV变体在体外和体内都显示出广泛的细胞嗜性。饱和突变不同抗原印记也被用来工程化AAV8衍生的衣壳以逃避Nabs,改善肝脏嗜性。
在AAV衣壳上表面筛选随机肽段是定向进化的另一种方法。例如,基于Cre重组的AAV靶向进化(CREATE)系统(图2)将短肽段插入到rAAV9衣壳上以改变其属性,已有研究用该方法成功获得了AAV-PHP.B。AAV-PHP.B在C57BL/6小鼠模型中表现出了优异的穿透血脑屏障(BBB)的能力,因此被广泛用于小鼠的中枢神经系统(CNS)研究。然而,后续的研究表明,AAV PHP.B的这种特性并没有在其它品系的小鼠和非人灵长类动物(NHPs)中得到相同的效果,这表明AAV PHP.B衣壳与宿主因素之间存在复杂的相互作用,而这些因素在不同物种之间可能存在差异。

图2 基于Cre从感染的靶细胞中恢复AAV衣壳序列。a CREATE选择过程示意图。用PCR引入多样性(多色光谱垂直带)到一个衣壳基因片段(黄色),该片段被克隆到携带剩余衣壳基因(灰色)的rAAV基因组中,并用于生成病毒变体库,之后该库被注入Cre转基因动物体内,最后用PCR从Cre+细胞中选择性恢复衣壳序列。b rAAV-Cap-in-cis-lox rAAV基因组。Cre颠倒了被lox71和lox66位点包围的聚腺苷酸(pA)序列。PCR引物(半箭头)被用来选择性扩增Cre重组序列。c 从两个Cre+或Cre-小鼠中恢复的衣壳库序列的Cre重组依赖性(顶部)和独立性(底部)扩增的PCR产物。d 示意图显示了Rep-AAP AAV辅助质粒内的AAV基因以及由cap基因编码的蛋白质。在cap基因中插入的终止密码子消除了VP1、VP2和VP3衣壳蛋白的表达。e 与用标准的AAV2/9 Rep-Cap辅助质粒+ rAAV-UBC-mCherry(中间)或AAV2/9 Rep-AAP + rAAV·UBC-mCherry质粒(底部)生产的病毒相比,使用分离的AAV2/9 Rep-AAP + rAAV-Cap-in-cis-lox质粒也能生成有DNase抗性的AAV载体基因组(vg)(顶部)(AAV基因组的DNase抗性是AAV在生产、纯化、储存和给药过程中过程中具有较高的稳定性的指标)。f 将7-mer衣壳库克隆到rAAV-∆Cap-in-cis载体中。g AAV9表面模型显示了7-mer插入在氨基酸(aa)588和589(洋红色)之间的位置。黄色表示用PCR生成的库片段编码的位点(aa 450-592)。
随后,Voyager Therapeutics公司开发了一种名为TRACER(Tropism Redirection of AAV by Cell-type-specific Expression of RNA,通过细胞类型特异性表达RNA重新定向AAV的嗜性)的新型rAAV进化平台(图3)。这个平台的核心是基于RNA进行筛选,能快速发现穿透血脑屏障(BBB)并增强CNS嗜性的AAV衣壳。这一过程不需要转基因动物,因此可以用于多种物种,包括非人灵长类动物(NHPs)。一项在小鼠中的研究基于在rAAV9衣壳上展示的肽库,鉴定了十个优势变体,这些变体在系统给药后,大脑的转导效率比亲本rAAV9高了多达400倍。最近一个研究报道,VCAP-102,一种基于TRACER开发的rAAV9变体,在非人灵长类动物的不同大脑区域显示出比rAAV9高20-90倍的感染效率。对VCAP-102的迭代进化产生了新的衣壳变体,其BBB穿透性进一步提高了6-7倍。同样,基于TRACER开发的VCAP-100衍生物在非人灵长类动物中显示出比其亲本AAV5高六倍的大脑感染效率,而在的肝脏感染效率则降低了300倍,预示着更低的肝毒性。
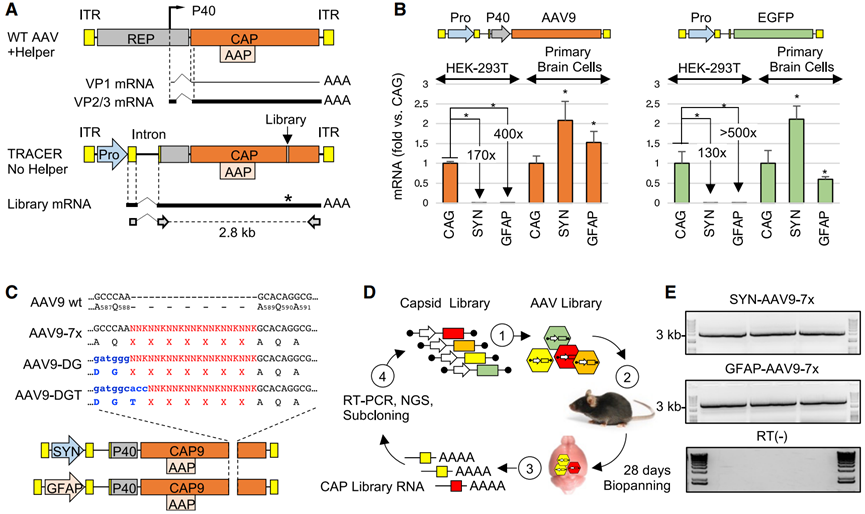
图3 TRACER策略。(A)野生型AAV(顶部)和TRACER文库载体(底部)结构示意图。ITR,反向末端重复序列。Pro,启动子。虚线表示AAV内含子(顶部)或合成的CMV globin内含子(底部),实线代表次要(细线)和主要(粗线)衣壳转录本。底部显示了用于恢复2.8-kb衣壳文库扩增子的引物。(B)在TRACER平台中将CAG、SYN和GFAP启动子串联(左边)或单一启动子(右边)的活性。转基因被包装在AAV9衣壳中,并在HEK293T细胞或小鼠原脑细胞中进行测试(1E+5 vg/细胞,n = 3)。感染后48小时通过实时RT-PCR定量RNA。(C)肽展示文库的构建。在包含SYN或GFAP启动子的载体中,将由AQ、DG或DGT残基引导的随机序列引入至AAV9 VP1的特定位置。(D)体内选择过程示意图。(1)DNA文库用于生产病毒库,(2)将病毒文库通过静脉注射(i.v.)感染小鼠(1E+12 vg/只),(3)注射后28天从整个大脑中恢复大量RNA,(4)通过RT-PCR扩增编码肽库的衣壳片段,通过下一代测序(NGS)进行分析,然后克隆到TRACER载体中进行另一轮选择。(E)在注射SYN和GFAP启动子文库后28天,从三只小鼠中获得的RT-PCR产物示例(顶部和中间,分别)。底部:RT阴性对照。
DELIVER(Directed evolution of AAV capsids leveraging in vivo expression of transgene RNA, 定向进化AAV衣壳,利用体内表达的转基因RNA)策略是另一种开创性的方法(图4),该方法通过在体内筛选AAV衣壳变体,以实现对特定组织的高效递送。已经有研究者采用这种策略鉴定出一类含有RGD基序的衣壳,这些衣壳在小鼠和非人灵长类动物中通过静脉注射后,能够以更高的效率和选择性感染肌肉组织。进一步分析表明,目标细胞中表达的与RGD结合的整合素异二聚体与含有RGD基序的病毒变体有很强的相互作用。研究人员最近生成了一个嵌入RGD的7个氨基酸肽库,插入衣壳的可变区域VIII,并鉴定出一些新的AAV衣壳变体,其骨骼肌转导效率比基准衣壳增强了20多倍。
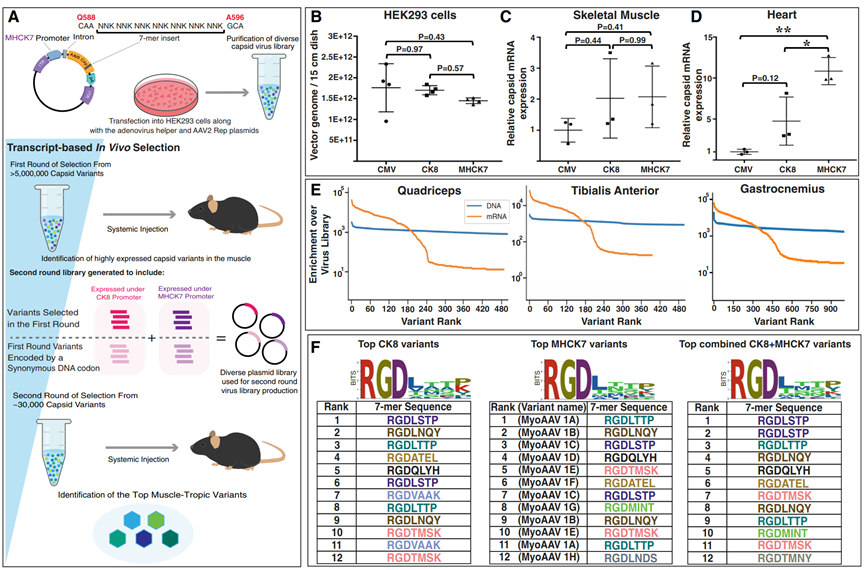
图4 DELIVER鉴定出一类含有RGD基序的肌肉趋向性AAV衣壳变体。(A)使用DELIVER生产病毒文库和选择衣壳变体的示意图。(B)使用含有ITR的质粒产生的rAAV滴度比较,这些质粒在CMV、CK8或MHCK7启动子的控制下表达AAV9衣壳编码序列。(C和D)在8周龄C57BL/6J小鼠的骨骼肌(C)和心脏(D)中,由CMV、CK8或MHCK7启动子控制表达的AAV9衣壳库mRNA的体内表达。病毒库感染方式为系统性注射,剂量为1E+12 vg/只小鼠。(E)图表显示在不同小鼠骨骼肌中,由MHCK7启动子表达的衣壳变体在DNA和mRNA水平上相对于病毒文库的富集情况。(F)在8周龄C57BL/6J小鼠肌肉中注射1E+12 vg病毒库后,经过第二轮基于转录本的选择,高度表达的衣壳变体中7个氨基酸的插入序列。每组中颜色相同的变体由同义密码子编码。变体的排序是基于每个变体在股四头肌、胫骨前肌、腓肠肌、肱三头肌、腹肌、膈肌和心脏中的mRNA表达量之和。
定向进化是一个强大的工具,用于生成和识别具有特定属性的变体,虽然这些属性并不总是能够在灵长类动物中跨物种转化,如AAV-PHP.B在小鼠中显示出比AAV9更强的CNS感染,但在狨猴中则没有,这表明在衣壳工程中进行跨物种进化的必要性。然而,一项在多个物种中的顺序进化rAAV衣壳库的研究确定了rAAV.cc47作为一种强大的跨物种变体,与rAAV9相比,在非人灵长类动物的大脑和心脏中具有增强的感染能力。AAV2.7m8是一种AAV2变体,通过10个氨基酸的插入,在小鼠中通过玻璃体内注射能够强烈转导外层视网膜层,如光感受器和视网膜色素上皮(RPE)细胞。使用ADVM-022(AAV.7m8-aflibercept)治疗糖尿病性黄斑水肿(DME)的II期临床试验(NCT04418427),接受高剂量【6.0 × 10^11病毒基因组(vgs)/眼】后16-36周内多名患者出现严重不良反应,包括难以治疗的眼内压降低,因此该临床试验暂停,这显示了工程化衣壳在该领域的转化挑战。
04
AI辅助设计
计算机辅助的rAAV工程是一种前沿的方法,它利用计算工具来辅助rAAV的设计和优化。各种研究已经从rAAV的进化谱系中探索了其多样的属性,并使用预测的祖先基因组重建来创造新的衣壳变体。有两项类似的研究通过合理设计或采用定向进化来计算建立祖先衣壳库。这两项研究都生成了具有更好的热稳定性的衣壳变体,热稳定性是血清型特征的一个指标,是显示临床应用潜力的生物学属性。在这些变体中,Anc80L65是一个有前途的载体,可用于内耳或眼睛相关疾病的基因治疗。
机器学习在生物医学研究中得到了广泛使用,包括医学图像分析、遗传学和药物发现。一项开创性的研究应用机器学习来理解rAAV2衣壳,从衣壳的适应度视角描述了单密码子替换,并使用机器学习来设计精确的多突变变体,这些变体基于它们对目标组织的影响。此外,深度学习已被用来多样化rAAV2衣壳变体,准确预测它们的活力。这种方法揭示了在衣壳之外工程化rAAV基因组的新可能性,这在未来的rAAV发展中具有创新应用潜力。
rAAV基因组设计
rAAV基因组由ITRs和转基因表达盒组成,后者包括感兴趣的基因和调控元件。rAAV基因组的设计策略包括修改ITRs或内含子,插入组织特异性启动子进行转录调控和/或使用可诱导表达系统,密码子优化,减少转基因cDNA的CpG基序,以及通过微小RNA(miRNA)介导的转录后调控重靶向等。这些元件各有其功能,它们各自和共同作用决定了转基因表达、细胞类型特异性、rAAV转导的安全性和持久性。
01
rAAV ITRs的设计
传统的rAAV携带单链载体基因组。其转导效率和速率取决于mRNA转录发生前载体DNA的第二链合成,这是限速步骤。为了提高转导效率,可采用突变其中一个ITR,生成具有双链载体基因组的自互补AAV(scAAV)的策略。scAAV可绕过dsDNA合成的限速步骤,更快、更高效地转导目标细胞。然而,使用scAAV有明显的局限性:较小的包装能力(scAAV为2.5 kb,而ssAAV为4.7 kb)以及由于转基因产物快速积累而导致的免疫反应风险的增加。
ITRs可以被改变,通过选择性地从两个相邻的ITRs中移除D序列,可以选择性地限制包装载体基因组的正链或负链。ITRs还包含CpG基序,可被toll 样受体(TLR)-9识别并诱发炎症反应。完全从ITRs中移除CpG并不会对治疗动物中载体基因组的拷贝数或转基因表达产生不利影响,然而,这会导致rAAV滴度的降低,并且尚不清楚是否能减少对rAAV的炎症反应。总的来说,ITRs可能是异质的,原因是ITRs天然容易发生突变,具有回文结构、高GC含量和二级结构。优化ITRs中的GC含量可能是一种潜在的改善rAAV属性的设计策略。
02
优化启动子
选择和优化转基因表达盒中的启动子可以满足特定的需求,如组织特异性和表达水平。常用的巨细胞病毒(CMV)或鸡β-肌动蛋白(CBA)启动子可提供强大且广泛的基因表达,而组织特异性启动子如CK8或MHCK7则在肌肉中提供组织特异性的基因表达。组织特异性转基因表达对于实现低剂量下足够的转导效率和最小化脱靶效应至关重要。一项研究采用了携带内源性人类存活运动神经元1(SMN1)启动子的scAA9载体,以在神经元中特异性驱动SMN1的表达。这种方法显示了更好的安全性,显著降低了肝脏毒性,并在患有脊髓性肌肉萎缩症(SMA)的SMNdelta7小鼠中增强了治疗效果。这一结果超越了使用CMV/CBA启动子被FDA批准的治疗方法Zolgensma的性能,从而强调了组织特异性启动子的优势。其它的调控元件,如添加上游增强子可以提高表达活性和特异性。许多增强子已被设计用于临床基因治疗载体中,目的是增加转基因表达,减少病毒剂量。另一项研究报告称,小鼠甲基-CpG结合蛋白-2启动子的一个片段在神经元中特异性地实现了强大的长期表达。
基于机器学习的多组学数据可以用于设计组织特异性启动子,使转基因活性在靶组织和非靶组织之间实现超过1000倍的动态增加。
03
转基因表达调控
转录调控:可以上调或下调感兴趣基因或蛋白的表达,以优化和微调所需的效果。四环素诱导系统是一种广泛使用的策略,用以实现特定水平的表达,虽然由于潜在的免疫原性问题,它不太可能被应用于人类。有研究开发了一种使用免疫抑制药物雷帕霉素来激活的反应性转录因子的系统,该系统最初由两个不同的rAAV递送,随后被优化成只需要一个rAAV就足够了。目前该系统已被用于对雷帕霉素处理的可诱导剂量-反应表达,以长期表达所需的转基因。重要的是,在没有给予雷帕霉素的情况下,转基因表达只有最小限度,表明这可能是一个特异且安全的调控系统。
转录后调控:一种策略是使用核糖开关(riboswitches),这是一类非编码RNA元件,主要存在于细菌mRNA的5'非编码区(5'UTR),但在真核生物mRNA的3'UTR及初始转录产物的内含子区段也有发现。核糖开关通常由两部分组成:适配体(aptamer)域和表达平台(expression platform)域。适配体域负责结合特定的小分子代谢物,即配体(ligand),而表达平台域则负责基因表达的调控。当特定分子(配体)结合适配体域时,会引起表达平台域的局部构象发生变化,从而打开或关闭下游基因的表达。核糖开关广泛存在于细菌中,它们在细菌的硫代谢、辅酶合成、氨基酸合成等基础代谢中发挥着非常重要的调控作用。迄今为止,已有20余类感应不同分子的核糖开关在细菌中被确认。目前核糖开关正被用来系统工程化哺乳动物基因表达调节器aptazymes,以改善其调控范围。使用核糖开关的优点包括与FDA批准的药物兼容、RNA的小尺寸,以及几乎没有免疫原性。重要的是,核糖开关序列非常短,这与rAAVs有限的包装能力相结合时尤为重要,使其成为调控rAAV基因治疗的强大系统。
非编码RNA是转基因调控中的多功能工具。将带有可切割的聚A信号(PAS)的RNA aptamers整合到转基因的5'-非翻译区(UTR)中,在没有小分子的情况下,PAS切割导致mRNA降解,从而沉默转基因表达;添加小分子时, mRNA的完整性得以维持,转基因可表达,可以将这种工具与可变剪接相结合,以更精确地控制基因表达。
一些调控系统需要外源性添加或共表达某些元件才能起作用。为了缓解这个问题,研究者们一直在追求使用药物诱导剪接作为基因表达调控的机制。这种方法涉及递送一个包含过早终止密码子的基因,以防止蛋白质的翻译。添加小分子剪接诱导剂有助于将一个特别设计的外显子包含到成熟转录本中,并排除终止密码子,从而使得感兴趣蛋白质的翻译成为可能。启动子的强度和诱导分子的剂量可精确激活目标基因的表达水平。然而,当前技术依赖于固有蛋白质周转机制来降低目标蛋白质的水平。
翻译后调控:调节感兴趣蛋白质半衰期的策略之一是使用蛋白质降解系统(degron),该系统允许对蛋白质的移除和恢复进行可逆和快速响应。一些研究已在体外建立degron系统,但在尝试将其转化为体内系统时发现存在较高的毒性。然而,通过优化已经生成了一些有前景的可应用于体内的系统,如在感兴趣蛋白质上结合一个SMASh (small-molecule–assisted shutoff) 标签,然后引入一种已经获批用于人类的小分子药物,以防止SMASh标签的分离,从而导致蛋白质的降解。结合可诱导表达系统、替代剪接策略和蛋白质降解方法,有可能实现对目标蛋白表达水平的精细控制。
04
优化转基因(转录后水平)
在表达盒优化中一个常见的方法是密码子优化,即使用计算机算法识别转基因中罕见或次优的密码子,并用更受偏好的密码子替换它们。研究已经证明,在小鼠模型中,对FVIII和人类囊性纤维化跨膜传导调节因子(CFTR)进行密码子优化后,其表达水平显著提高。此外,对Canavan病的致病基因,一种天冬氨酸酰酶(ASPA)的密码子进行优化,显著恢复了ASPA蛋白的表达,并在小鼠模型中挽救了致命的疾病表型。虽然密码子优化是提高rAAV递送的转基因表达的有效策略,但这种效果可能因特定的转基因和宿主生物而异。密码子优化方法可能会引入意外的免疫原性和毒性,以及损害其它特性,如嗜性。事实上,一项研究发现密码子优化在基于rAAV8的FIX Padua基因治疗中引入了大量CpG基序,这可能引发先天免疫反应。一项研究开发了一种新的基于循环神经网络的工具,该工具使用来自小鼠心肌细胞、神经元和肝细胞的数据,为特定细胞类型优化密码子使用,这种方法提高了蛋白表达水平并减少了CpG二核苷酸,为提高组织特异性基因治疗效率提供了希望。
05
修改其他顺式调控元件
在表达盒中修改其它顺式调控元件可以调节基因表达和特异性。例如,土拨鼠肝炎病毒转录后调控元件(WPRE)是一个约600 bp的RNA元件,通常添加在转基因下游。WPRE可以通过增加与转基因无关的mRNA转录量来提高体外和体内的转基因表达。有研究谨慎地报告了WPRE在小鼠中递送的慢病毒载体中潜在的致癌活性。然而,通过从原始WPRE中移除致癌序列,可以降低此类风险。
在转基因表达盒中包含内含子也可以改善动物中的基因表达。有研究表明内含子在体内可以将转基因表达提高40-100倍。然而,内含子对基因表达的影响可能是复杂的,取决于多种因素,如内含子的大小和位置以及特定的目标细胞。选择合适的polyA信号对于优化转基因表达和稳定性很重要【例如,β-球蛋白、SV40或牛生长激素(BGH)】。一项比较研究发现,修改后的SV40晚期polyA(135 bp)的较短版本在小鼠大脑中的转基因表达与BGH polyA(223 bp)相当。此外,包含Kozak序列可以进一步增强转基因表达。
确保仅限在目标组织中表达目的基因对于避免有毒性的过表达和免疫毒性至关重要。rAAV设计采用了细胞特异性启动子作为目标表达的主要策略,并进一步开发了微调策略,例如在3′-UTR中添加miRNA结合位点以抑制目标基因在表达互补miRNA的细胞中的表达。如在rAAV9中添加miR-122结合位点可以实现在中枢神经系统表达的同时减少靶向肝脏、心脏和骨骼肌。当rAAV携带外源转基因,或对患者体内发生无义突变的基因拷贝进行替代时,转基因产物可能被抗原呈递细胞(APCs)视为非自身抗原,然后APCs处理转基因产物,通过主要组织相容性复合体(MHC)进行提呈,启动免疫清除。减轻转基因免疫的一种策略是在rAAV的表达盒中结合APC特异性miRNA结合位点,如miR-142和miR-652,以抑制转基因在APCs的表达。结果显示,在小鼠中转基因特异性免疫反应减少,目标细胞中转基因表达持续。这种策略已在非人灵长类动物中转化,通过rAAV递送后,针对人类免疫缺陷病毒的NAbs得到了广泛持久的表达,突出了这种策略在临床转化中的潜力。
06
扩展rAAV包装能力
rAAV应用中的另一个重大挑战是递送超过其4.7 kb包装能力的转基因,如Leber先天性黑蒙症10型的中心体蛋白(CEP290)(约7.5 kb),或基于CRISPR的工具,如胞嘧啶碱基编辑器或先导编辑器2(超过5 kb)。为了克服这一障碍,可将大基因片段分成两部分,每部分都封装在rAAV衣壳中。这些分段的转基因被共同引入同一细胞,从而重组成全长基因和蛋白。这种重构可以在遗传信息流的不同阶段发生。在DNA水平上,可以通过rAAV ITRs、部分转基因序列或在两个rAAV基因组中都存在的优化的重组元件来促进载体间DNA重组。重叠序列可以在转录后通过特别设计的剪接信号被切除,产生成熟的全长mRNA,随后被翻译成所需的蛋白。在RNA水平上,通过每个转录本中存在的剪接供体和受体介导的两个单独载体的转录本之间的跨剪接,生成全长转录本和蛋白。在蛋白水平上,可以通过分裂型内含肽(分裂型内含肽是能够切除自身并连接附近蛋白片段的天然多肽)实现蛋白重构。
参考资料:
1. https://doi.org/10.1038/nbt.3440
2. https://doi.org/10.1016/j.omtm.2020.12.006.
3. https://doi.org/10.1016/j.cell.2021.08.028
4. https://doi.org/10.1038/s41392-024-01780-w






































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论