 关注小药说药,一起成长!
关注小药说药,一起成长!单克隆抗体(mab)已成为一类越来越重要的药物,它的临床应用彻底改变了癌症治疗的领域。尤其细胞毒性T淋巴细胞相关抗原4(CTLA-4)和程序性细胞死亡蛋白1(PD-1)作为抗肿瘤免疫的负调节因子的发现促进了许多免疫调节抗肿瘤药物的开发。不同单抗的抗肿瘤作用机制不同,包括阻断肿瘤特异性生长因子受体或免疫调节分子,以及补体和细胞介导的肿瘤细胞溶解。临床前研究表明,基于免疫球蛋白G(IgG)疗法的疗效不仅取决于其阻断或结合靶点的能力,还取决于抗体的Fc片段及其与Fcγ受体(FcγRs)的相互作用。因此,对于许多单抗来说,Fc介导的效应器功能对治疗的疗效至关重要。
然而,我们对这些免疫调节抗体的这些相互作用如何增强抗肿瘤免疫的理解仍然知之甚少。因此,进一步了解评估IgG亚类、遗传多态性的影响,以及这些抗体作用机制的临床前和临床研究之间的转化,有助于我们进一步提高这些治疗药物的疗效。
抗体是免疫球蛋白超家族的成员,在结构上由两个结构域组成:负责抗原识别的结合结构域(Fab)和与Fc受体(FcRs)结合的Fc结构域。Fab包括轻链和重链的互补决定区(CDR),该互补决定区包含六个决定抗原识别的高可变区。Fc区由重链α链、δ链、ε链、γ链或μ链组成,分别存在于IgA、IgD、IgE、IgG和IgM中,定义了抗体同种型。FcRs有三种类型:I型,包括典型的Fcγ受体;II型,其含有C型凝集素受体如CD209和CD23;以及分别负责维持抗体半衰期和降解的细胞内受体新生Fc受体(FcRn)和TRIM-21。
IgG亚类抗体由于其强大的效应器功能和易于生产而在临床上应用最广泛。IgG根据结构和与FcγRs亲和力可以分为不同的亚类。在人类和小鼠中,有四个亚类:hIgG1、hIgG2、hIgG3和hIgG4,以及mIgG1、mIgG2a/c、mIgG2b和mIgG3。不同亚类的活性和与FcγRs的结合主要由铰链区长度和存在的二硫键数量的差异驱动。在临床上,hIgG1、hIgG2和hIgG4已经在治疗癌症方面得到广泛且非常成功的应用。
FcγRs是一个结合单体和免疫复合物IgG的受体家族,可引发激活或抑制功能。这些受体参与驱动抗体效应器功能,包括抗体依赖性细胞毒性(ADCC)和/或抗体依赖性胞吞噬作用(ADCP)、抗原呈递以及趋化因子和细胞因子的释放。
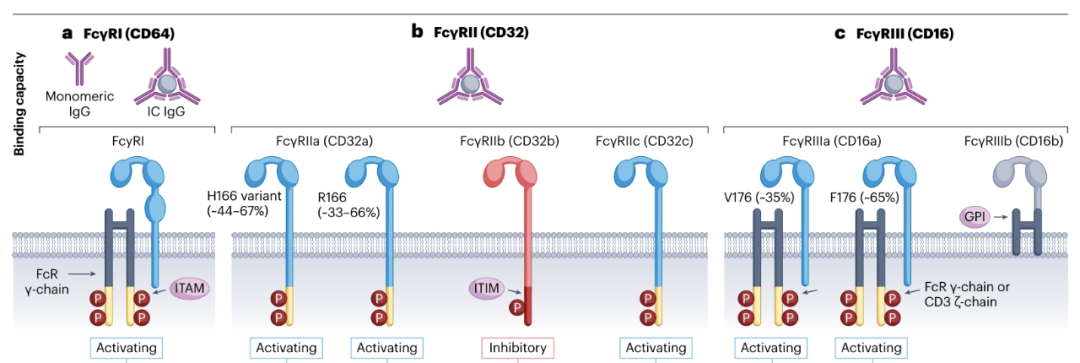
在人和小鼠中,有三个受体家族。其中包括FcγRI(CD64)、FcγRII(CD32)和FcγRIII(CD16)。小鼠表达这三种受体,以及独特的高亲和力FcγRIV(CD16-2)。FcγRI、FcγRIII和FcγRIV被认为是激活受体,而FcγRII是抑制性的。而人类FcγR系统比小鼠的更复杂,通常人类表达FcγRI、FcγRIIa(CD32a)、FcγRIIb(CD32b)、FcγRIIIa(CD16a)和FcγRIIIb(CD16b)。除了缺乏胞内信号结构域的FcγRIIIb和抑制性的FcγRIIb外,其它都被认为是激活性的。
人和小鼠FcγRI、FcγRIII和FcγRIV通过一种含有免疫受体酪氨酸激活基序(ITAM)的衔接蛋白,即Fc受体γ链(FcRγ)发出信号。人FcγRIIa和FcγRIIc是唯一在胞内尾部含有内源性ITAM的FcγRs,不需要衔接蛋白来发出信号。有趣的是,人类自然杀伤细胞(NK)中的FcγRIIIa也与CD3ζ链相关,驱动更有效的信号传导。尽管FcγRIIIb缺乏直接信号传导能力,但该受体已被证明与FcγRIIa顺式相互作用,增强细胞内信号传导,增强中性粒细胞介导的ADCP。FcγRIIb通过与免疫复合物结合并通过内源性细胞内免疫受体酪氨酸基抑制基序(ITIM)发出信号,抑制通过激活FcγRs介导的抗体效应器功能。
FcγRs根据其结合单体或IgG免疫复合物的能力分为高亲和力和低亲和力。亲和力高于107/M-1的FcγRs 可以结合单体和IgG免疫复合物,被认为是高亲和力的;而FcγRs的亲和力低于107/M-1只能与IgG免疫复合物结合,被认为是低亲和力。人hIgG1、hIgG3和hIgG4与所有FcγRs结合,而hIgG2与除FcγRI和FcγRIIIb外的所有FcγRs结合。小鼠mIgG1仅与mFcγRII和mFcγRIII结合,mIgG2a/c和mIgG2b与所有FcγRs结合,而mIgG3仅与mFcγRI结合。但在体内,这些受体的亲和力受到多种变量的影响,如抗体-抗原比率、免疫复合物的大小和受体的位置。

IgG亚类对FcγRs的不同亲和力和每个FcγR的细胞表达水平被用于定义引发“弱”或“强”抗体效应功能的可能性,这被称为激活抑制(A/I)比率。通常,具有hIgG1主链的治疗性抗体用于激活FcγRs并清除靶细胞。相反,hIgG2和hIgG4抗体用于阻断受体-配体相互作用,而不参与激活FcγRs,因为它们对FcγRs的亲和力相对较低。然而,hIgG2和hIgG4仍然具有结合激活的FcγRs的能力,可能在意想不到的情况下驱动效应器功能。由于FcγRIIa和FcγRIIIa主要在NK细胞、粒细胞和巨噬细胞上表达,它们被认为是人类IgG的主要效应细胞。在小鼠中,当需要抗体效应器功能时使用mIgG2a,而当阻断靶的生物活性时使用mIgG1。mIgG2a的治疗性抗体需要与髓系细胞上的高亲和力小鼠FcγRs、mFcγRI和mFcγRIV结合,以清除靶标。
人类和小鼠之间存在两个关键差异:人和小鼠高亲和力FcγRs的差异以及高亲和力FcγRs对应效应细胞的差异,特别是mFcγRIV在小鼠是独特的,在结构上与hFcγRIIIa同源,但由于其结合单体IgG的能力更强。因此,当试图将小鼠的数据或结论外推到人类身上时,mFcγRIV在肿瘤靶向抗体中的潜在重要性代表了一个问题,因为它没有功能对应物,这突出了对更好的小鼠模型的需求。
FcγRs已在人类血液中的外周循环免疫细胞上得到广泛表征。hFcγRI在单核细胞和树突状细胞上表达,并可在活化的中性粒细胞中上调。hFcγRIIa在所有髓系细胞和血小板上表达,hFcγRIIb在B细胞、单核细胞和树突状细胞亚群上表达。hFcγRIIIa在NK细胞和单核细胞上表达,而hFcβRIIIb仅在中性粒细胞和嗜碱性粒细胞上表达。经典的单核细胞(CD14+CD16-)表达最高水平的hFcγRI和hFcγRIIa,而非经典的单核细胞(CD14-CD16+)表达hFcαRIIa和FcγRIIIa,在两个单核细胞亚群上都表达低水平的hFcγRIIb 。
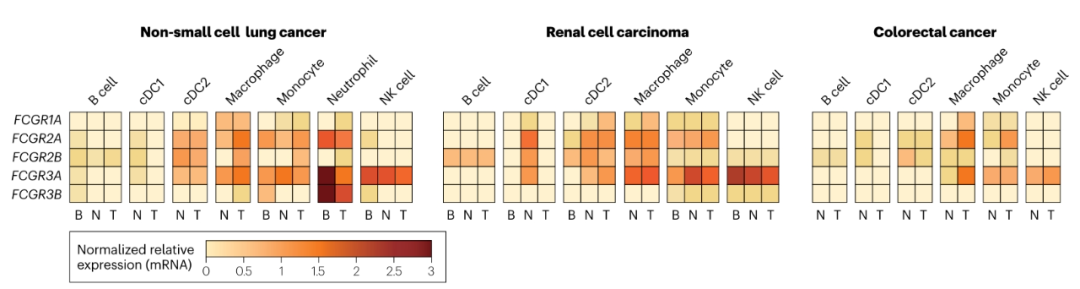
为了进一步了解FcγRs在人类肿瘤中的表达,使用公开的单细胞RNA测序(scRNA-seq)数据评估不同FcγRs在关键免疫细胞群体中的表达。在NSCLC、RCC和CRC这三种肿瘤中,FCGR1A和FCGR2A仅限于骨髓细胞,而FCGR3A在单核细胞、巨噬细胞、树突状细胞和NK细胞中表达。在NSCLC和RCC中,与正常组织和血液相比,NK细胞表达的FCGR3A水平较低。FCGR2B在三种肿瘤类型的巨噬细胞和单核细胞中的表达上调。与正常组织相比,在所分析的三种肿瘤类型中,I型常规树突状细胞(cDC1)上的FcγR表达始终较低,这再次表明TME的调节作用。此外,与NSCLC和RCC相比,CRC内的大多数免疫细胞表达低水平的所有FcγR mRNA,其中FCGR3A表现出最显著的下调。尽管这些数据仍需要在蛋白质水平上进行验证,但它们强调了FcγR在不同肿瘤类型中表达的多样性。
第一代被批准用于临床的治疗性抗体,仍然是癌症治疗中最常见的一类单克隆抗体,由直接针对肿瘤抗原的抗体组成。这些肿瘤抗原或多或少对肿瘤的生长、存活和侵袭具有重要作用(如抗HER2、抗EGFR)。然而,在人类和小鼠中的一些观察表明,Fc介导的免疫细胞激活是其中许多单抗的一个重要的额外作用机制。

抗体的Fc部分可以激活效应细胞,如NK细胞、巨噬细胞或中性粒细胞上的FCR,然后介导肿瘤细胞溶解。这通过细胞毒性作用(抗体依赖性细胞介导的细胞毒性-ADCC)或对肿瘤细胞的吞噬作用(抗体依赖性细胞介导的吞噬作用-ADCP)介导。此外,抗体通过其Fc尾部,可通过结合C1q激活补体级联反应,从而通过几种不同的机制导致肿瘤细胞溶解。这包括膜攻击复合物(MAC)的形成,直接诱导靶细胞的溶解(CDC)或通过补体成分C3a和C5a的化学趋向性吸引免疫细胞。
此外,C3b和C4b介导NK细胞、巨噬细胞/单核细胞和粒细胞的补体依赖性细胞介导的细胞毒性(CDCC),或髓系细胞的补体依赖性细胞介导的吞噬作用(CDCP)。抗体介导的细胞死亡也会导致肿瘤抗原的释放和免疫复合物(IC)的形成,从而促进抗肿瘤T细胞反应的启动,维持对肿瘤的控制和排斥反应。在这个过程中,与FcγRs的结合和补体的激活在树突状细胞(DC)摄取IC及对肿瘤抗原的呈递中起着关键作用。
IgG-Fc效应器功能通过补体和FcγRs介导,它们分为激活受体(FcγRI,FcγRIIa/IIc,FcγRIIIa,FcγRIIIb)或抑制受体(FcγRIIb)。由于大多数效应细胞同时表达激活和抑制FcγRs,IgG结合的结果是相对综合亲和力、受体可用性和信号能力的结果。抗体对其受体的相对亲和力定义为激活抑制比(A/I)。
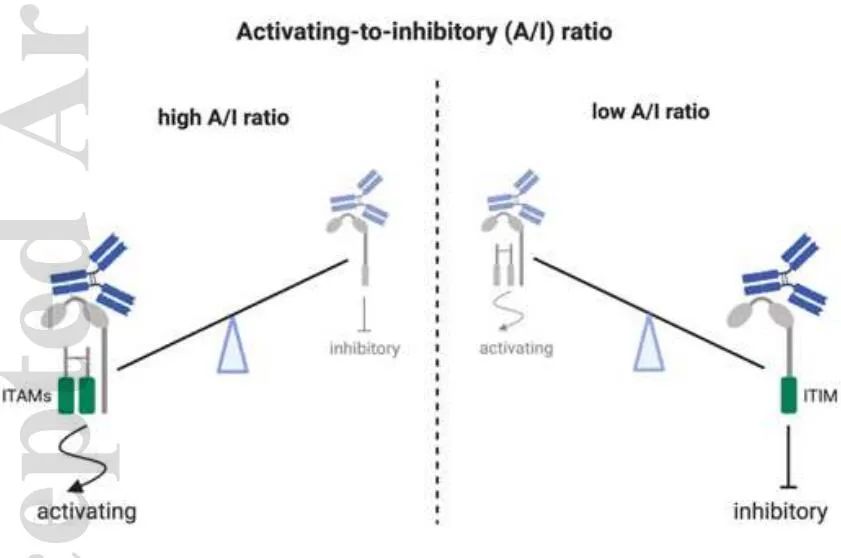
A/I比率的概念是基于对小鼠的观察,结果表明mIgG2a的A/I较高,mIgG1的A/I较低,mIgG2b的A/I介于中间。因此,在许多体内模型中,mIgG2a亚类的治疗性抗体被证明能更有效地清除肿瘤。虽然人IgG亚型间A/I比值的差异不太明显,但由于它们的FcR结合谱不同,它们诱导免疫应答的能力也不同。IgG1和IgG3与所有FCR结合,但对激活的FCR表现出更高的亲和力。因此,它们被定义为具有强烈Fc效应器功能的Ig亚型。另一方面,IgG4与大多数激活的FcRs和抑制FcγRIIb结合的亲和力相似,被认为是低活性的。最后,除了高亲和力的H131 FcγRIIa等位基因,IgG2与大多数FCR的结合较差,Fc效应器功能有限。因此,IgG1和IgG3能够发挥有效的效应器功能来消耗抗体,而IgG2和IgG4在避免Fc介导的细胞耗竭时是首选的。
1. 优化激活抑制比
提高IgG-Fc效应器功能的一种常用方法是通过增加激活FcγRs的亲和力和降低与抑制性FcγRIIb的结合来优化A/I比值。一种提高A/I比值的方法是通过糖工程化成功实现的,最相关的修饰是N297多糖的去岩藻糖基化,它显著增加了对FcγRIIIa的亲和力,改善了ADCC效应。两种去岩藻糖基化的单抗已获得上市批准(抗CCR4的mogamulizumab和抗CD20的obinutuzumab),其他一些目前正在进行临床试验。
另一种提高A/I比率的常用策略是在Fc尾部中引入点突变。这一类中最有前景的单抗是margetuximab,一种抗HER2抗体,其Fc尾部具有5点突变,从而改善了与FcγRIIIa和FcγRIIa的结合,并且降低了与FcγRIIb的结合。
2. 优化补体依赖性细胞毒性
CDC被认为是一些治疗性单抗(如抗CD20)的重要作用机制。优化Fc介导的补体激活是一种有效策略。
由于其自然存在的五聚体和六聚体形式,IgM表现出最大的补体激活能力。然而,IgM在治疗性单克隆抗体的开发中并没有受到太多的关注,只有少数肿瘤靶向的IgM单克隆抗体在临床试验中得到了评估。其中PAT-SM6获得了EMA和FDA针对多发性骨髓瘤的孤儿药资质。
在IgG亚类中,IgG1和IgG3是很好的补体激活剂,IgG3似乎是更有效的亚型。然而,尽管IgG3的内在问题,如体内半衰期短,已经成功地得到了解决,但其具体的制造问题仍使其在药物开发方面的吸引力降低。
另外,通过构建IgG1/IgG3嵌合抗体,可以实现IgG1(有利制造特性)和IgG3(增强型CDC)两者优点的结合。最佳结构称为113F,它将IgG1的CH1和铰链区与IgG3的CH2以及部分来自IgG3、部分来自IgG1的CH3结合在一起。这种嵌合抗体的去糖基化版本显示,除了保留与蛋白A结合外,CDC和ADCC的增强程度与去岩藻糖基化IgG1相当。在体内,抗CD20 113F抗体与IgG1相比表现出更大的B细胞耗竭(这两种抗体都是去岩藻糖基化的,以改善ADCC)。这项研究表明,优化的补体激活和A/I比率的结合是一种很有前途的改进肿瘤清除抗体的策略。
增强补体激活的其他策略包括引入点突变来改善IgG1与C1q的结合。重要的是,增强CDC的突变可以与单个IgG1中的ADCP和ADCC增强突变结合起来,从而扩大这些抗体的效应器功能。最后,有利于IgG六聚体形成的突变也显著增强了C1q的结合,从而增强了CDC作用。然而,这些Fc突变是否能转化为提高临床疗效仍有待观察。
3. 应用Ig的其它亚型
IgE:IgE可通过两种激活受体(高亲和力FcεRI和低亲和力FcεRII)介导其Fc效应器功能。虽然FcεRI主要由肥大细胞(MC)和嗜碱性粒细胞表达,但FcεRI在嗜酸性粒细胞、树突状细胞和髓系细胞上也有表达。与IgG类相比,IgE具有许多优点,例如,它对其受体FcεRI的亲和力比IgG的高亲和力受体FcγRI高两个数量级。由于具有如此高的FcɛRI亲和力,IgE被局部保留在表达FcɛRI的细胞上,并且在组织中具有良好的生物利用度,这对实体瘤的治疗具有重要意义。此外,IgE缺乏能引起免疫抑制的抑制性Fc受体,如IgG47中的FcγRIIb。

关于IgE治疗的一个潜在的担忧是,MC或嗜碱性粒细胞的脱颗粒导致潜在的危及生命的过敏反应的风险。然而幸运的是,在临床前模型中没有发现过敏反应的迹象,啮齿动物和猴子的安全性数据令人满意,支持首次使用肿瘤靶向抗叶酸受体α-IgE单克隆抗体MOv18(NCT02546921)进行临床试验。来自24名患者的1期数据支持了MOv18-IgE的安全性和潜在疗效。容易控制的荨麻疹是最常见的副作用,只有1例患者出现过敏反应。此外,在一名患者中观察到抗肿瘤效果。
IgA:另一种相当有前途的肿瘤清除单抗Ig亚型是IgA,它通过FcαRI介导其效应器功能。FcαRI在多形核细胞(PMNs)上高表达,使得中性粒细胞成为IgA单抗治疗最相关的细胞类型。中性粒细胞是人类最丰富的细胞毒性细胞类型。它们具有多种强大的细胞破坏机制,包括释放细胞毒性分子、诱导细胞凋亡和坏死。此外,与IgG1/IgG3嵌合体相似,人们试图构建IgG1/IgA嵌合体,目的是结合这两种不同亚型的优点。这些方面得研究仍处于早期阶段。
FcγR在肿瘤内的异质性表达、其靶密度以及由特异性IgG亚型驱动的抗体-FcγR相互作用为癌症免疫疗法中治疗性免疫调节抗体的设计、功能和理解增加了相当大的复杂性。而所有FcγRs的总体表达和A/I比率是免疫调节抗体能否实现疗效的关键决定因素。
抗体工程是调节FcγR结合的强大工具,影响治疗性抗体的活性、半衰期和生产制造。Fc的点突变和N297糖基化位点的修饰已被广泛用于修饰IgG与补体、FcRn和FcγRs的结合,以影响其作用机制。最常见的突变之一是用于治疗性hIgG4抗体的S228P突变。S228P突变防止自发的Fab臂交换,并在体内稳定抗体以维持二价靶标结合。另一种常见的策略是对Fc的CH2结构域内连接到N297的聚糖进行糖工程改造。例如,从hIgG1的N297处的聚糖谱中去除岩藻糖可以增加与FcγRIIIa的结合,以增强效应器功能。相反,用丙氨酸(N297A)或谷氨酰胺(N297Q)取代297位的天冬酰胺,以及其他氨基酸变化,可以消除聚糖谱减少与FcγRs的相互作用。此外,除了Fc的突变和糖基化的变化外,许多新的策略也正在研究中。一个例子是hIgG2抗体铰链区的突变,增加了它们传递激动信号的能力。
CTLA-4
CTLA4因其与抗原呈递细胞(APC)上的CD80和CD86的结合超过CD28,作为T细胞激活的负调节因子。在活化的效应T细胞(Teff细胞)上阻断CTLA-4的抗体允许CD28与CD80和CD86相互作用,从而触发抗肿瘤免疫。

美国食品药品监督管理局(FDA)已经批准了两种CTLA-4抗体,ipilimumab(hIgG1)和tremelimumab(hIgG2)。尽管hIgG1具有比hIgG2更高的亲和力,hIgG1和hIgG2都可以参与激活FcγRs,潜在地驱动抗体效应器功能并导致表达CTLA-4的细胞的清除。在最近的一项临床试验中,在nivolumab治疗黑色素瘤患者之前,ipilimumab治疗与更好的生存率相关,这被认为是由肿瘤内Treg细胞的清除驱动的。然而,该领域仍存在争议,需要更好地了解临床CTLA-4抗体对Teff细胞、Treg细胞和TME其余部分的个体影响。
PD-1
PD-1是一种抑制性受体,在T细胞受体(TCR)参与时上调,并在肿瘤反应性Teff细胞表面高水平表达。PD-1与其在肿瘤和APC上表达的配体PD-L1的结合导致T细胞激活的抑制。
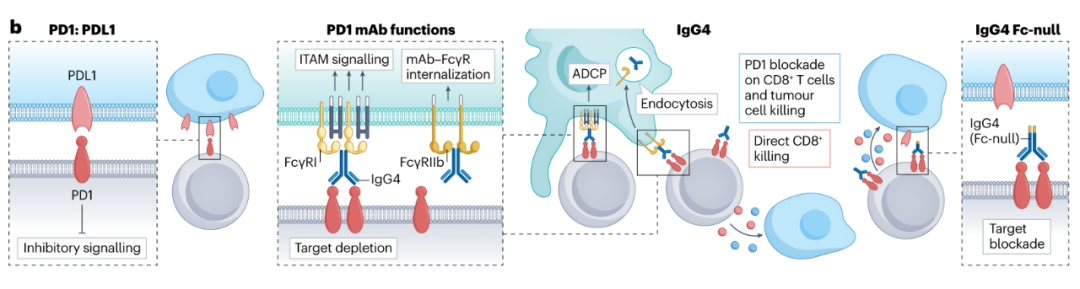
FDA已经批准了几种靶向PD-1的抗体,这些抗体使用S228P突变改造的hIgG4亚型阻断其与PD-L1的相互作用。令人感兴趣的是,tislelizumab与其他FDA批准的PD-1抗体不同,因为它在其恒定区经过一系列突变改造,以降低FcγR的结合,有可能防止Fc–FcγR相互作用的有害影响。几项研究表明,FcγR与抗PD-1 hIgG4结合会产生负面影响,包括表达FcγR-的TAMs捕获PD-1抗体,并清除具有杀死肿瘤细胞能力的PD1高表达肿瘤反应性T细胞。
PD-L1
PD-L1是PD-1的主要配体,PD-L1/PD-1轴是中枢和外周免疫耐受的主要控制器。在TME中,PD-L1可由肿瘤细胞、髓系细胞和活化的Teff细胞表达。
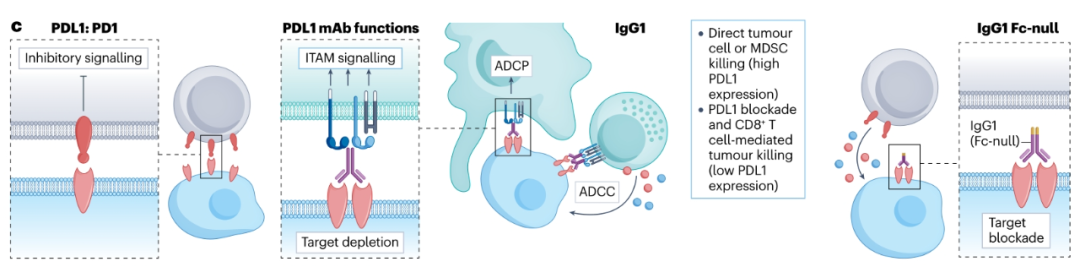
目前有三种FDA批准的PD-L1抗体,atezolizumab、durvalumab和avelumab,具有不同的FcγR-结合特性。与具有Fc突变hIgG1亚型的atezolizumab和durvalumab不同,avelumab是一种野生型hIgG1,具有完整的FcγR结合。Avelumab已被证明在参与hFcγRIIIa后介导同种异体癌症细胞系的ADCC,类似于其他肿瘤靶向hIgG1抗体。然而,由于Teff细胞和APC也在TME中表达PD-L1,Avelumab也可能清除这些群体,导致次优的抗肿瘤活性。最近的研究发现,Avelumab的生存益处与晚期尿路上皮癌中FCGR2A和FCGR3A中SNPs的两个或多个高亲和力等位基因的存在有关。富含NK细胞和巨噬细胞的肿瘤患者的总生存率更高,这表明这些细胞是阿维鲁单抗治疗后抗体效应器功能的关键。最有可能的是,抗PD-L1药物的最终体内活性将取决于PD-L1在不同免疫细胞和不同TME中的分布和表达水平。
LAG-3和TIGIT
淋巴细胞活化基因3(LAG-3)和具有免疫球蛋白和ITIM结构域的T细胞免疫受体(TIGIT)是存在于Teff细胞上的共抑制受体,与T细胞耗竭和肿瘤杀伤活性降低有关,但也在肿瘤浸润性Treg细胞上表达。
FDA最近批准了LAG-3抗体relatlimab(hIgG4S228P)与抗PD-1(nivolumab)联合治疗晚期黑色素瘤。与大多数PD-1抗体类似,relatlimab被开发用于阻断LAG-3的抑制活性,而不引发抗体效应器功能。
Tiragolumab,一种抗TIGIT hIgG1抗体,最近获得了FDA的突破性疗法,用于联合PD-L1抗体atezolizumab治疗NSCLC。最近的的结果显示接受Tiragolumab治疗的患者的CD4+和CD8+Teff细胞和NK细胞活化、Treg细胞清除以及伴随的髓系细胞活化。此外,目前处于I/II期临床试验的另一种TIGIT阻断抗体(EOS-448,hIgG1)也能够促进体外Treg细胞清除。这些结果表明,抗TIGIT的抗体可能在“最佳点”微环境中发挥作用,在该微环境中,除了它们的阻断活性外,高靶抗原密度驱动清除(如Treg细胞),而低靶抗原密度优先促进靶阻断(如Teff细胞)。
CD28
CD28在几乎所有的人外周CD4+Teff细胞和大约一半的CD8+T细胞中表达。CD28对于通过肽-主要组织相容性复合体(MHC)结合初始TCR后的T细胞活化至关重要,促进增殖和存活。
Theralizumab(TGN-1412)是第一种在临床上测试的CD28抗体,其设计具有野生型hIgG4亚类(缺乏S228P突变),作为靶向人CD28的超级激动性抗体,独立于TCR。在I期临床试验中,健康志愿者服用theralizumab会导致细胞因子释放综合征(CRS),导致严重的炎症反应和慢性器官衰竭。进一步的体外研究表明,theralizumab的hFcγRIIb超交联增强了CD28聚集,并增加了CD4+Teff细胞的细胞因子产生,至少驱动了其部分毒性,这是临床前研究中未观察到的特征。此外,该抗体具有野生型IgG4,没有S228P突变,这表明它可能在体内进行了Fab臂交换,可能会增加其毒性效应。
ICOS
在结构和功能上与CD28相关,ICOS是一种共刺激受体,其表达在T细胞激活后被诱导。在肿瘤中,ICOS主要在Treg细胞上表达,在Teff细胞上表达水平较低。ICOS-ICOS配体(ICOSL)相互作用对CTLA-4抗体的抗肿瘤活性至关重要。

已经在临床上评估了几种具有hIgG1或hIgG4骨架的ICOS抗体。有人赞成开发具有效应器功能hIgG1的抗ICOS抗体(vopratelimab),以促进ICOS高表达Treg细胞的消耗,以及表达较低水平ICOS的Teff细胞的激活(通过受体交联)。另一种种更为保守,用hIgG4开发抗ICOS抗体(feladilimab),激活ICOS并减少消耗活化的ICOS高表达Teff细胞的机会。然而,这两种抗体都没有产生显著的临床影响,而且还不完全清楚这些分子是否阻断ICOS和ICOSL的自然相互作用,需要更深入地了解靶向ICOS的免疫调节抗体在体内的激动活性,以及FcγR和靶密度在其功能中的作用和影响的系统表征。
CD40
CD40是TNFRSF的成员,是一种在APC上表达的I型膜蛋白,与三聚体CD40配体(CD40L)相互作用,主要表达在活化的CD4+T细胞上。CD40激活通过树突状细胞、增强抗原交叉呈递和增强生发中心形成增强免疫反应。

在已经进入临床试验的许多CD40抗体中,具有增强的FcγRIIb结合的hIgG1和不需要FcγRIIb的hIgG2抗体可能最有希望引发最佳治疗潜力。然而,尽管做出了努力,但大多数使用CD40抗体的临床试验显示出有限的疗效,并导致了与治疗相关的肝毒性和CRS。已经开发了靶向CD40和肿瘤相关抗原的双特异性抗体或树突状细胞标记的肿瘤内递送来克服这些限制。这些最新进展可能有助于将下一代CD40抗体带到临床,并为开发其他激动性抗体提供蓝图。
OX40
人CD4+和CD8+Teff细胞在TCR刺激后瞬时表达共刺激受体OX40。在人类肿瘤中,OX40在Treg细胞上最高表达,在CD4+Teff细胞上也有高水平表达,在CD8+Teff细胞上几乎没有表达。
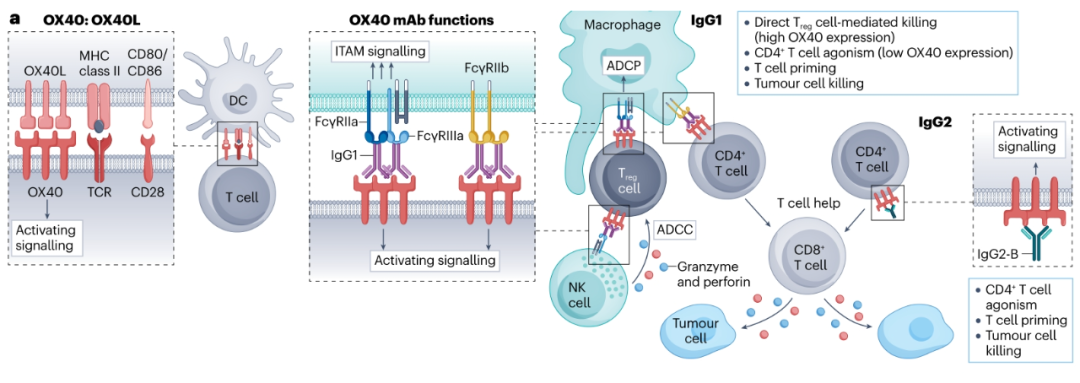
人OX40抗体已经在临床上使用hIgG1或hIgG2亚型进行了测试。Ivuxolimab(PF-04518600)是唯一的hIgG2,在一项I期试验中作为单一疗法进行了测试,发现它能促进血液中CD8+Teff细胞的克隆扩增,在6%的局部晚期或转移性癌症患者中有部分反应。在同一项研究中,ivuxolimab与4-1BB抗体(utomilumab)联合使用,在少数晚期实体癌患者中显示出一定疗效。hIgG1 OX40抗体也已在早期临床试验中进行了测试。尽管缺乏临床活性,Cudarolimab(IBI101)和tavolimab与CD4+和CD8+Teff细胞的扩增有关,在后者的情况下与TME内的Treg细胞清除有关。
4-1BB
4-1BB在活化和记忆性CD4+和CD8+Teff细胞上表达,其通过4-1BB配体(4-1BBL)的结合驱动这些细胞的活化和增殖。
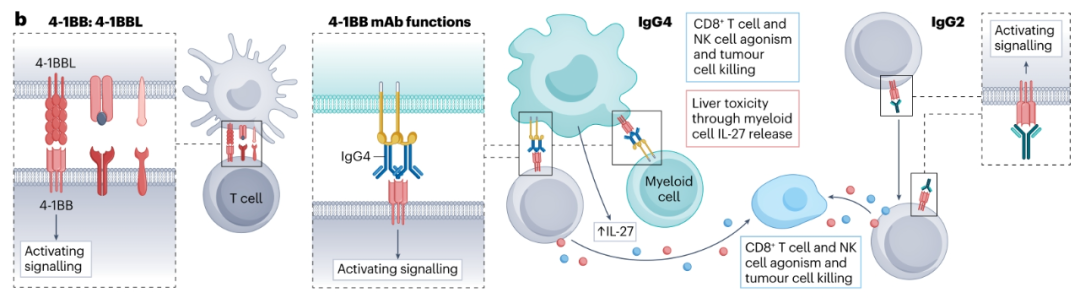
目前,两种4-1BB抗体已在临床上进行了评估,即urelumab(hIgG4)和utomilumab(hIgG2)。与ICOS和OX40类似,这些抗体在临床试验中显示出有限的反应。Urelumab和utomilumab在循环NK细胞、CD4+Teff细胞和CD8+Teff以及树突状细胞上显示出激活标记物的表达增加。然而,由于其相当大的肝毒性,urelumab显示出较差的安全性,而utomilumab具有更可接受的安全性。utomilumab更有利的安全性可能部分与这样一个事实有关,即utomilumab的激动性不如urelumab,并且其hIgG2亚型不与FcγRIIb结合。一种潜在的4-1BB抗体开发策略可能是降低utomilumab或urelumab的Fab亲和力,同时工程化hIgG2亚型以驱动不依赖于FcγRs的4-1BB激动剂。
单克隆抗体的临床应用从根本上改变了肿瘤的治疗方法。然而,越来越明显的是,单克隆抗体通过多种不同的作用机制来调节它们的作用。选择正确的Ig亚型是至关重要的,因此人们投入了大量的精力来理解不同抗体亚型的Fc介导作用以及Fc修饰,以进一步提高抗体的疗效。为了优化Fc介导的效应器功能,人们开发了多种策略,为改进基于抗体的癌症治疗提供了全新的机会。此外,通过考虑患者相关因素,例如他们的免疫状态、TME或FcγR多态性的特征,Ig亚型选择可以允许开发在更广泛的患者中活跃的抗体,或者允许选择性地使用针对个人需求的抗体。
尽管取得了一些进展,但我们的理解仍然存在差距,需要对FcγR生物学、多态性和表达FcγR的先天免疫细胞进行系统评估,并对靶点进行深入了解,以促进临床的成功。
参考文献:
1.Fcγ receptors and immunomodulatory antibodies in cancer. Nat Rev Cancer.2024 Jan;24(1):51-71.
2. Isotype selection for antibody-based cancer therapy. Clin ExpImmunol. 2020 Nov 5.
公众号内回复“肿瘤免疫”或扫描下方图片中的二维码免费下载《小药说药肿瘤免疫全集》的PDF格式电子书!

公众号已建立“小药说药专业交流群”微信行业交流群以及读者交流群,扫描下方小编二维码加入,入行业群请主动告知姓名、工作单位和职务。





































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论