
关于肾脏
肾脏是位于脊柱两侧的一对豆状器官,人类的肾脏大约有拳头大小,重约150克。肾脏的主要功能是过滤血液,去除废物和多余的液体,形成尿液。肾脏的内部结构可以分为两个主要部分:皮质和髓质。肾皮质位于外层,是肾小球和肾小管的主要分布区域;肾髓质位于内层,由多个肾锥体组成,每个肾锥体的顶端称为肾乳头。肾锥体的尖端汇集成肾小盏,最终形成肾盂,连接到输尿管,将尿液送往膀胱。肾单位(nephron)是肾脏的基本功能单位,每个肾脏约有一百万个肾单位。每个肾单位包括肾小体和肾小管两大部分。肾小体由肾小球和包围它的肾小囊(Bowman囊)组成。肾脏有多种细胞类型,主要包括内皮细胞、足细胞、系膜细胞、近端小管细胞、远端小管细胞、髓袢细胞、间质细胞等,它们在肾脏不同部位发挥特定的功能。

图1. 肾脏结构示意图和肾皮质的纤维结构1
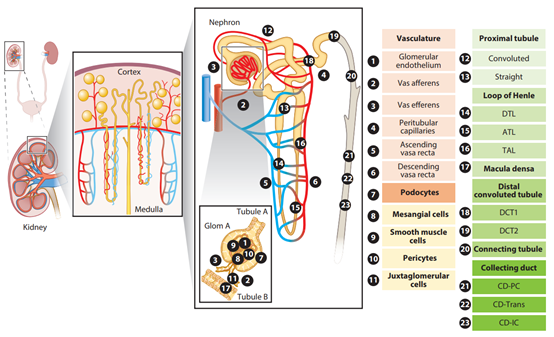
图2. 肾脏的主要细胞类型2
靶向肾脏不同类型细胞的AAV血清型
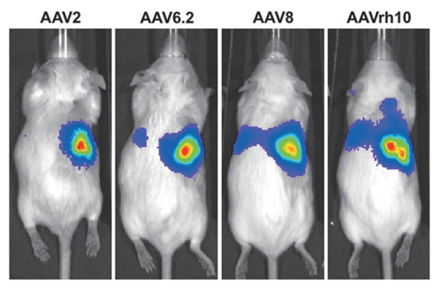
图3 不同AAV血清型对肾脏的靶向性3
导入方式为肾皮质注射,1012 gc/只,体积为50-100μl。
我们根据文献报道和实践经验总结了肾脏研究中常用的AAV血清型:
细胞类型 | 血清型 |
肾小球上皮细胞 | AAV9 |
肾小球系膜细胞 | AAV9,AAV8 |
肾小球内皮细胞 | AAV9,AAV8 |
肾小管细胞 | AAV9,AAV6,AAV2 |
间质成纤维细胞 | Anc80 |
足细胞 | AAV9, AAV-LK03 |
全肾 | AAV9 |
肾脏研究中常用的启动子型
启动子名称 | 启动子特异性 |
CMV | 广谱启动子 |
ECAD | 集合管细胞启动子 |
SGLT2 | 近端小管启动子 |
KSPC | 肾脏启动子 |
hNHPS1 | 足细胞启动子 |
AAV导入肾脏的方式4


| AAV导入肾脏的方式 | AAV分布 | 特点 | 病毒参考剂量 |
| 尾静脉注射 | 全身大多数器官均可感染 | 操作简单,病毒剂量大 | 5E+11~1E+12vg |
| 肾静脉注射 | 皮质和髓质中,主要在肾小球和近端小管中 | 难以突破肾小球屏障,感染效率较低 | 1E+11vg |
| 肾动脉注射 | 近端小管和肾集合管 | 技术难度大 | / |
| 肾皮质注射 | 仅限于注射针头周围 | 操作相对简单 | 1.5-3ul/位点 |
| 输尿管逆行注射 | 肾脏管道系统 | 突破肾小球屏障,操作难度大 | 1E+11vg |
| 经肾皮质向肾盂注射 | 皮质和髓质的肾小管上皮细胞中,主要是集合管细胞 | 操作简单,感染效率高 | 5E+10vg |
AAV在肾脏疾病研究中的应用
案例一、AAV基因疗法治疗由NPHS2基因突变引起的肾病综合征5
足细胞是肾脏中的一种细胞类型,其基因突变(如NPHS2基因)是儿童遗传性肾病综合征的常见原因。这篇文章旨在探索用AAV基因疗法治疗由NPHS2基因突变引起的肾病综合征。

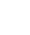
AAV-LK03和AAV 2/9的选择:研究者比较了AAV-LK03和AAV 2/9两种血清型在人类和鼠类足细胞中的转导效率。
体外实验:通过体外培养的突变人类足细胞中来测试基因疗法的效果。
体内实验:在诱导型足细胞蛋白(Podocin)敲除小鼠模型中测试疾病诱导前(预防性)的基因治疗效果,在诱导型突变Podocin敲入小鼠中测试疾病诱导后(治疗性)的基因疗法效果。
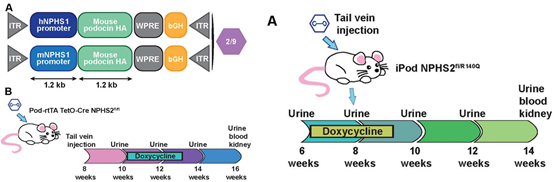
图4 体内实验设计示意图
AAV-LK03的高效转导:在体外实验中,AAV-LK03是人类足细胞的高效转导剂。
功能恢复:AAV-LK03介导的足细胞蛋白在突变人类足细胞中实现了功能恢复。
预防性策略的效果:在诱导型Podocin敲除小鼠模型中,AAV治疗组小鼠的尿白蛋白/肌酐比(ACR)、血清肌酐和尿素水平显著降低,血清白蛋白水平有所升高。肾组织显示出较少的肾小球硬化和间质纤维化,与生理盐水组相比,AAV治疗组的肾小球足突结构较为正常。

图5 接受生理盐水或AAV处理的Pod-rtTA TetO-Cre NPHS2fl/fl小鼠的肾脏组织学和存活情况,这些小鼠在疾病诱导之前接受了治疗。
在诱导型突变Podocin敲入小鼠中,AAV治疗组小鼠的尿白蛋白/肌酐比(ACR)显著降低,血清白蛋白水平有所升高,血清肌酐和胆固醇水平没有显著变化,肾组织显示出较少的肾小球硬化和间质纤维化,足突结构恢复较好。
| 本篇文章体外实验AAV的导入方式 | |
| 细胞系选择 | Conditionally immortalized human Pods, mouse podocytes |
| 血清型 | AAV-LK03,AAV2/9 |
| 转导方式 | 细胞融合度为50%时加入AAV |
| MOI | 5 × 105 |
| 本篇文章体内实验AAV的导入方式 | |
| 小鼠选择 | Pod-rtTA TetO-Cre NPHS2fl/fl,Pod-rtTATetO-Cre NPHS2fl/R140Q小鼠 |
| 血清型 | AAV2/9 |
| 注射方式 | 尾静脉注射 |
| 注射总量 | 1.5 × 1012 vg/只,约6 × 1013 vg/kg |
案例二、miR-29b用于治疗肾脏纤维化的概念验证6
慢性肾病(CKD)是一种进行性疾病,其特征是肾功能逐渐丧失,最终可能导致需要肾脏替代治疗或肾移植。肾脏纤维化是CKD患者几乎普遍存在的一种病理变化。已有研究结果显示miR-29b可以抑制肾纤维化,因此miR-29b替代疗法可能是肾纤维化治疗的有效方法。这篇文章主要研究miR-29b用于肾脏纤维化基因治疗的可行性。

实验设计
确定最适合肾脏靶向基因递送的AAV血清型
体外实验:在正常大鼠成纤维细胞、NRK-49F、TEC和NRK-52E细胞中评估miR-29b对TGF-β1诱导的肾细胞纤维化的影响
体内实验:在UUO小鼠模型中评估miR-29b对肾脏纤维化的影响
AAV血清型选择:体外细胞实验结果显示rAAV1、2和6是适合靶向肾细胞的AAV血清型,小鼠体内实验结果显示rAAV6是最合适的载体。
 图6 rAAV6载体适合在小鼠体内进行肾脏靶向基因递送
图6 rAAV6载体适合在小鼠体内进行肾脏靶向基因递送miR-29b对肾脏纤维化的影响:miR-29b在体外抑制了TGF-β1诱导的肾细胞纤维化。在UUO小鼠模型中,rAAV6介导的miR-29b递送可以抑制肾脏纤维化和Snail1的表达

图7 rAAV6介导的miR-29b递送可以抑制UUO小鼠模型中的肾纤维化
| 本篇文章体外实验AAV的导入方式 | |
| 细胞系选择 | 正常大鼠成纤维细胞、NRK-49F、TEC和NRK-52E细胞 |
| 血清型 | AAV1,2,5,6,7,8,9 |
| 转导方式 | 24孔板,2×109 gc/200 µl/孔 |
| 本篇文章体内实验AAV的导入方式 | |
| 小鼠选择 | 8周雄性C57BL/6小鼠 |
| 血清型 | AAV1,2,5,6,7,8,9 |
| 注射方式 | 用29G针头向肾盂内注射 |
| 注射总量 | 5 × 109 vg/只,约6 × 1013 vg/kg |
AAV作为肾脏基因治疗的潜力载体,其在针对单基因肾脏疾病的基因治疗研究中已有初步成果,尽管整体进展滞后于其他领域,但潜力与应用前景仍不可估量。派真生物一站式CRO&CDMO服务平台,可为您提供全面的病毒载体包装服务和个性化定制服务。我们的产品线涵盖腺相关病毒(AAV)载体、慢病毒载体、mRNA,为您的肾脏基因治疗研究提供全方位的支持,欢迎后台留言或点击文末“阅读原文”了解详情。





































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论