

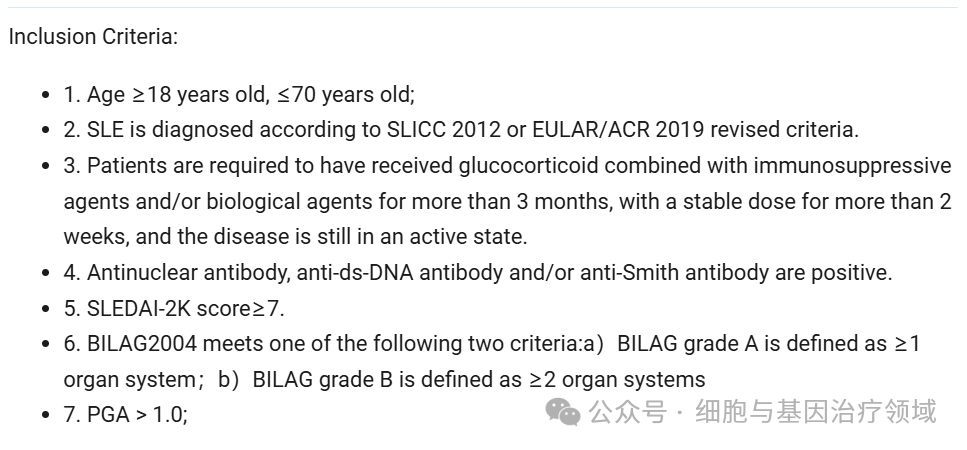
这项研究旨在观察SYS6020在成人难治性活动性系统性红斑狼疮患者中的安全性和耐受性,确定可能用于后续研究的推荐剂量(RD),初步评估该产品的临床疗效,并探索SYS6020注射液在这些患者中的药代动力学和免疫原性。计划共入组50例患者,入组标准如下:

据悉,SYS6020是全球首款获得临床试验批准的基于mRNA-LNP的CAR-T细胞基因治疗药物。该药物通过表达特异性识别BCMA抗原的CAR,能够精准靶向并清除患者体内BCMA阳性的细胞,从而实现治疗效果。

与传统CAR-T细胞基因治疗药物相比,SYS6020具备高细胞活力、高CAR阳性率、无基因整合导致的肿瘤风险,以及较低的细胞因子风暴等优点。临床前研究表明,该产品能够有效杀伤BCMA抗原阳性的骨髓瘤细胞,表现出良好的安全性和有效性。
E.N.D

往期文章推荐:
CDE发布《细胞治疗产品临床药理学研究技术指导原则(试行)》
荣泽集团完成数千万元战略融资,推进细胞与基因治疗等创新药开发
突破AAV载荷限制,《Science》发表关于StitchR™ RNA组装技术及治疗肌营养不良症应用的研究
基因编辑安全性再引关注:腺嘌呤碱基编辑器引发小鼠胚胎和人类T细胞脱靶结构变异
总投资约30亿元,建筑面积10万平米,国内一细胞治疗药物研发与生产基地正式开工




































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论