
转载自 医脉通
前言
静脉系统侵犯是局部晚期肾细胞癌(RCC)的临床特点之一,对于局限性肾癌癌栓患者,肾根治性切除联合癌栓取出术是首选的治疗方式。然而,即便采用开放手术,在切除癌栓及重建下腔静脉的过程中,仍可能出现大出血、肺栓塞等严重并发症。有研究表明,肾癌伴静脉癌栓患者围手术期死亡率为5%-15%1,且癌栓分级越高,围手术期并发症风险越高。因此,术前进行新辅助治疗以降低癌栓高度和分级,对于减少围手术期风险具有重要意义。中国人民解放军总医院张旭院士、马鑫教授及顾良友教授团队牵头开展的特瑞普利单抗联合阿昔替尼新辅助治疗肾癌伴下腔静脉癌栓的NEOTAX研究入选2024年ESMO年会,以壁报形式公布成果2。值此契机,特邀该研究第一作者顾良友教授分享肾癌靶免联合治疗的前沿进展,并探讨本次NEOTAX研究结果对局部进展期肾癌治疗格局的影响。

术前降低下腔静脉癌栓(IVC-TT)分级可减少RCC的手术并发症发生率和死亡率。RENOTORCH研究是一项Ⅲ期临床试验,评估了特瑞普利单抗联合阿昔替尼对比舒尼替尼治疗转移性RCC的疗效,研究结果显示特瑞普利单抗联合阿昔替尼治疗组与舒尼替尼单药治疗组无进展生存期(PFS)分别为18.0个月和9.8个月。相比于舒尼替尼单药治疗,特瑞普利单抗联合阿昔替尼联合治疗显著降低了35%的疾病进展或死亡风险(HR 0.65,95% CI 0.49-0.86;P=0.0028),其中联合用药组客观缓解率为56.7%,舒尼替尼组为30.8%。本项Ⅱ期研究(NEOTAX)评估了特瑞普利单抗联合阿昔替尼新辅助治疗RCC伴IVC-TT患者的疗效和安全性(ChiCTR2000030405)。
共纳入29例肾透明细胞癌(ccRCC)伴Ⅱ-Ⅳ级IVC-TT(cT3b/c)、cN0/1、cM0/1、拟行根治性肾切除术联合下腔静脉癌栓取出术的患者。特瑞普利单抗的推荐剂量为240mg每3周一次,持续4个周期。阿昔替尼剂量为5mg,每日两次(图1)。主要研究终点为IVC-TT降级率。次要研究终点包括手术策略和癌栓高度变化百分比、缓解率、手术并发症发生率、PFS、安全性以及生物标志物分析。此次数据分析截止日期为2024年2月1日。

图1 研究设计
2020年3月至2023年10月,共纳入29例患者,其中25例接受研究治疗并纳入分析。患者的中位年龄为58岁(IQR:51.5-67.5岁),大多数为男性(n=19,76.0%)。10例(40.0%)患者伴有淋巴结转移,5例(25.0%)患者伴有远处转移。分别有9例(36.0%)、7例(28.0%)、9例(36.0%)患者的癌栓Mayo分级为Ⅱ、Ⅲ、Ⅳ级(表1)。
表1 患者基线特征

治疗12周后,44.0%(11/25)的患者癌栓降级(2例患者由Ⅳ级降至Ⅲ级,1例由Ⅳ级降至Ⅱ级,1例由Ⅳ级降至Ⅰ级,5例由Ⅲ级降至Ⅱ级,2例由Ⅱ级降至Ⅰ级)(图2A)。24/25(96.0%)的患者癌栓高度有不同程度的减少(范围:5-79%),癌栓高度变化的中位数为-2.3cm(范围:-7.1至1.1cm)(图2B)。
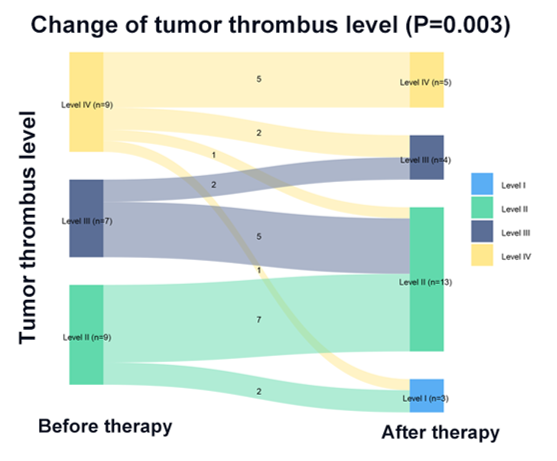
图2A 癌栓降级情况

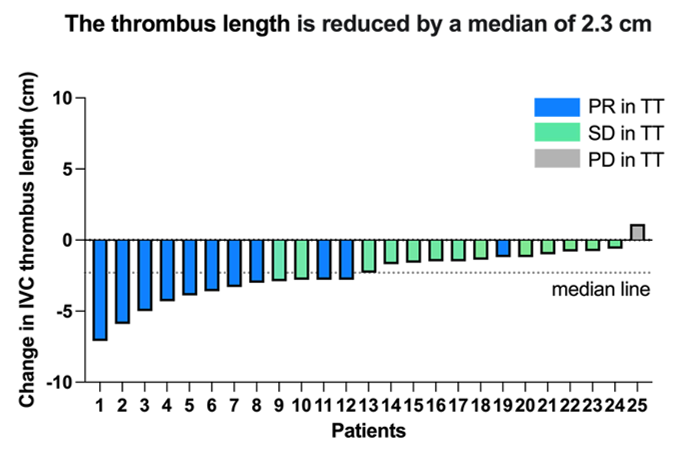
图2B 癌栓高度变化
61.9%(13/21)的患者改变了手术策略。术后并发症发生率为57.1%(12/21)(表2)。
表2 围术期结果

9例(36.0%)患者出现肿瘤进展,其中7例在术后进展(图2C)。1年和2年PFS率分别为89.1%(95% CI:62.7-97.2)和54.8%(95% CI:27.5-75.6)(图2D)。
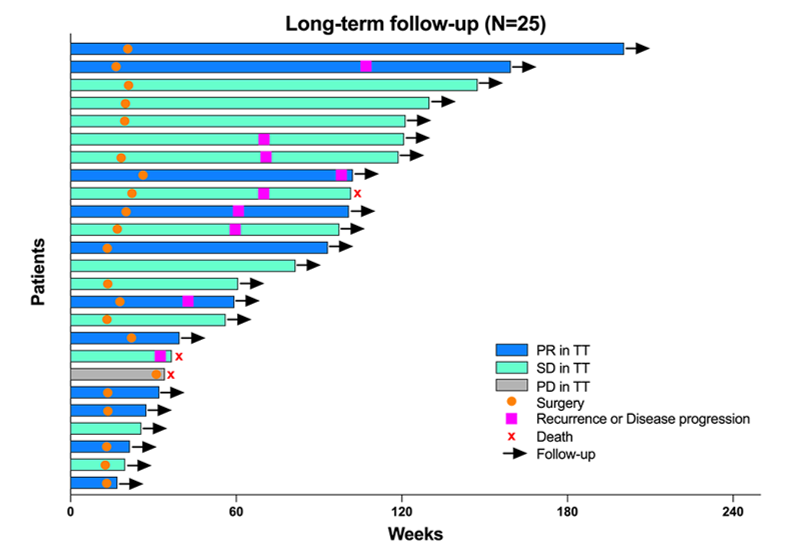
图2C

 图2D
图2D
所有(100.0%)患者均发生与治疗相关的不良事件(TRAEs),且大多为1级或2级。7例(28.0%)患者发生3级TRAEs,主要为高血压(8.0%)和蛋白尿(8.0%)。
无应答者的活检样本显示细胞毒性T浸润增加,但这些细胞主要为PD-1阳性。应答者的活检样本中辅助T细胞减少,然而调节性T细胞亚型保持不变。在癌栓的手术样本中,无应答者CD8T_01_GZMK_CXCR4亚群T细胞增加。
NEOTAX II期研究首次为特瑞普利单抗联合阿昔替尼可使相当一部分患者的IVC-TT降级从而缩小手术范围的疗效结果提供了研究证据。
目前研究进展顺利,总体而言,特瑞普利单抗联合阿昔替尼作为肾癌伴静脉癌栓患者的新辅助治疗,展现了卓越的疗效和良好的安全性,为患者带来显著的获益。
- 顾良友教授 -
中国人民解放军总医院泌尿外科医学部副主任医师、副教授、硕士生导师
中华医学会泌尿外科分会临床研究办公室秘书
北京医学会泌尿外科分会基础与转化医学学组委员
入选2023年北京市科技新星计划
主持国家自然科学基金2项、院自主创新项目1项,作为课题骨干参与国家重点研发计划项目、首都卫生发展科研专项重点项目等
以第一/通讯作者于Innovation、Eur Urol、Cancer Treat Rev、J Urol、BJUI等发表论文33篇
研究成果多次入选ESMO、EAU、SIU、UAA等国际会议
《BMC Urology》、《Frontiers in Oncology》编委,《Cancer Letters》、《Surgery》等审稿人
获中华医学科技奖一等奖1项,解放军总医院医疗成果一等奖、科技进步二等奖各1项
肾癌的药物治疗模式经历了多个时代的变迁,如今已进入到靶免联合时代,国际上已经发展出多种药物组合方案。作为NEOTAX研究牵头人之一,请您谈一谈选择特瑞普利单抗联合阿昔替尼方案出于哪些考量?
在晚期肾癌治疗方面,组合方案众多,其中程序性死亡受体1(PD-1)抑制剂联合阿昔替尼在国内晚期肾癌治疗中应用较为广泛,被视为一种常规治疗方案。对于有癌栓的局部晚期肾癌患者而言,目前临床指南中仍无标准的新辅助治疗方案,缺乏强有力的证据支持,主要依赖经验性治疗。然而,有癌栓的患者接受围术期治疗,存在获益的可能性。如果能够减少癌栓,则可缩小手术区域,降低手术难度,基于这一考虑,我们尝试了靶免联合治疗。
特瑞普利单抗作为中国自研的PD-1药物,在前期真实世界应用中展现出了良好的疗效。NEOTAX研究继续立足于中国人群,因此我们在治疗方案中选择特瑞普利单抗,以期获得与国际先进PD-1抑制剂相当疗效的同时进一步降低患者经济负担。特瑞普利单抗联合阿昔替尼是我国首个获批用于晚期RCC一线治疗的靶免联合方案,我们希望可以发挥“1+1>2”的作用,探索该方案是否有望前移至局部进展期,以便为更广泛的患者群体提供多样化的治疗选择,同时也为医生提供更多有效的治疗“武器”。
局部进展期RCC尚无标准围术期治疗方案,因此,本次ESMO大会上公布的NEOTAX研究结果倍受关注。请您与大家分享一下,在该研究中患者接受特瑞普利单抗联合阿昔替尼新辅助治疗后围术期结局和整体预后情况如何?
目前初步评估了新辅助治疗后的围术期结果,共纳入29例患者,由于4例患者存在病理类型问题,最终入组25例患者,其中21例患者接受肾癌合并下腔静脉癌栓取出术。研究结果显示,接受特瑞普利单抗联合阿昔替尼新辅助方案治疗12周后,61.9%的患者简化了手术方案,所有患者均成功完成手术。与既往报道相比,中位手术时间、失血量、输血量以及术后并发症均有明显改善。总体而言,围术期的结果令人满意。
整体预后需要更长时间的随访,从目前的初步数据来看,中位PFS为25.3个月(95% CI:17.0-NE)。1年PFS率为89.1%(95% CI:62.7-97.2),结果非常理想,许多患者的病情在这一年内得到了有效控制。2年PFS率为54.8%(95% CI:27.5-75.6),虽然部分患者出现疾病进展,但这可能与患者初始即为M1,以及Ⅲ、Ⅳ级癌栓患者的预后较差有关。我们将进一步分析与未接受药物治疗的患者相比,围术期与预后的结果,并在后续研究中报道。
特瑞普利单抗联合阿昔替尼开创了我国晚期肾癌一线靶免联合时代,如今在局部进展期肾癌的新辅助阶段再传捷报。请您结合临床经验谈一谈,NEOTAX研究取得阳性结果对于局部进展期RCC的诊疗具有何种临床意义,您对该方案有哪些期待?
在肾癌的围术期治疗中,新辅助治疗的经验相对有限。然而,在其他类型的癌症中,新辅助治疗已成为标准方案。对于局部进展期肾癌,药物治疗的需求一直存在,但是否进行术前新辅助治疗,一直是临床实践中的困惑点。NEOTAX是国内首个以降癌栓为目标的特瑞普利单抗联合阿昔替尼用于局部进展期且具有高风险癌栓肾癌患者的新辅助治疗Ⅱ期研究。初步结果显示,术前特瑞普利单抗联合阿昔替尼新辅助治疗,能显著降低癌栓等级,减少手术难度,提高手术成功率,为此类患者带来围术期的明显获益。不过,总生存期(OS)和PFS结果仍需进一步随访。期待未来随着新辅助病例的累积和更高级别证据的出现,这种联合治疗方案成为局部进展期肾癌患者的标准方案,这将为我们在临床实践中的应用提供更强的信心和支持。
靶向治疗的出现改变了肾癌治疗模式,靶向血管内皮生长因子受体的酪氨酸激酶抑制剂(TKI)与免疫治疗联合使用已被广泛认可,为晚期肾癌治疗开启了新篇章。特瑞普利单抗联合阿昔替尼的获批,填补了我国晚期肾癌一线靶免联合的空白,为临床医生提供了新的有力武器。NEOTAX研究进一步揭示了特瑞普利单抗联合阿昔替尼作为肾透明细胞癌伴下腔静脉癌栓新辅助治疗的卓越疗效和安全性。研究显示,该联合方案能减少癌栓高度,降低癌栓等级,从而为手术创造更为有利的条件,降低手术难度,提高手术成功率。这一发现有望推动该治疗方案在临床应用中前移,改善局部进展期肾癌患者的治疗结果和生活质量,为这类患者的治疗带来新的曙光。
参考文献:
Liangyou Gu, et al. Neoadjuvant therapy in renal cell carcinoma with tumor thrombus: A systematic review and meta-analysis. Crit Rev Oncol Hematol. 2024 Apr:196:104316.
Liangyou Gu, et al. NEOTAX: A Phase II trial of neoadjuvant toripalimab plus axitinib for clear cell renal cell carcinoma with inferior vena cava tumor thrombus. ESMO 2024. 1701P.


声明
 觉得有用,请“分享 点赞 在看”一连三键
觉得有用,请“分享 点赞 在看”一连三键






































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论