 关注小药说药,一起成长!
关注小药说药,一起成长!抗血管生成药物,通常是靶向VEGF–VEGFR途径的抗体或酪氨酸激酶抑制剂,是目前临床证明可提高免疫检查点抑制剂(ICIs)疗效的少数组合之一。这种临床益处已在不同癌症类型的关键III期试验中得到证明,然而,许多III期临床试验也出现了阴性结果。
使用抗血管生成药物联合ICIs的基本原理主要依赖于阻断VEGF的多种免疫抑制作用,并诱导几种不同的血管调节作用,这些作用可以刺激免疫,例如血管正常化导致肿瘤内血液灌注和流量增加,以及抑制内皮细胞对T细胞的促凋亡作用等。相反,VEGF阻断也会导致抑制抗肿瘤免疫的变化,如肿瘤缺氧增加,以及ICIs肿瘤内进入减少。因此,抗血管生成与ICI组合的净临床益处将由VEGF信号传导的拮抗作用及其对抗肿瘤免疫反应的抑制之间的平衡来决定。
抗血管生成与ICI联合的基本原理
乍一看,将一种肿瘤血管生成抑制剂的药物与ICI联合似乎违反常理。如果抗血管生成药物减少了肿瘤血管形成,从而减少了整个肿瘤血管的灌注,人们可能会预期产生至少两种不利的功能结果:(1)肿瘤缺氧水平增加;和(2)肿瘤内药物分布受损,从而降低ICI的肿瘤内浓度和生物分布。然而,抑制VEGF–VEGFR轴同时也具有许多有利的作用,原则上可以增强ICIs的疗效。因此,如果抗血管生成剂对ICIs的有利和不利作用同时或依次起作用,联合治疗的最终治疗结果将取决于给定治疗情况下这两种作用之间的净平衡。
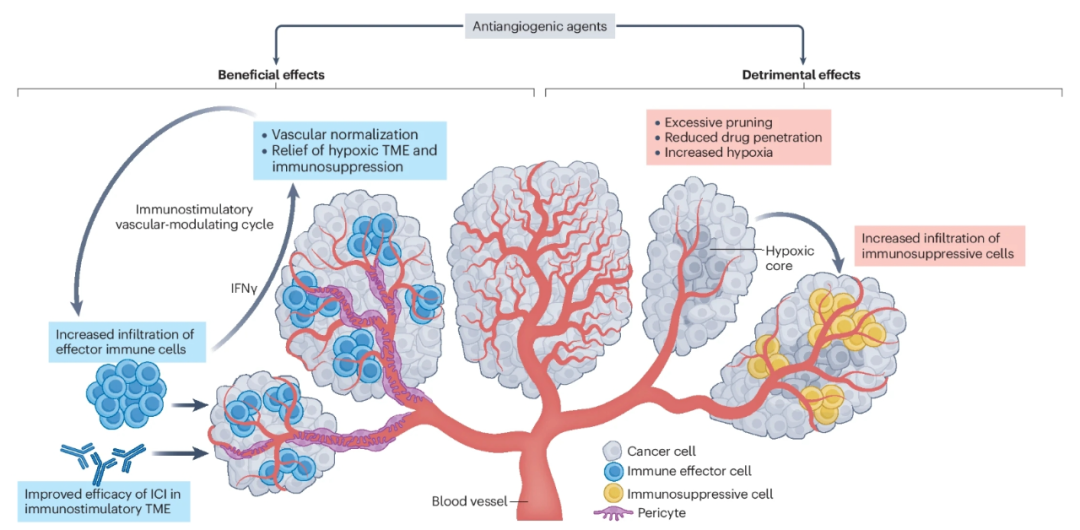
肿瘤的血管正常化
血管生成性肿瘤血管系统与非恶性组织血管系统的区别在于其异常曲折的结构,这可能会损害肿瘤内灌注,导致更缺氧和酸性的肿瘤微环境(TME)。这种异常的肿瘤血管系统往往具有高血管通透性,导致渗漏增加。此外,癌细胞及其细胞外基质对血管的压迫以及不良的淋巴引流系统导致血流量减少,这可能会阻碍免疫细胞的进入和药物积累。
这些有害影响可以通过抗血管生成药物诱导的血管正常化来预防甚至逆转。血管正常化通过类似于血管回归和修剪的机制发挥作用,从而去除非功能性血管。通过增加血液灌注和减少血管渗漏,血管正常化可以降低肿瘤缺氧水平,并增加药物暴露。
抑制VEGF的免疫抑制功能
VEGF蛋白家族包括三个成员:VEGFA、VEGFB和VEGFC。VEGFA是这三种生长因子中最活跃的促血管生成因子。VEGF具有免疫抑制功能,包括可以抑制T细胞的功能,增加调节性T细胞(Treg)和髓源性抑制细胞(MDSCs)的募集,抑制树突状细胞(DC)的分化和激活。抑制VEGF可以有效抑制肿瘤生长。
抗血管生成对ICI的不利作用
抗血管生成药物与肿瘤缺氧
肿瘤缺氧是对抗癌疗法产生耐药性的最有力和最常见的因素之一。虽然抗血管生成药物最初的短期治疗可能导致灌注不良的异常血管正常化,从而减少肿瘤缺氧;然而,以批准的剂量长期给药的抗血管生成药物对肿瘤血管系统的过度修剪可能导致肿瘤灌注不足,从而增加肿瘤缺氧。因此,在常规临床实践中以批准剂量进行慢性治疗的情况下,当与ICIs联合使用时,这种缺氧促进作用可能会限制ICI的潜在益处。
药物的生物分布减少
抗血管生成剂是否增强或削弱联合给药的抗PD-1/PD-L1抗体对肿瘤的生物分布是一个尚未评估的重要问题。考虑到血管正常化假说,抗血管生成药物应该会增加ICI的生物分布。然而,出乎意料的是,几项评估不同分子靶向抗体与抗血管生成药物在小鼠肿瘤内积聚的研究一致显示抗体积聚减少。
所有这些研究都发现靶向抗体的肿瘤内浓度降低了约40%,一些研究发现生物分布发生了变化。虽然这些临床前研究的有一个局限性是,分析主要局限于皮下移植的原发性肿瘤;既没有评估原发性原位肿瘤,也没有评估远处转移。然而,综合起来,他们的结果提出了一种可能性,即抗血管生成剂与抗PD-1/PD-L1抗体联合给药可能会导致ICI的显著减少和肿瘤内分布改变,这可能在一定程度上抵消其潜在的抗肿瘤功效。
非血管生成性肿瘤的概念是指肿瘤可以通过多种机制规避新生血管生成,包括血管生成模拟(癌细胞可以形成灌注血液的血管样结构)、重塑(血管分裂成两个血管的过程),或与各种器官中现有的丰富血管系统共存。
一个明显的问题是,血管选择在肿瘤中的作用是否会降低抗血管生成药物诱导的免疫刺激性血管调节作用的发生率和程度,从而降低临床相关性。如果治疗的肿瘤是非血管生成的,那么抗血管生成药物促进抗肿瘤免疫的能力可能非常弱,甚至不存在。现有证据表明,非血管生成性血管选择性肿瘤在患者中可能非常常见,在对来自乳腺癌、CRC或RCC患者的肺转移的分析中,>70%的乳腺或结直肠癌转移被认为是完全或主要是非血管性的。即使是肾细胞癌患者,非血管生成性肺转移的发生率也令人惊讶,约为30%。
总之,非血管生成肿瘤与血管生成肿瘤的比例,尤其是转移瘤,可能是一个被忽视和不被重视的因素,有助于解释接受抗血管生成与ICI联合治疗的患者之间的结果差异。
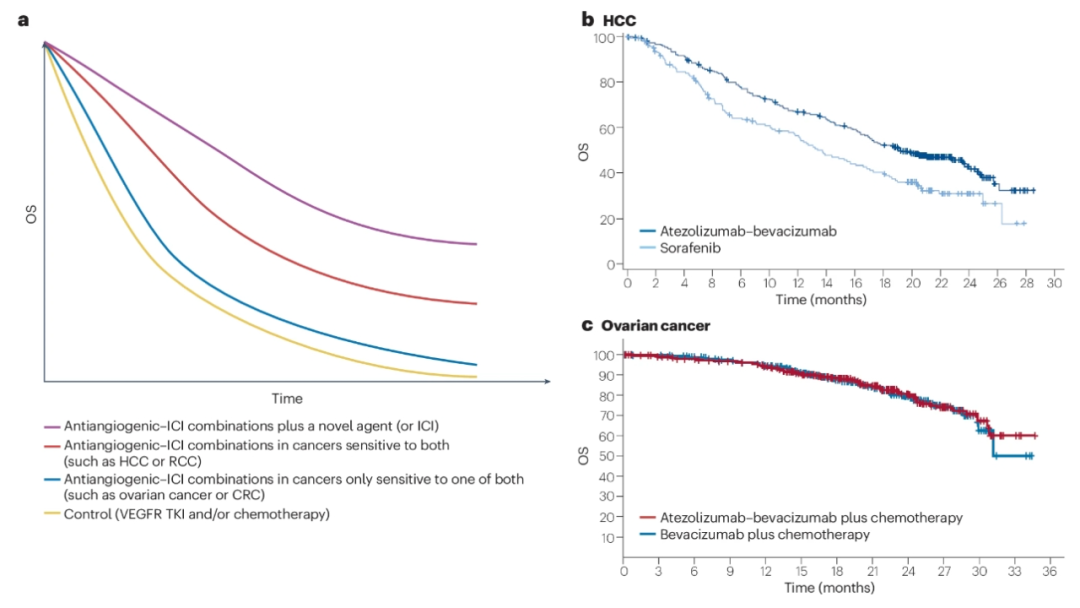
在过去的十年里,许多关键的临床试验测试了不同的抗血管生成药物与ICI组合。在晚期肾细胞癌的一线治疗中观察到了最大的成功,pembrolizumab联合axitinib对比 sunitinib(KEYNOTE-426试验)、pembrolizhumab联合lenvatinib对比 sunitinib(CLEAR试验)以及nivolumab联合cabozantinib对比 sunitinib(CheckMate 9ER试验)。这些试验达到了延长PFS和/或OS的主要终点。此外,另外两项III期试验比较了抗血管生成与ICI联对比索拉非尼作为HCC一线治疗的疗效,结果均为阳性。
然而,除了这些成功的试验外,更多测试抗血管生成ICI组合作为转移性疾病一线治疗的III期试验未能显示OS益处,如JAVELINRenal 101(肾细胞癌的avelumab联合axitinib对比 sunitinib )、COSMIC-312(HCC的atezolizumab联合cabozantinib对比sorafenib)、LEAP-002(肝细胞癌的pembrolizumab联合lenvatinib对比lenvatinib)、IMagyn050(卵巢癌的atezolizamab联合贝伐单抗加化疗对比贝伐单抗加化疗)等。
以上这些令人失望的结果突显了一个事实,即在早期和较小的II期研究中观察到的有希望的ORR通常不会转化为后续关键的较大随机对照III期试验中的显著PFS或OS改善。几个可能的因素导致了这些失败。
对单一疗法的敏感性
抗血管生成药物和ICI的内在敏感性在不同的癌症类型中是异质性的。根据III期试验的可用结果,可以推测,不同癌症类型的患者对抗血管生成药物或ICI敏感性不同,一些不太可能从这些药物的联合治疗中获益。
药物协同作用
血管正常化理论为在ICIs中添加抗血管生成药物的有益效果提供了潜在的理论基础;然而,在许多试验中,这些组合的预期协同作用显然没有发生。事实上,在大多数此类试验中,获得相加效应可能更接近现实。
根据II/III期试验的可用结果,联合治疗的ORR往往与单一治疗的每种药物的ORR之和相似。例如,接受单剂VEGFR TKIs的RCC患者的ORR通常约为30%,而接受单剂ICIs的患者的ORRs也约为30%;因此,接受两种联合治疗的患者的ORR约为60%。在一些涉及肾细胞癌患者的临床试验中注意到的另一个现象(如COSMIC-312或JAVELIN Renal 101)是,这些试验显示出对PFS的益处,但对OS没有益处。这些情况提醒我们,在ICIs中添加抗血管生成药物并不总能提高治愈患者的比例,这可能只会产生相加效应。
对二线ICI治疗的耐药性
在过去几年中,在接受ICIs治疗后疾病进展的患者中进行了几项抗血管生成与ICI联合的大型随机III期试验(如LEAP-003、LEAP-017、CONTACT-01、SAPPHIRE148和LEAP-008),具有令人失望的初步结果。这些结果提醒我们,在对ICIs耐药性的复杂机制没有明确了解的情况下,测试此类组合的潜在风险。毕竟,VEGF相关的免疫抑制可能只是肿瘤逃避免疫监测的众多机制之一。
靶向肿瘤缺氧
抗血管生成药物可导致缺氧升高,从而激活HIF1α或HIF2α及其下游信号通路。靶向HIF介导通路的药物可与抗血管生成药物联合使用。其中,belzutifan是第一种口服HIF2α抑制剂,在涉及ICI难治性转移性透明细胞RCC患者的试验中,该药物显示出令人印象深刻的单药疗效,随后开展与cabozantinib或lenvatinib的联合应用。在一项II期试验中,接受belzutifan+cabozantinib治疗的患者ORR为30.8%,疾病控制率为92.3%,中位PFS为13.8个月。在同一疾病环境中的另一项I/II期试验中,24名接受belzutifan+lenvatinib治疗的可评估患者的ORR为50%,临床获益率为54%,中位PFS为11.2个月。将低氧靶向药物与一线抗血管生成与ICI联合可能是某些类型癌症,特别是肾细胞癌的一种很有前途的选择。
确定可靠的预测性生物标志物
使用可靠的生物标志物来选择最有可能对抗癌疗法有反应的患者,是一种持续未满足的医疗需求。如果叠加效应解释了大多数抗血管生成与ICI联合试验的积极结果,那么为每种单独的药物(以及组合)采用可靠的预测生物标志物将是改善患者选择的可行方法。
优化组合药物:抗体与TKIs
与抗血管生成抗体相比,转移性RCC患者对抗血管生成TKIs的反应率往往更高;相比之下,HCC患者的反应模式则相反。因此,关键的一步是根据每种癌症类型独特TME内的治疗相互作用概况,选择最佳的抗血管生成药物作为ICI的组合药物。此外,同样的考虑也适用于选择ICI作为抗血管生成药物的最佳组合。一个例子是RCC患者中抗PD-1抗体相对于抗PD-L1抗体的具有更好的反应。此外,还需要更多的研究来调查患者在单剂治疗后是否会产生抗药物抗体,这可能会影响随后接受涉及相同药物的组合时的结果。
利用免疫刺激血管调节周期
在过去几年中,几项研究表明,不仅抗血管生成药物,而且ICIs单药都可能诱导肿瘤血管正常化。在癌症小鼠模型中,ICIs激活T辅助细胞1(TH1),其分泌IFN-γ,随后诱导周细胞募集和血管正常化。ICIs还通过增加周细胞覆盖的微血管密度来改善血液灌注,从而缓解肿瘤内缺氧,这些作用又进一步促进免疫细胞的浸润。这些研究的结果支持免疫刺激性血管调节循环的存在。这一概念可能解释了为什么对这两种治疗类别都敏感的肿瘤可以从这种组合中获得最大的临床益处,这将导致这种循环的诱导。
克服ICI耐药性
对于越来越多的癌症类型,ICIs作为一线治疗方案的重要组成部分逐渐被采用,这突出表明需要重点预防或克服对这一治疗类别的耐药性。我们可以从晚期非小细胞肺癌患者的试验中吸取重要教训,其中ICIs是一线治疗方案的关键组成部分。随机II期Lung MAP S1800A试验证明,与标准护理相比,接受抗VEGFR2抗体ramucirumab加pembrolizumab治疗的ICI难治性NSCLC患者具有OS获益。然而,三项III期试验在ICI难治性NSCLC患者中测试了抗血管生成与ICI的组合(CONTACT-01、SAPPHIRE148和LEAP-008),不幸的是,与标准护理的二线治疗相比,所有试验都未能显示出优越的PFS或OS。因此,在一线环境中具有良好活性的方案在ICI难治人群中可能没有那么有效。
引起深刻而持久的反应
在不同癌症类型的患者中,反应深度与PFS和OS的改善相关。从免疫肿瘤学的角度来看,具有高反应深度的患者(一些研究表明,治疗期间肿瘤大小的最大收缩率>40%)可能有较小的残余肿瘤,与体积较大的肿瘤相比,其血液灌注更好。由此产生的缺氧减少的TME可能具有较少的免疫抑制作用,并为持久的“免疫平衡”期提供了更大的机会,在此期间,免疫机制使肿瘤细胞保持功能休眠状态而不会生长。因此,尝试在短暂的血管正常化窗口期间提高反应深度可能是提高抗血管生成与ICI联合疗效的可行选择。
此外,与接受抗血管生成与ICI联合治疗的患者相比,接受双ICI联合治疗的患者具有持久反应的比例更高。不过值得注意的是,在接受双ICI组合的患者中,毒性发生率更高。一般来说,在抗血管生成药物加单一ICI的临床试验中,这种组合的严重(≥3级)免疫相关不良反应的发生率并不显著高于ICI单一疗法;然而,在接受联合用药的患者中,这两类药物通常会出现一些不良反应。
许多涉及不同癌症类型患者的关键III期试验表明,ICIs与血管生成抑制剂的组合提高了ORR和存活率,包括OS。然而,这种联合疗法在其他III期试验中的失败也广泛存在。这些差异提醒我们需要提高对这些结果差异的基础认知和理解。
因此,从这个角度来看,需要强调了几个因素,以供未来考虑,以提高这类联合治疗的临床前景。这些方面包括:
(1)需要更深入地了解抗血管生成药物对接受ICIs的患者可能产生的一些负面影响,例如后一种药物的生物分布减少和/或肿瘤缺氧水平增加的可能性,以及确定预防或改善这些负面影响的方法;
(2)作为单一疗法,对任何一种药物的临床反应性的重要性;
(3)这些组合在由其它血管形成过程驱动的非血管生成肿瘤患者中的结果;
(4) 需要更好地了解口服TKIs和基于抗体的抗血管生成药物与ICIs联合使用之间的差异;(5)其他因素,如抗血管生成药物的剂量、治疗持续时间和给药间隔,以及通过激活Tie2等方法改善血管正常化在肿瘤中的应用;
(6)需要反映转移性疾病而不仅仅是原发性肿瘤的临床前模型;
(7)要考虑到抗血管生成与ICI组合的最佳治疗益处可能是通过免疫刺激血管调节周期对抗肿瘤免疫的抑制和激活作用之间净平衡的结果。
参考文献:
1.Antiangiogenic-immune-checkpoint inhibitor combinations: lessons from phase III clinical trials. Nat Rev Clin Oncol. 2024 Apr 10.
公众号内回复“肿瘤免疫”或扫描下方图片中的二维码免费下载《小药说药肿瘤免疫全集》的PDF格式电子书!

公众号已建立“小药说药专业交流群”微信行业交流群以及读者交流群,扫描下方小编二维码加入,入行业群请主动告知姓名、工作单位和职务。





































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论