
原发性肝癌(以下简称肝癌)是全球最常见的恶性肿瘤之一。2022年中国新增肝癌病例数达36.8万,高居我国恶性肿瘤发病例数第4位,占全球病例的42.4%;死亡病例数为31.7万,位居我国恶性肿瘤死亡病例数第2位,占全球病例的41.7%1。由于起病隐匿,大多数患者确诊时往往已是中晚期,5年生存率仅约12%2。按照病理类型,肝癌可主要分为肝细胞癌(HCC)、肝内胆管癌(ICC)及混合型肝癌,其中HCC约占90%3。近年来,随着靶向和免疫治疗在肝癌领域取得一系列突破性进展,肝癌治疗进入了“免疫+”时代。对于不可切除晚期HCC和ICC患者,以免疫检查点抑制剂(ICIs)为基础的联合疗法均已成为一线治疗的重要策略。此外,如何优化转化治疗策略、提高转化降期率以获得根治也在同步进行探索中。对于可切除HCC患者的围术期治疗,特别是针对高复发风险患者的长期控制策略,也亟需更有效的治疗手段和策略。各疾病亚型及不同阶段的未满足的临床需求为肝癌治疗领域提出了更高要求。本文对君实生物创新药在肝癌领域的探索和关键临床研发布局,以及取得的突破性成果进行了梳理汇总,快来一览。
面对中国肝癌治疗领域的巨大未满足需求,君实生物以特瑞普利单抗为基石,在肝癌领域发起了一系列创新临床研究,涵盖从晚期到围手术期等多个阶段,探索不同组合方案及新型治疗策略,以期为肝癌患者提供更优治疗选择。其中,针对不可切除晚期HCC患者一线治疗的III期HEPATORCH研究结果日前已重磅发布,基于该研究结果,国家药品监督管理局(NMPA)已于2024年7月正式受理了特瑞普利单抗联合贝伐珠单抗(即:TB方案)用于不可切除或转移性HCC患者一线治疗的新适应症上市申请,有望为更多肝癌患者带来治疗新选择。

图1. 君实生物肝癌治疗领域研发布局
数据来源:药物临床试验登记与信息公示平台
HCC
► HEPATORCH:“TB方案”用于不可切除/转移性HCC一线治疗显著延长患者PFS和OS
以ICIs为基础的联合方案的出现显著改变了晚期HCC治疗格局,为患者带来全新的治疗选择。特瑞普利单抗联合贝伐珠单抗对比索拉非尼用于晚期HCC一线治疗的III期HEPATORCH研究(NCT04723004)数据在2024年中国临床肿瘤学会(CSCO)学术年会-创新论坛上全球首次公布(点击查看详情)4,结果显示,与索拉非尼单药治疗相比,特瑞普利单抗“TB方案”可显著延长患者无进展生存期(PFS)和总生存期(OS),中位PFS达5.8个月(vs. 对照组4.0个月),疾病进展或死亡风险降低31%(HR=0.69,95% CI:0.525-0.913;P=0.0086)(图2A);中位OS达20.0个月(vs. 对照组14.5个月),死亡风险降低24%(HR=0.76,95% CI:0.579-0.987;P=0.0394)(图2B);此外,特瑞普利单抗联合贝伐珠单抗组客观缓解率(ORR)较索拉非尼组显著提高4倍,ORR达25.3% (vs. 对照组6.1%),且安全性良好。
HEPATORCH研究阳性结果充分支持TB方案作为晚期HCC一线治疗的新选择,同时获2024年《中国临床肿瘤学会(CSCO)原发性肝癌诊疗指南》推荐 (II级1A类证据) 5,进一步推动靶免联合治疗方案在HCC领域中的应用,为提升我国晚期HCC患者的生存率和生活质量带来新的希望。

图2A. PFS分析(IRC根据RECIST v1.1标准评估)

图2B. OS分析
► 多种免靶联合策略探索:特瑞普利单抗联合小分子酪氨酸激酶抑制剂(TKI)用于不可切除HCC一线治疗显潜力
特瑞普利单抗联合安罗替尼:一项多中心、单臂II期研究ALTER-H-003(ChiCTR1900028295)纳入了31例既往未接受过系统治疗的晚期HCC患者,评估特瑞普利单抗联合安罗替尼一线治疗的疗效和安全性6。结果显示该联合方案具有令人欣喜的疗效:根据RECIST v1.1标准评估的ORR为29.0%(32.3%,根据mRECIST标准评估),疾病控制率(DCR)达77.4%,中位PFS为11.0个月(图3A),中位OS达18.2个月(图3B)。此外,该联合治疗的安全性也良好,故值得开展进一步研究。

图3 (A)PFS分析(B)OS分析
特瑞普利单抗联合索拉非尼:一项单臂、开放、II期前瞻性临床研究(NCT04926532)评估了特瑞普利单抗联合索拉非尼作为不可切除HCC一线治疗的安全性和疗效7。28例患者接受该组合疗法治疗,结果显示,ORR为35.7%,DCR为71.4%,其中3例患者(10.7%)实现完全缓解(CR),中位PFS为4.8个月,中位OS尚未达到。值得一提的是,6例(21.4%)患者在治疗后实现了肿瘤降期并成功手术。整体安全性良好,3级治疗相关不良事件(TRAE)发生率为39.3%。
► 多维度综合治疗策略探索:特瑞普利单抗联合TKI±局部治疗/系统化疗用于不可切除HCC一线治疗
立体定向放疗(SBRT)后进行靶免联合治疗:相关研究表明SBRT与免疫疗法联用具有潜在协同增效作用。一项前瞻性、单臂、探索性临床研究(ChiCTR2000032533)纳入20例中晚期不可切除HCC患者,经SBRT后接受特瑞普利单抗联合安罗替尼治疗6周期后,ORR为15.0%,DCR为50.0%。中位随访时间为7.2个月,中位PFS为7.4个月8。18个月和24个月的总生存率分别为61.1%和50.9%。该研究结果提示,通过SBRT暴露HCC特异性抗原增强了免靶联合治疗的疗效,且不良反应可控。
肝动脉灌注化疗(HAIC)联合免疫靶向的三联方案:高肿瘤负荷通常与晚期HCC的全身治疗预后不良相关,因此将局部治疗与系统治疗相结合,有可能显著改善高肿瘤负荷患者的生存率。LTHAIC研究是一项单臂、II期临床研究(NCT04044313),评估了仑伐替尼、特瑞普利单抗联合HAIC(使用FOLFOX方案)一线治疗高危晚期HCC的疗效和安全性9。研究纳入了36例患者,结果显示,6个月PFS为80.6%,中位PFS为10.4个月(图4A),中位OS达17.9个月(图4B)。根据RECIST v1.1标准评估ORR为63.9%(66.7%,根据mRECIST标准评估),中位缓解持续时间达14.4个月。该研究结果有望为具有高风险特征的晚期HCC患者带来更多获益。
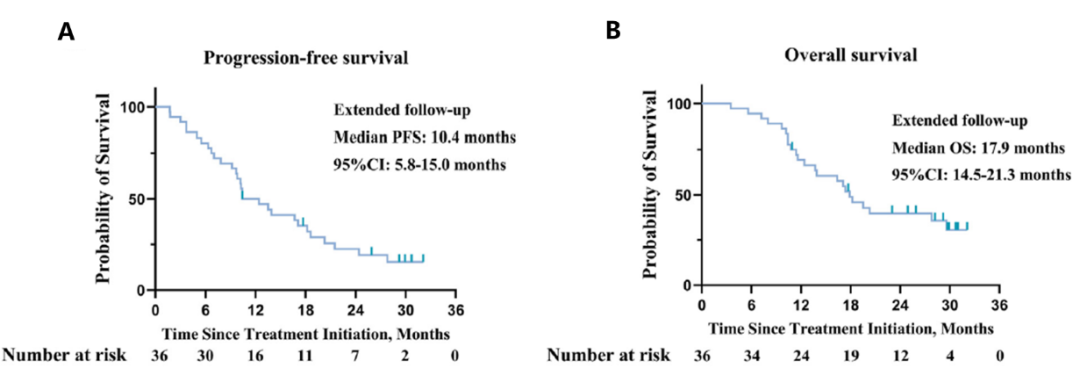
图4 (A)PFS分析(B)OS分析
系统化疗联合免疫靶向的三联疗法:一项特瑞普利单抗联合仑伐替尼和FOLFOX化疗的三联方案用于伴肝外转移的晚期HCC一线治疗的探索性II期LTSC研究(NCT04170179)结果显示(点击查看详情),该三联疗法可显著改善患者预后且安全性可控,主要终点6个月PFS率为66.7%,中位PFS达9.73个月(图5A),中位OS达14.63个月(图5B),根据RECIST v1.1和mRECIST标准评估ORR分别为43.3%和56.7%。研究中80%患者表现出高危特征,这些患者中位PFS和OS分别达8.3个月和13.7个月10。
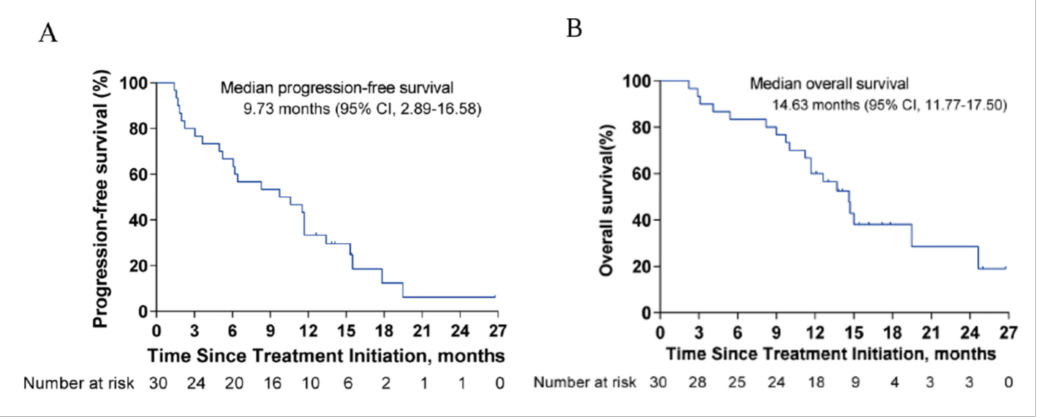
图5 (A)PFS分析(B)OS分析
联合局部治疗:一项在既往治疗失败的不可切除HCC患者中开展的多中心、随机、二阶段的I/II期临床研究结果显示(点击查看详情),在局部消融后第3天开始联合特瑞普利单抗治疗较免疫单药治疗明显提高ORR,生存期显著延长,实现了33.8%的ORR,中位PFS达7.1个月(HR=0.57,P<0.001),中位OS达18.4个月(HR=0.58,P=0.005)11。
双免联合治疗:在特瑞普利单抗的联合治疗探索中,一项Ib期研究(NCT05149027)评估了抗CTLA-4单抗Porustobart(HBM4003)联合特瑞普利单抗用于晚期HCC患者的疗效和安全性12。研究结果显示,在抗PD-(L)1初治患者中,Porustobart联合特瑞普利单抗治疗显示出极具潜力的抗肿瘤活性且安全性可接受,ORR为46.7%,DCR为73.3%,值得进一步确证该双免组合疗法的临床价值。
术前新辅+术后辅助治疗:一项随机、对照、Ib/II期临床研究(NCT03867370)纳入18例可切除HCC患者,术前接受特瑞普利单抗单药或特瑞普利单抗联合仑伐替尼新辅助治疗,术后达到R0切除的患者再随机接受特瑞普利单抗单药或特瑞普利单抗联合仑伐替尼辅助治疗13。结果显示,18例患者中16例患者接受了手术,未出现因治疗延迟或取消手术的情况。术后病理结果显示1例患者无可见肿瘤,3例(20%)达到主要病理缓解(MPR)。该研究表明,特瑞普利单抗单药或联合仑伐替尼用于可切除HCC术前新辅助治疗具有良好的抗肿瘤活性。
术后辅助治疗:一项特瑞普利单抗联合多纳非尼用于HCC高复发风险患者辅助治疗的开放、单臂、前瞻性临床研究(NCT04418401)结果显示,特瑞普利单抗联合多纳非尼辅助治疗伴高危复发因素的HCC患者,1年无复发生存(RFS)率为89.7%,有效减少患者复发14。值得一提的是,君实生物发起的特瑞普利单抗单药用于局部晚期HCC患者术后辅助治疗的关键III期JUPITER-04研究(NCT03859128/ CTR20182326),在接受根治术后的局部晚期肝细胞癌患者中评估了特瑞普利单抗与安慰剂相比作为术后辅助治疗的疗效和安全性(图6)15。该研究已顺利完成全部受试者入组,正在持续随访中。这一研究有望进一步开拓免疫治疗在中国HCC患者术后辅助治疗中的应用,期待该研究数据早日读出,为高复发风险患者提供更有效的长期控制策略。
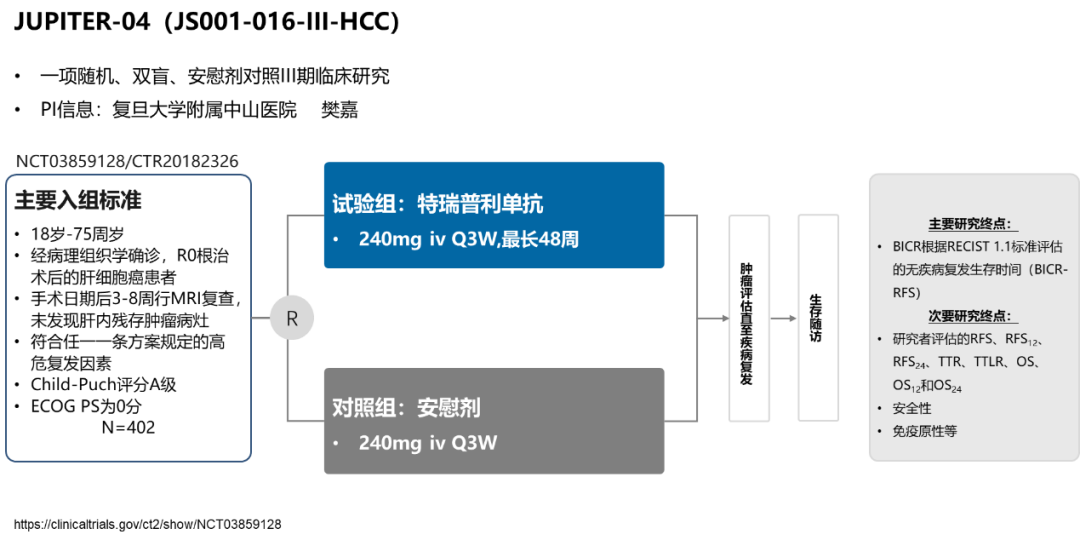
图6. JUPITER-04研究设计
ICC

图7. JS001-039-III-ICC研究设计
与君共行,同赴未来。通过不断探索和优化,君实生物旨在构建从晚期一线到围术期治疗的全程疾病管理策略,以期为全球肝癌患者带来治疗新选择,推动肝癌整体治疗标准的进一步提升。


声明
 觉得有用,请“分享 点赞 在看”一连三键
觉得有用,请“分享 点赞 在看”一连三键




































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论