
近年来,抗体类药物(如单抗、双抗、ADC等)发展迅速,在多个疾病研究领域均有重磅产品陆续上市,抗体药物研发受到越来越多的关注。美迪西在抗体药物的一站式研发服务方案制定中与客户深入交流,将每一个案例的特点与多年实战经验和技术积累相结合,谨慎地将优质实验方案与结果交到客户手上。美迪西可以提供抗体全流程服务,包括:药物发现、CMC研究服务、符合GLP规范的综合性临床前研究服务(药效学研究、药代动力学评价和安全性评价等),以合规、高效、高质的服务助力客户产品顺利获批等。
美迪西抗体药物研发服务平台建立至今已积累了众多国内外知名医药企业及科研机构客户,已成功助力济民可信、百奥泰、石药集团等药企的抗体项目获批临床,并达成多年的持续合作,获得客户持续的信任和好评。截至2024年4月底,美迪西已成功助力34个抗体(包括单抗、双抗和三抗)获批临床,其中6个抗体药物FDA/NMPA同时获批,3个抗体药物NMPA/TGA同时获批,1个抗体药物获得美国FDA、中国NMPA、澳洲TGA三国批准,另外有多个抗体项目在研。
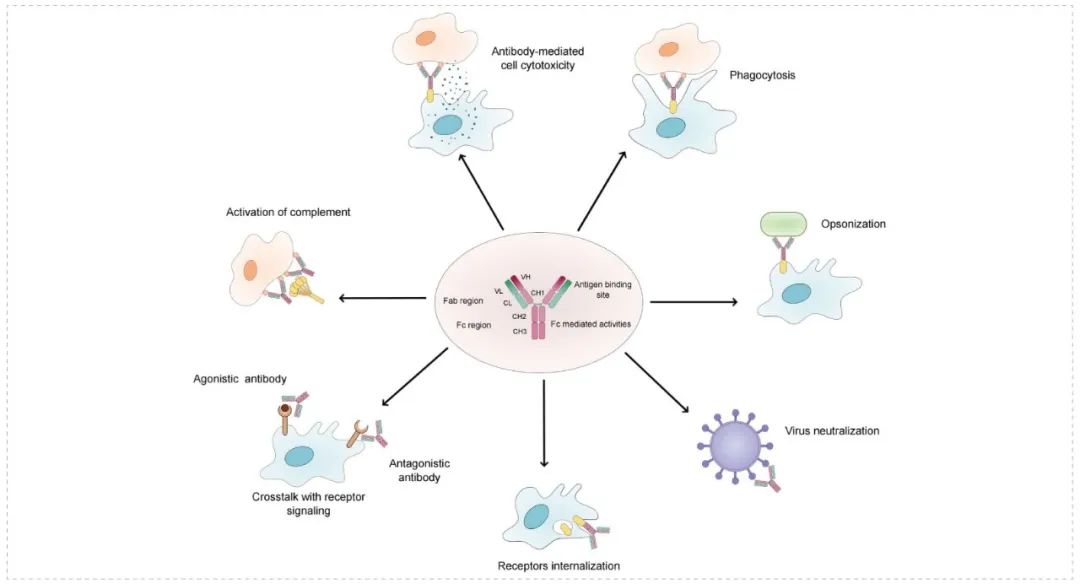 Overview of the natural function of antibodies[1]
Overview of the natural function of antibodies[1]
抗体药物开发
针对某个特定靶点开发创新性抗体药或抗体相关药物的研发流程中,筛选出合适的候选抗体是其中非常重要的一个环节。目前常见的抗体发现方法包括杂交瘤技术、噬菌体展示技术、单B细胞抗体筛选技术等。
杂交瘤抗体制备
 Production route of hybridoma technology[2]
Production route of hybridoma technology[2]
纳米抗体制备
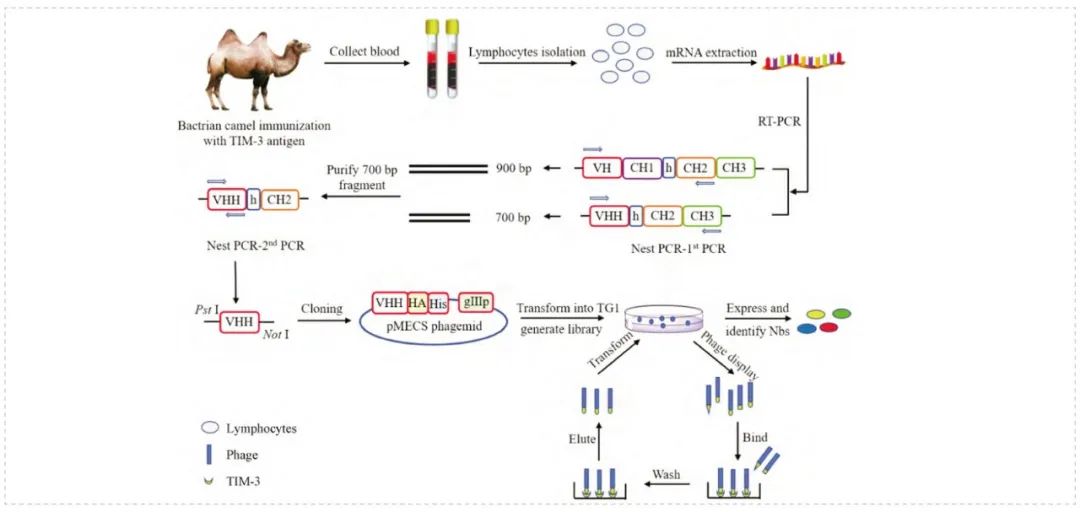 Nanobody production scheme[3]
Nanobody production scheme[3]
单B细胞抗体制备
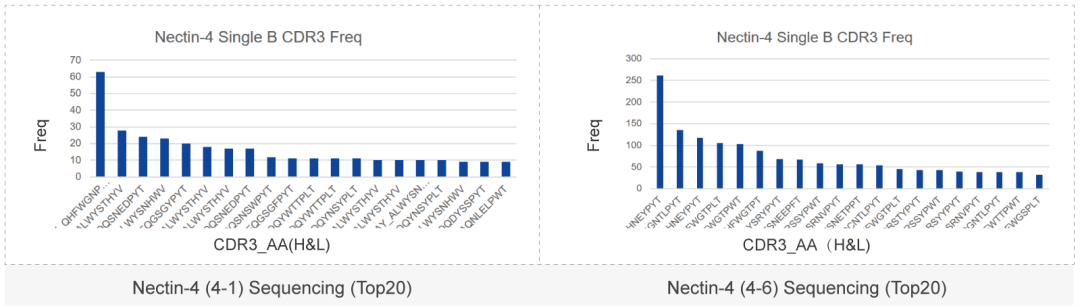
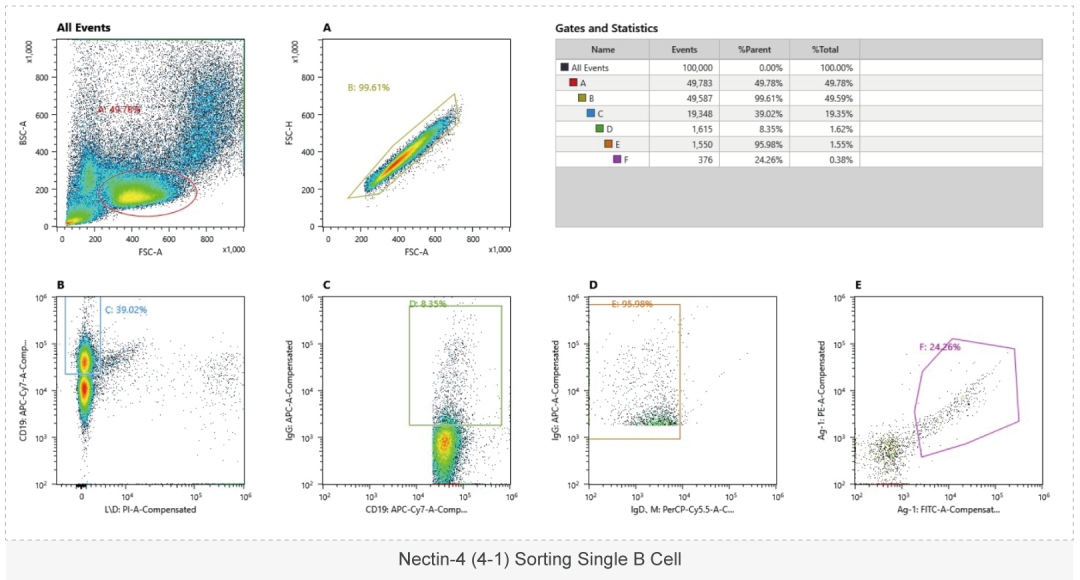
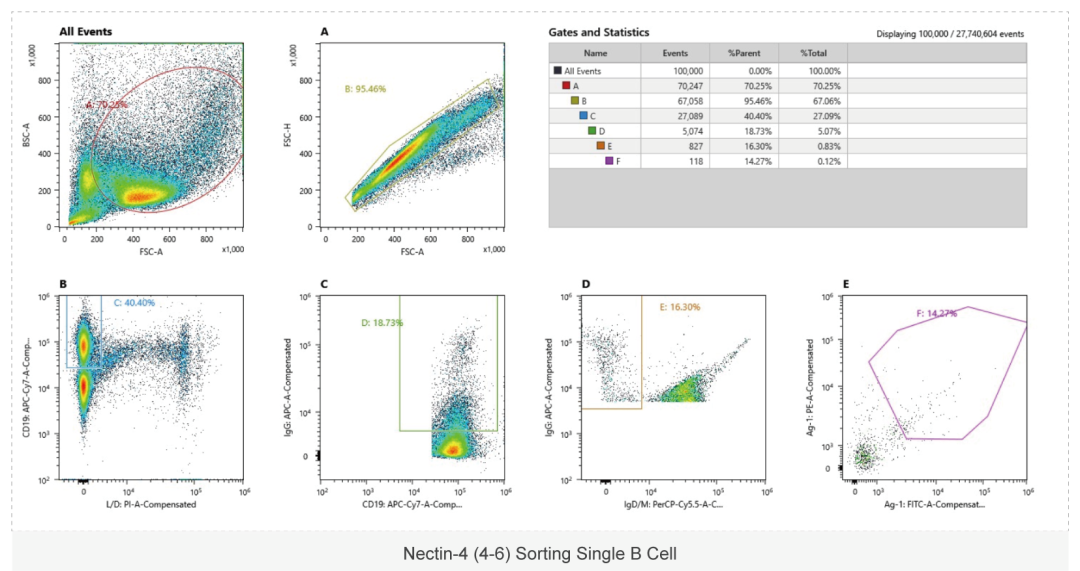
 单B细胞抗体制备流程
单B细胞抗体制备流程
抗药物抗体制备
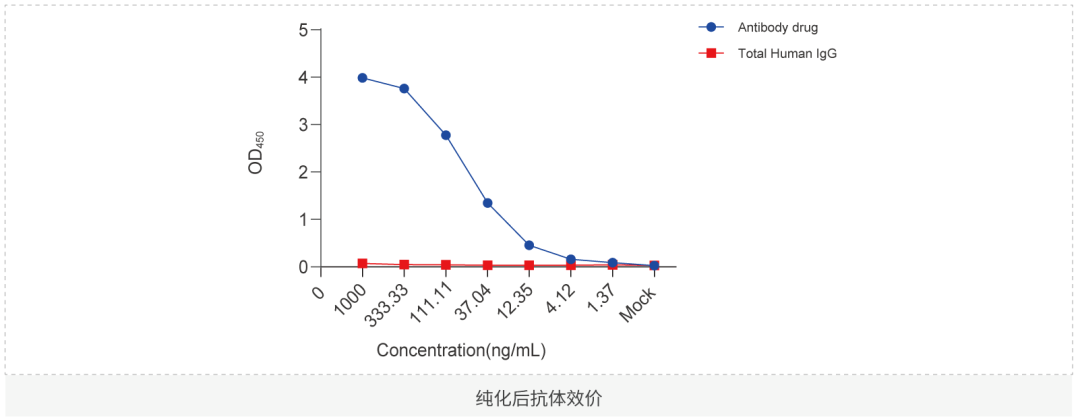
抗体药物体外研究
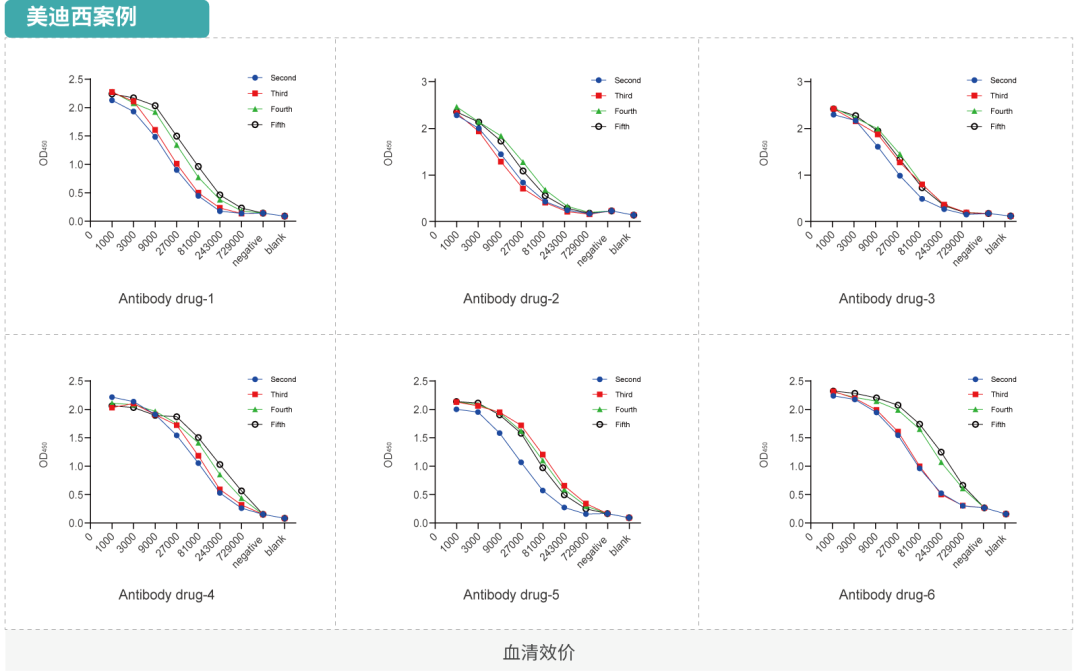
抗体类药物的活性测定是指对药物的有效成分、含量及药物效价进行测定,在药物研发及质量控制中至关重要,是探索药物作用机制(MOA),提供药物IND申报依据的重要手段。抗体药物在与其特定靶点结合后,通过激活或阻断细胞因子等信号传导、补体系统活化及细胞杀伤等生物学作用发挥治疗效果。随着药物高通量筛选平台的不断建立与生产规模的不断放大,基于细胞系的体外分析方法,例如依据药物作用机制构建的报告基因细胞株更是因灵敏度高,检测周期短,重复性好且操作简单而被广泛应用于新药开发的过程中。体外药理药效分析需要根据抗体特点,靶点特性来设计相应实验,分析方法主要包括基于流式、细胞成像的细胞分析;基于ELISA,Luminex等可溶性蛋白的分析。
结合实验(FACS, ELISA, SPR)

已验证的靶点:PD-1, PD-L1, VEGF, Nectin1, Nectin2, Nectin3, Nectin4, NECL1, NECL2, NECL3, NECL4, NECL5, EPHA1, EPHA2,EPHA3, EPHA4, EPHA5, INSR, IGF-1R, HSA, FcRN, FcRI, FcRII, FcRIII, C1q, Factor B, HER2, Transferrin, EPCR, STAT3, STAT5,STAT1, 4-1BB, SHP2, ATIII, EGFR, gp1等。
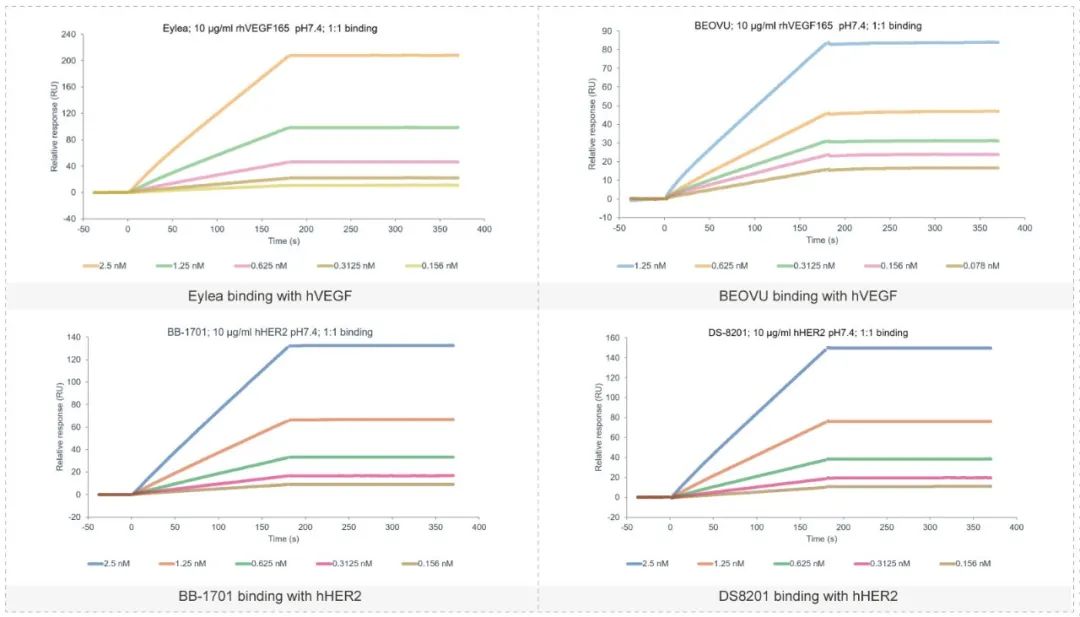
抗体的功能性实验
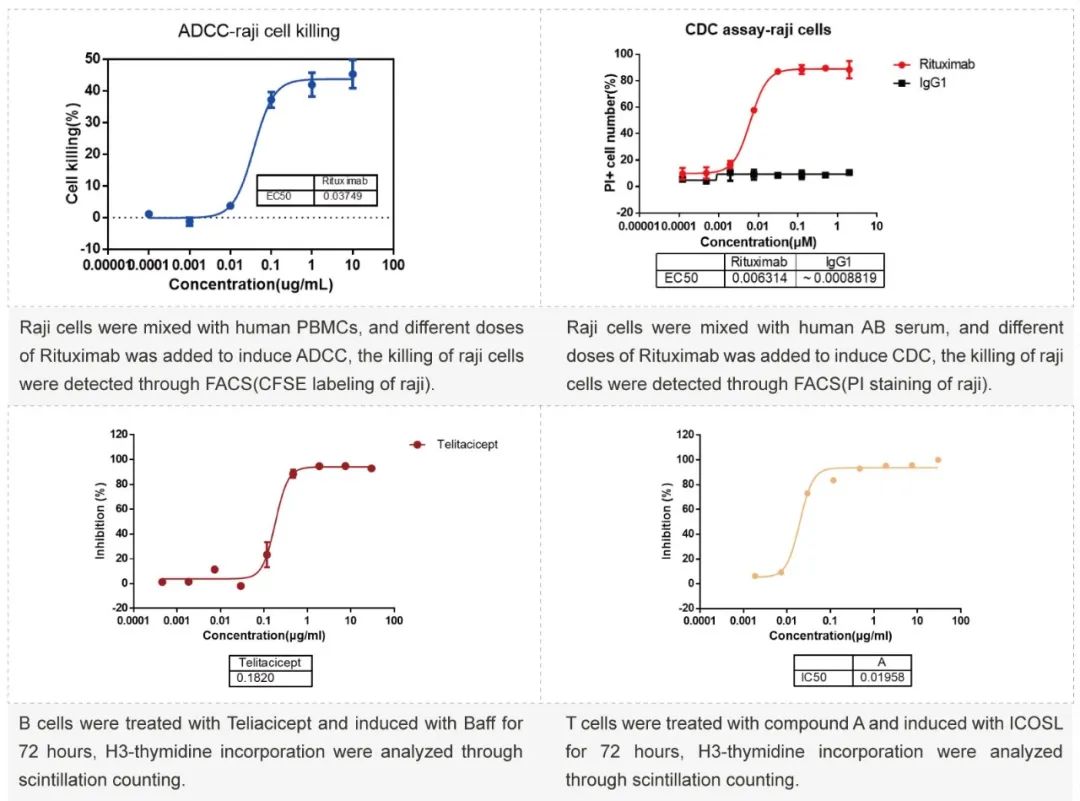
细胞因子释放实验
❖使用抗体A/IgG1和抗CD3/LPS处理人PBMC细胞25小时(液相或固相),通过Luminex试剂盒分析TNFα水平。
❖按照ICH指导原则测定细胞因子释放,其中必须测试的因子有IL-2、IL-6、IL-10、IFN-γ和TNF-α。使用受试抗体处理PBMC细胞,至少测试3种。受试抗体的呈现形式包括固相和液相。ELISA、Luminex、CBA和 MSD 方法可用于检测细胞因子。OKT3用作阳性对照。
❖该测定的目的是评估潜在的抗体诱导细胞因子释放效应,以防止临床试验中发生强细胞因子释放风暴。

抗体药物的CMC研究
美迪西可提供抗体药物工艺开发和制剂研发服务。在确保研发质量的基础上,美迪西团队通过严谨的试验方案设计(DOE)、专业化的研发技术、标准化的项目管理、规范化的试验操作、高效的多方沟通,持续助力客户的抗体药物研发!
美迪西案例:LQ036
2022年2月,洛启生物LQ036——重组抗IL-4Rα单域抗体雾化液(毕赤酵母)的IND正式获得CDE批准。LQ036是一款针对中重度哮喘治疗的吸入式纳米抗体药物。在LQ036的研发过程中,美迪西依托其吸入制剂研发平台,参考国内外吸入制剂的指导原则并结合各国申报要求,为LQ036制定专门的吸入制剂吸入特性指标研究方案,协助LQ036顺利完成了中国NMPA和澳洲TGA申报材料的准备,并成功获批。
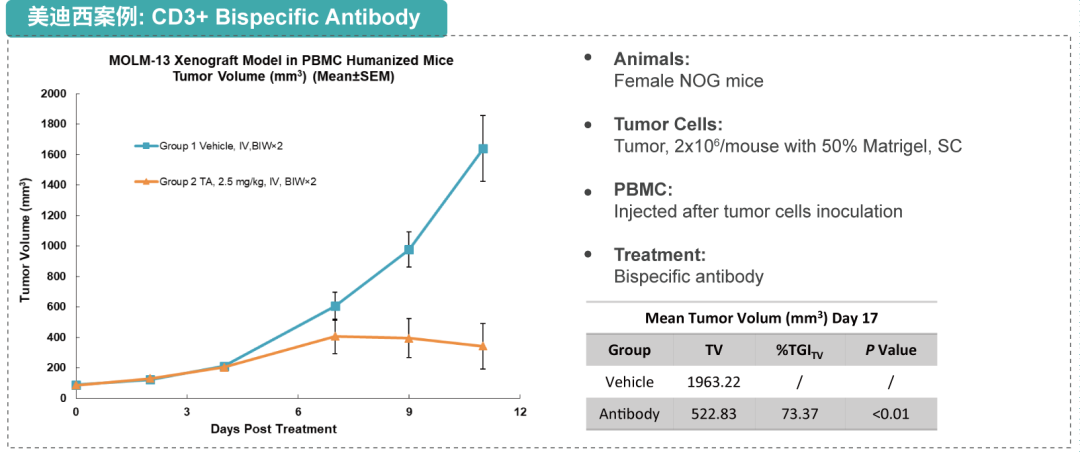
抗体药物药效学评价
抗体的动物体内药效试验是抗体药物研究中一项重要的药理参数,直接反映了抗体的功效并影响临床试验设计。美迪西致力于为客户提供成熟的评估抗体体内药效的肿瘤模型,在AAALAC认证的环境下完成模型动物的建模和饲养,并以GLP-like的高标准完成相关药效学评价试验。美迪西多年来深耕动物领域,为药物研发提供合适的动物模型,可提供多种用于评估抗体药物的肿瘤模型及非肿瘤模型,在AAALAC认证的环境下完成模型动物的建模和饲养,并以GLP-like的高标准完成相关药效学评价试验。
多种实验动物:
❖啮齿类:小鼠/大鼠、兔子
❖非啮齿类:比格犬、小型猪、非人灵长类动物

抗体药物药代动力学评价
美迪西在抗体药物体内分析中可提供多种测检测方法,通过分析动物体内采集的血浆/血清样本,为客户提供可靠优质的PK数据。
美迪西案例: YYB-101
在四只雄性食蟹猴中单次静脉注射 YYB-101(剂量为10 mg/kg) 后,研究其药代动力学特征。血清Tmax为2 h,Cmax为221.57 μg/mL,AUC(0–∞)为94 802.96 μg/mL*h。t1/2Z约为 21.7 天,清除率为 0.11 mL/kg/h。这项实验是通过美迪西进行的。
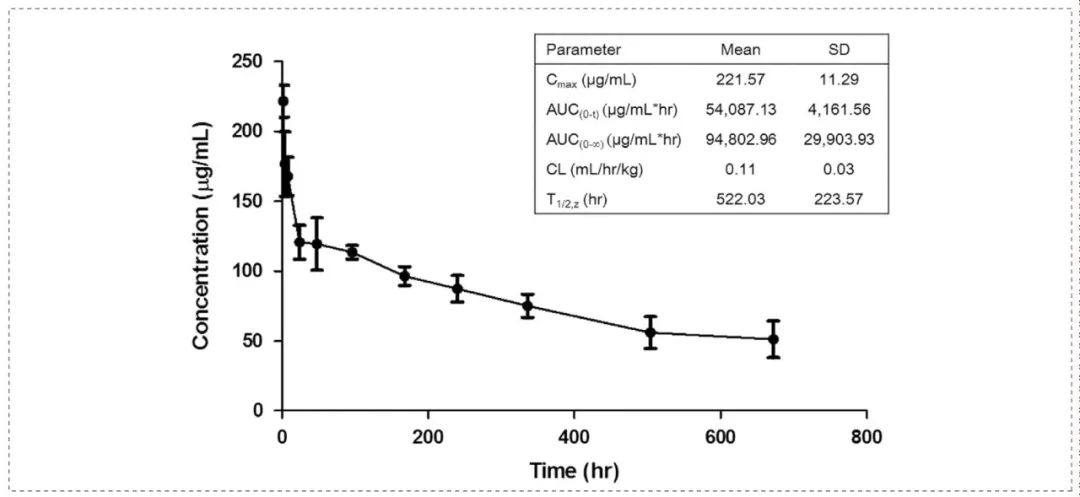
抗药物抗体(ADA)测定
在每天服用YYB-101(剂量为 50mg/kg ) 的第一天,在一只雌性猴子中检测到抗药物抗体,但在第 29 或 85 天从该动物收集的样本中未检测到抗药物抗体。仅在 1 只动物中检测到抗药物抗体。单一时间点,几乎没有观察到与正常组织的交叉反应。这项研究通过美迪西进行。基于这些结果,一项针对晚期实体瘤患者的 I 期临床研究正在进行中 (NCT02499224)。
抗体药物安全性评价
美迪西毒理研究部遵循ICH指导原则S6和S9,结合每一个项目的具体情况定制个性化的安全性评价方案,提供符合NMPA、FDA、OECD、TGA等国际GLP标准的安全性评价服务,包括:
❖单次和重复给药毒性试验(伴随毒代动力学研究)
❖安全药理(包括组织交叉反应)
❖免疫原性检测
美迪西案例: YYB-101
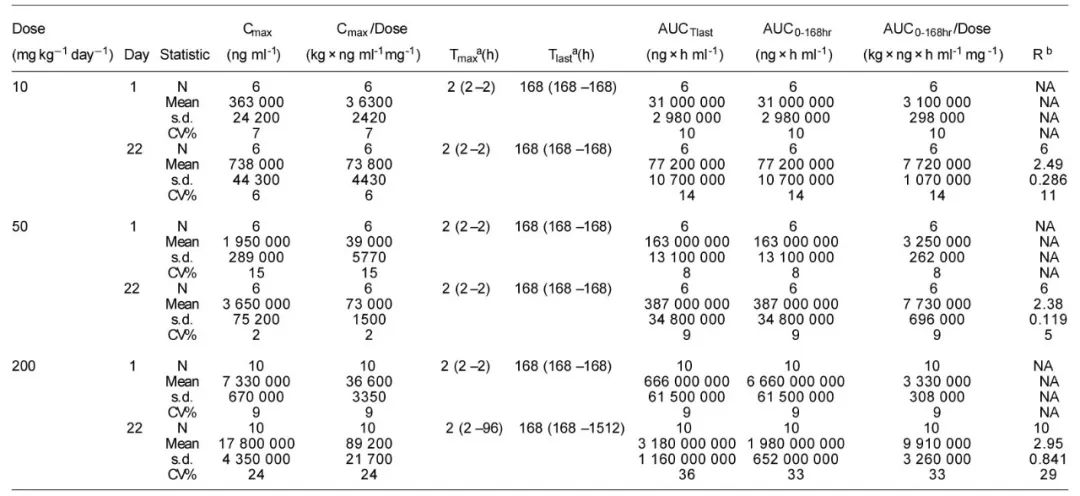
静脉注射YYB-101后,YYB-101的平均全身暴露量(AUC0-168h)和Cmax值随剂量成比例增加。 在每周输注 YYB-101 四次后,YYB-101 的平均血清峰浓度和谷浓度趋于稳态。最后一次给药后 63 天,康复动物的血清浓度可量化(第 22 天起约为 Cmax的 2.8%)。重复静脉注射YYB-101后,全身暴露量(AUC0-168h)增加,累积率为2.38至2.95。这项研究通过美迪西进行的。
美迪西部分助力抗体项目案例
BAT6021和BAT6005
2021年9月,百奥泰BAT6021注射液和BAT6005注射液创新药接连获批临床,在肿瘤治疗领域取得新进展。BAT6021和BAT6005是百奥泰开发的抗TIGIT单克隆抗体,用于肿瘤治疗。作为长期合作伙伴,美迪西先后为百奥泰创新药BAT6021、BAT6005提供(包括药代和安全性评价在内的)综合性临床前研究服务,为百奥泰新药项目的临床获批助力。
BAT7104
2021年10月,百奥泰PD-L1/CD47双抗BAT7104注射液获临床试验默示许可,本次获批的适应症为晚期恶性肿瘤。BAT7104是靶向PD-L1/CD47的双特异性抗体药物,旨在抑制PD-1/PD-L1和CD47/SIRP-α途径。美迪西作为百奥泰长期合作伙伴,有幸在BAT7104注射液的研发中与百奥泰合作,在GLP的实验室环境和操作规范下,完成了BAT7104注射液的(包括药代动力学和安全性评价在内的)综合性临床前研究服务,为BAT7104注射液高效、高质的获批临床提供了专业保障。
JYB1904
2022年5月,济民可信旗下子公司江苏济烨生物制药有限公司lgE抗体药物JYB1904注射液获批临床。JYB1904是一款新型抗IgE重组人源化单克隆抗体靶向治疗药物。JYB1904注射液具有优良的临床治疗潜力,可为中重度哮喘等过敏性疾病的临床治疗提供潜在的新方案。美迪西为该药提供了符合GLP规范的(包括药代和安全性评价在内的)综合性临床前研究服务,在攻坚克难中赋能JYB1904项目成功获批。
CC312
2022年6月,惠和生物首个靶向CD19/CD3/CD28三特异性抗体CC312的IND申请获得FDA默示许可,这是国内首个、全球第三个基于CD28 共刺激信号进入临床研发阶段的三特异性抗体,CC312在针对血液瘤的临床前研究中表现出显著的药效学作用及良好的安全性。在本次获批中,美迪西为CC312提供了符合GLP规范的(包括药代和安全性评价在内的)综合性临床前研究服务,以合规、高效、高质的服务助力其顺利获批。
BAT2022
2022年6月, 百奥泰注射用BAT2022获得临床试验批准。注射用BAT2022是百奥泰自主研发的双特异性中和抗体,拟用于治疗由于新冠病毒及其突变株感染引起的新冠肺炎。在注射用BAT2022的临床前研发中,美迪西依托丰富的项目经验和扎实的专业基础,在极短时间内向百奥泰呈递了完整的试验方案。最终在GLP的实验室环境和操作规范下,完成了注射用BAT2022的安全性评价研究服务,以合规、高效、高质的服务助力其成功获批临床,为注射用BAT2022的快速获批临床提供了专业保障。
GT90008
2022年10月,开拓药业PD-L1/TGF-β双靶点抗体(GT90008)获批临床。GT90008是一款PD-L1/TGF-β双靶点抗体,可以同时抑制PD-L1和TGF-βR2的高度活性,具有成为同类最佳药物的潜力。在GT90008的研发中,美迪西依托蛋白质/抗体药代动力学研究平台和生物技术药物非人灵长类安全评价技术服务平台,提供了符合GLP规范的(包括药代和安全性评价在内的)和药代的综合性临床前研究服务,整个项目的研发进展顺利且高效。
HCW9218
2022年10月,HCW Biologics Inc.融合蛋白复合物HCW9218获FDA批准进行癌症治疗试验。HCW9218是一种异源二聚体、双功能融合蛋白复合物,包含TGF-β受体II的细胞外结构域和IL-15/IL-15受体α复合物,能有效激活和增殖NK细胞和CD8+ T细胞,增强细胞对肿瘤靶标的细胞毒性,优化化疗的疗效并减少化疗副作用。美迪西作为HCW的合作伙伴,在GLP 的实验室环境和操作规范下,建立了适用于HCW9218的分析方法,提供了临床前药代和安评研究,全力促成该项目的高质高效完成。此外,美迪西临床前药理及毒理研究团队依托在软件、技术、规范、素质等各方面全面成熟的SEND数据转换平台,助力HCW9218成功申报FDA,推动其进入临床试验阶段。
NB002
2023年7月,逻晟生物NB002顺利通过FDA审查并同意开展Ⅰ期临床试验。NB002是一款靶向TIM-3独特表位的单克隆治疗抗体,具有显著的单药抗肿瘤的治疗效果,其不仅显著激活T和NK细胞的活性,增强其对抗肿瘤的能力,更重要的是NB002重建了肿瘤环境中被抑制的天然免疫,恢复DC细胞反应能力,提高髓系细胞抗原递呈功能,整体性解除TIM-3调控的从天然免疫到获得免疫的抑制性作用,有效地增强肿瘤免疫杀伤能力。美迪西作为逻晟生物的合作伙伴,为NB002提供了安全性评价、药代动力学等临床前研究服务,助力其IND申请顺利获FDA临床许可。
参考文献
直播预告

关于美迪西

美迪西(股票代码:688202.SH)成立于2004年,总部位于上海,致力于为全球制药企业、研究机构及科研工作者提供全方位的临床前新药研究服务。美迪西的一站式综合服务以强有力的项目管理和更高效、高性价比的研发服务助力客户加速新药研发进程,服务涵盖医药临床前新药研究的全过程,包括药物发现、药学研究及临床前研究。至2024年6月底,美迪西已为全球超2000家客户提供药物研发服务,参与研发完成的新药及仿制药项目已有490件IND获批临床,与国内外优质客户共同成长。美迪西将继续立足全球视野,聚力中国创新,为人类健康贡献力量!







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论