1.5.1 本周全球TOP10创新药研发进展
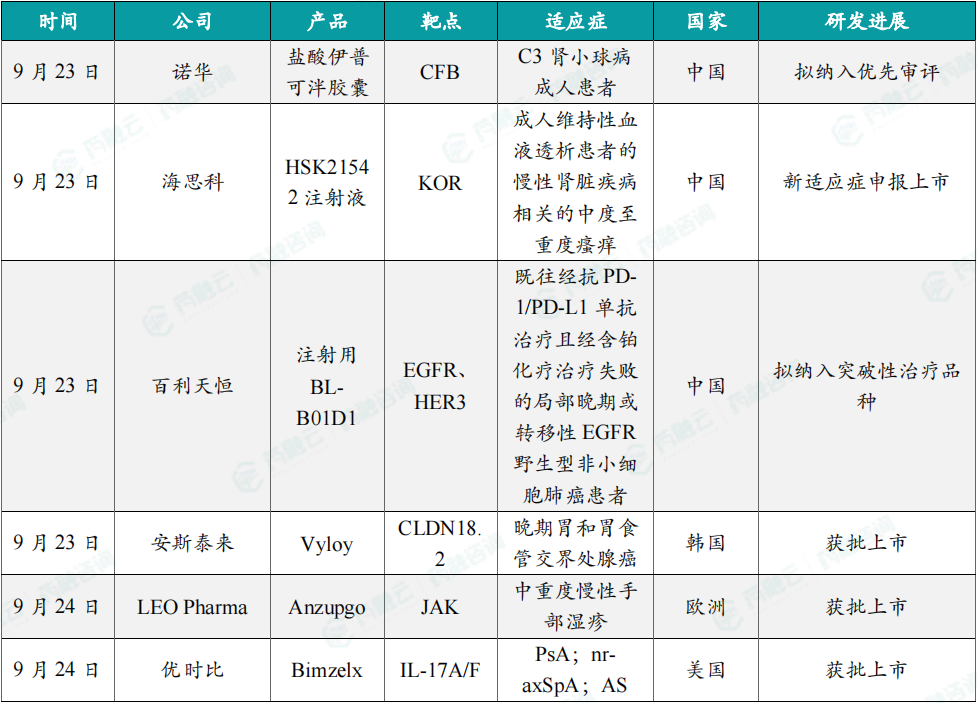
(1)诺华口服新药盐酸伊普可泮胶囊拟纳入优先评审
9月23日,诺华盐酸伊普可泮胶囊新适应症上市申请拟被纳入优先审评,适用于治疗C3肾小球病(C3G)成人患者。伊普可泮是一款特异性补体B因子口服抑制剂。针对C3G适应症,该产品此前已经被CDE纳入突破性治疗品种。伊普可泮胶囊(iptacopan,LNP023)是一种口服特异性替代补体途径因子B抑制剂,能高效抑制补体替代通路中因子B。它可能在治疗多种替代通路功能异常导致的疾病同时,不影响其它补体通路介导的对微生物入侵的免疫反应,降低患者受到感染的风险。这款产品曾被行业媒体Evaluate列为10款值得关注的潜在重磅疗法之一。
(2)海思科1类新药HSK21542注射液新适应症申报上市
9月23日,海思科申报的HSK21542注射液上市申请获得受理。根据海思科公告介绍,该项上市申请此前已经被CDE纳入优先审评,针对适应症为治疗成人维持性血液透析患者的慢性肾脏疾病相关的中度至重度瘙痒。HSK21542是海思科研发的强效外周kappa阿片受体(KOR)选择性激动剂,该产品的腹部手术术后镇痛的上市申请此前已经获得CDE受理。据海思科公告介绍,临床研究结果表明,HSK21542 注射液能显著缓解瘙痒,主要疗效指标和次要疗效指标均显著优于安慰剂组,且HSK21542注射液安全性良好可控。除了注射液剂型,海思科开发的HSK21542口服片剂用于腹膜透析中重度瘙痒的适应症也已开展2期临床研究。
(3)百利天恒双抗ADC注射用BL-B01D1拟纳入突破性治疗品种
9月23日,百利药业申报的注射用BL-B01D1两项适应症拟纳入突破性治疗品种,分别为:既往经抗PD-1/PD-L1单抗治疗且经含铂化疗治疗失败的局部晚期或转移性EGFR野生型非小细胞肺癌患者、经EGFR-TKI治疗失败的EGFR敏感突变的局部晚期或转移性非鳞状非小细胞肺癌患者。BL-B01D1是一种基于双特异性拓扑异构酶抑制剂的ADC,可同时靶向作用于表皮生长因子受体和人表皮生长因子受体3(EGFR×HER3),二者在大多数上皮性肿瘤中高度表达。该产品能够广泛地靶向多种实体肿瘤、且更加富集于肿瘤组织,从而增强肿瘤杀伤活性、减少靶毒性。
(4)安斯泰来Vyloy(zolbetuximab)在韩国获批上市
9月23日,安斯泰来韩国公司表示,韩国食品药品安全部(MFDS)已批准Vyloy(zolbetuximab)用于治疗晚期胃和胃食管交界处(GEJ)腺癌。根据安斯泰来新闻稿,zolbetuximab是一款靶向Claudin18.2(CLDN18.2)的抗体,也是全球首个获批的靶向Claudin 18.2的治疗药物,适用于Claudin 18.2阳性和HER2阴性的局部晚期不可切除或转移性胃或胃食管交界处腺癌患者。Zolbetuximab是一种“first-in-class”的靶向CLDN18.2的单克隆抗体。它已于2024年3月获得日本厚生劳动省(MHLW)批准,成为全球首个获监管机构批准的CLDN18.2靶向治疗方法。
(5)LEO Pharma小分子疗法Anzupgo乳膏获批上市
9月24日,LEO Pharma宣布欧盟委员会(EC)已批准Anzupgo(delgocitinib)乳膏上市,适用于那些不适合使用局部皮质类固醇治疗或治疗后应答不足的中重度慢性手部湿疹(CHE)成人患者。根据新闻稿,Anzupgo是欧盟批准用于治疗中重度CHE成人患者的首个外用药物。LEO Pharma还宣布,美国FDA已接受该公司提交delgocitinib乳膏的新药申请(NDA)。CHE是一种异质性、反复发作的炎症性皮肤病,主要症状包括瘙痒和疼痛。其病理生理学特征为皮肤屏障功能障碍、皮肤炎症和皮肤微生物群改变。该病可能带来很大的心理、社会和职业负担。
(6)优时比Bimzelx(bimekizumab)在美国获批上市
9月24日,优时比宣布,美国FDA已批准Bimzelx(bimekizumab)用于治疗活动性银屑病关节炎(PsA)、有客观炎症迹象的活动性非放射性中轴脊柱关节炎(nr-axSpA)以及活动性强直性脊柱炎(AS)成人患者。根据新闻稿,Bimzelx是美国FDA批准用于治疗四种慢性免疫介导炎性疾病的首个白介素-17 A/F(IL-17A/F)抑制剂。行业媒体Fierce Biotech称Bimzelx具有成为潜在重磅药物的潜力。Bimzelx是一款人源化的IgG1单克隆抗体,能够与IL-17A、IL-17F和IL-17AF细胞因子选择性结合。IL-17A与IL-17F具有大于50%的结构同源性和重叠的生物学功能。
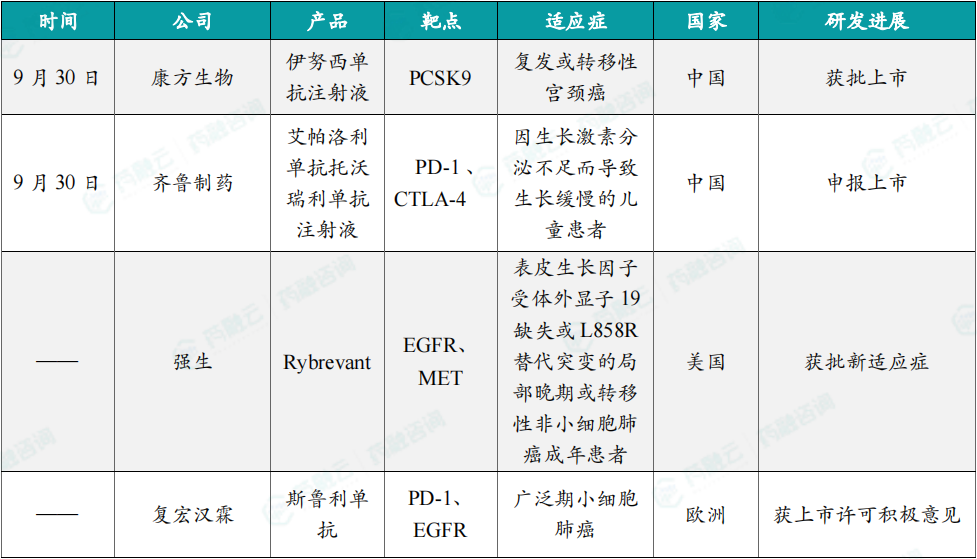
(7)康方生物抗PCSK9单抗伊努西单抗注射液获批上市
9月30日,康方生物1类新药伊努西单抗注射液(AK102)上市申请已正式获批,适应症为:在控制饮食的基础上,与他汀类药物、或者与他汀类药物及其他降脂疗法联合用药,用于在接受中等剂量或中等以上剂量他汀类药物治疗后,仍无法达到低密度脂蛋白胆固醇(LDL-C)目标的原发性高胆固醇血症(包括杂合子型家族性和非家族性高胆固醇血症)和混合型血脂异常的成人患者。研究表明,PCSK9基因的活跃表达会促进低密度脂蛋白受体的降解,从而降低肝脏清除血液中胆固醇的能力。这可能导致低密度脂蛋白胆固醇(LDL-C)水平长期升高,进而增加动脉粥样硬化性心血管疾病(ASCVD)的风险。
(8)齐鲁制药帕洛利单抗托沃瑞利单抗注射液获批上市
9月30日,齐鲁制药1类新药艾帕洛利单抗托沃瑞利单抗注射液上市申请已获得批准。根据齐鲁制药公开资料,这是一款双功能组合抗体,由靶向PD-1的IgG4抗体艾帕洛利单抗及靶向CTLA-4的IgG1抗体托沃瑞利单抗组成。该药本次获批的适应症为用于既往接受含铂化疗治疗失败的复发或转移性宫颈癌患者的治疗。根据齐鲁制药公开资料,该药可同时抑制PD-1和CTLA-4,并且CTLA-4抗体成分在体内具有更短的清除半衰期、在一个给药周期内抗体暴露时间较短。因此,艾帕洛利托沃瑞利单抗既有同时阻断PD-1和CTLA-4的协同作用机制,又降低了CTLA-4抗体产生的毒性。
(9)强生重磅双特异性抗体Rybrevant再获FDA批准
近日,强生公司宣布,美国FDA批准其双特异性抗体Rybrevant(amivantamab)联合标准化疗(卡铂和培美曲塞),用于治疗患有表皮生长因子受体(EGFR)外显子19缺失(ex19del)或L858R替代突变的局部晚期或转移性非小细胞肺癌(NSCLC)成年患者,这些患者在接受EGFR酪氨酸激酶抑制剂(TKI)治疗后发生疾病进展。Rybrevant是一款人源化EGFR/MET双特异性抗体。它具有多重抗癌的作用机制,不但能够阻断EGFR和MET介导的信号传导,还可以引导免疫细胞靶向携带激活性和耐药性EGFR/MET突变和扩增的肿瘤。
(10)复宏汉霖PD-1新药斯鲁利单抗获欧洲药品管理局上市许可积极意见
近日,复宏汉霖宣布欧洲药品管理局(EMA)人用药品委员会(CHMP)已发布推荐该公司自主开发的抗PD-1单抗新药——斯鲁利单抗获得上市许可的积极意见,建议批准其用于一线治疗广泛期小细胞肺癌(ES-SCLC)适应症。斯鲁利单抗是一款重组人源化抗PD-1单抗注射液,已在中国已获批用于治疗微卫星高度不稳定(MSI-H)实体瘤、鳞状非小细胞肺癌(sqNSCLC)、ES-SCLC,以及食管鳞状细胞癌(ESCC)。与此同时,复宏汉霖同步在全球开展10余项以斯鲁利单抗为核心的免疫联合疗法临床研究。
1.5.2本周全球TOP10积极/失败临床结果
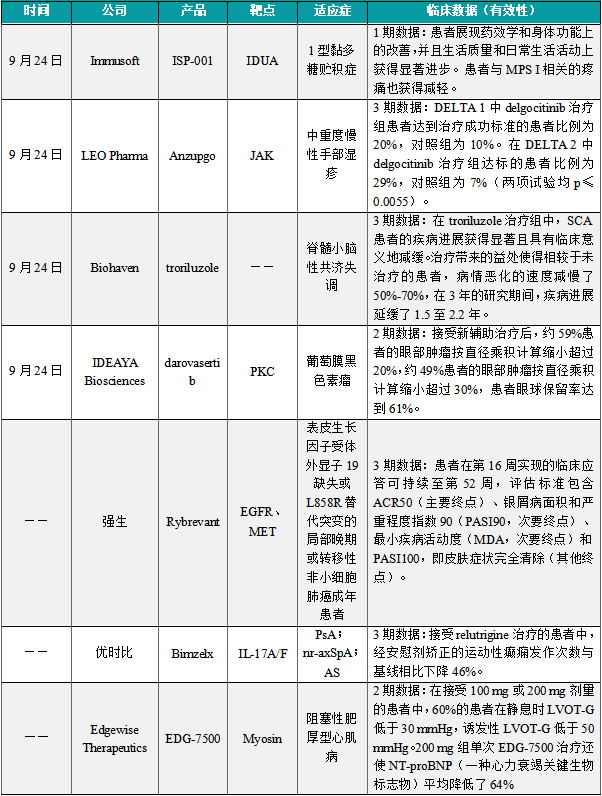

(1)Immusoft公布工程化B细胞疗法ISP-001 的1期临床数据
9月24日,Immusoft公布其工程化B细胞疗法ISP-001用于治疗1型黏多糖贮积症(MPS I)的临床1期试验积极结果。在该临床1期试验中,符合条件的受试者接受ISP-001的单次输注,并接受包括疾病生物标志物、功能测试和患者报告结果在内的评估。首例患者接受了研究中预定的最低剂量ISP-001治疗,并在研究的一部分时间内继续接受标准治疗。在该临床1期试验中,符合条件的受试者接受ISP-001的单次输注,并接受包括疾病生物标志物、功能测试和患者报告结果在内的评估。首例患者接受了研究中预定的最低剂量ISP-001治疗,并在研究的一部分时间内继续接受标准治疗。
(2)LEO Pharma公布Anzupgo(delgocitinib)乳膏的3期临床数据
9月24日,LEO Pharma公布Anzupgo(delgocitinib)乳膏的3期临床数据,适用于那些不适合使用局部皮质类固醇治疗或治疗后应答不足的中重度慢性手部湿疹(CHE)成人患者。Delgocitinib的批准主要是基于包括DELTA1和DELTA 2临床3期试验的结果,这些试验评估了delgocitinib相较于安慰剂的安全性和疗效。试验数据显示,在第16周时,delgocitinib治疗组比载体对照组有更大比例的患者达到IGA-CHE治疗成功的标准。DELTA 1中delgocitinib治疗组患者达到治疗成功标准的患者比例为20%,对照组为10%。在DELTA 2中delgocitinib治疗组达标的患者比例为29%,对照组为7%(两项试验均p≤0.0055)。
(3)Biohaven公布troriluzole 的3期临床数据
9月24日,Biohaven宣布在研疗法troriluzole在治疗脊髓小脑性共济失调(SCA)的关键性临床试验BHV4157-206-RWE中达到主要终点。在治疗3年后,与外部对照组相比,患者的功能性共济失调评分(f-SARA)变化获得显著改善。分析显示,在troriluzole治疗组中,SCA患者的疾病进展获得显著且具有临床意义地减缓。治疗带来的益处使得相较于未治疗的患者,病情恶化的速度减慢了50%-70%,在3年的研究期间,疾病进展延缓了1.5至2.2年。Troriluzole的主要作用机制是减少突触中的谷氨酸水平。Troriluzole增强了位于胶质细胞上的兴奋性氨基酸的转运体表达和功能,这些转运体在清除突触中的谷氨酸方面发挥着关键作用。
(4)IDEAYA Biosciences公布在研疗法darovasertib的2期临床数据
9月24日,IDEAYA Biosciences宣布在研疗法darovasertib在治疗葡萄膜黑色素瘤(UM)的2期临床试验中获得积极数据。Darovasertib是一种强效的选择性蛋白激酶C(PKC)抑制剂,正在开发用于治疗原发性和转移性UM。最新临床数据显示,接受新辅助治疗后,约59%患者的眼部肿瘤按直径乘积计算缩小超过20%,约49%患者的眼部肿瘤按直径乘积计算缩小超过30%,患者眼球保留率达到61%。综合来看,临床疗效数据为darovasertib用于新辅助治疗葡萄膜黑色素瘤提供了进一步临床概念验证。IDEAYA Biosciences同时宣布已经与美国FDA就3期临床试验的设计达成共识,在确定临床试验最终方案后将启动3期临床试验。
(5)强生公布双特异性抗体Rybrevant的3期临床结果
近日,强生公布双特异性抗体Rybrevant(amivantamab)联合标准化疗(卡铂和培美曲塞)的 3期临床结果,用于治疗患有表皮生长因子受体(EGFR)外显子19缺失(ex19del)或L858R替代突变的局部晚期或转移性非小细胞肺癌(NSCLC)成年患者,这些患者在接受EGFR酪氨酸激酶抑制剂(TKI)治疗后发生疾病进展。分析显示,与单独化疗相比,Rybrevant联合化疗可将病情进展或死亡风险降低52%,达成该研究的主要终点。接受Rybrevant联合化疗患者的中位无进展生存期(PFS)为6.3个月,而化疗组患者为4.2个月。此外,Rybrevant联合化疗组患者的确认总缓解率(ORR)为53%,而化疗组患者为29%。
(6)优时比公布Bimzelx的3期临床结果
近日,优时比公布Bimzelx的3期临床结果,Bimzelx是美国FDA批准用于治疗四种慢性免疫介导炎性疾病的首个白介素-17 A/F(IL-17A/F)抑制剂。分析显示,与安慰剂相比,Bimzelx在第16周时达到了美国风湿病学会50(ACR50)应答的主要终点,以及其他次要终点。在生物制品初治患者和TNF抑制剂应答不足(TNFi-IR)患者中均观察到了一致的结果。在对BE OPTIMAL和BE COMPLETE及其开放标签扩展研究的分析显示,患者在第16周实现的临床应答可持续至第52周,评估标准包含ACR50(主要终点)、银屑病面积和严重程度指数90(PASI90,次要终点)、最小疾病活动度(MDA,次要终点)和PASI100,即皮肤症状完全清除(其他终点)。
(7)Edgewise公布在研疗法EDG-7500的2期临床结果
近日,Edgewise Therapeutics宣布了在研疗法EDG-7500在阻塞性肥厚型心肌病(HCM)患者中的2期临床试验CIRRUS-HCM的顶线数据。EDG-7500是一种创新口服选择性心脏肌节调节剂,专门设计用于减缓早期收缩速度,并解决与HCM相关的心脏舒张受损问题。在CIRRUS-HCM的A部分中,阻塞性HCM患者接受了单次50、100或200 mg剂量的EDG-7500。接受100 mg和200 mg剂量的患者中,静息左室流出道压力梯度(LVOT-G)平均降低67%,诱发性LVOT-G平均降低55%。在接受100 mg或200 mg剂量的患者中,60%的患者在静息时LVOT-G低于30 mmHg,诱发性LVOT-G低于50 mmHg。200 mg组单次EDG-7500治疗还使NT-proBNP(一种心力衰竭关键生物标志物)平均降低了64%,显示了该疗法在治疗包括非阻塞性HCM在内的舒张功能障碍疾病中的潜力。
(8)安进OX40靶向单抗rocatinlimab治疗特性性皮炎3期结果积极
近日,安进公布其与Kyowa Kirin共同开发的在研OX40靶向单抗rocatinlimab在HORIZON临床3期试验中的积极顶线结果。Rocatinlimab是一种OX40靶向人源单克隆抗体,目前正在研究用于治疗中度至重度特应性皮炎。Rocatinlimab有可能成为首个通过靶向OX40来抑制和减少致病T细胞,以达到体内T细胞再平衡的疗法。分析显示,HORIZON达到了双主要终点。即在第24周时,与安慰剂组患者相比,rocatinlimab组患者中达到经验证特应性皮炎研究者总体评估(vIGA-ADTM)评分为0(皮肤症状清除)或1(皮肤症状几乎清除)且较基线减少≥2分的比例显著较高(19.3% vs. 6.6%,差异为12.8%,p<0.001);达到湿疹面积和严重度指数较基线减少75%(EASI-75)的rocatinlimab组患者比例亦较高(32.8% vs. 13.7%,差异19.1%,p<0.001)。该研究还在所有关键次要终点上达到统计学上的显著差异。
(9)UNION口服疗法orismilast治疗中重度特应性皮炎2b期结果积极
9月26日,UNION Therapeutics宣布,其潜在“first-in-class”口服疗法orismilast在治疗中度至重度特应性皮炎成人患者的2b期临床试验ADESOS中获得积极结果。Orismilast是一种新一代高效磷酸二酯酶4(PDE4)抑制剂,靶向与炎症相关的PDE4B/D亚型,表现出对Th1、Th2和Th17通路的强效抑制作用。它在炎症级联反应的早期阶段起作用,诱导对多种皮肤和免疫疾病相关的多种细胞因子的广泛抗炎作用。Orismilast的开发旨在比上市的PDE4抑制剂具有更强的抗炎特性,这得益于其对PDE4B和D亚型的更高选择性。研究中随机分配的233名患者的数据表明,与安慰剂组(n=55)相比,orismilast的20 mg(n=58)、30 mg(n=61)和40 mg(n=59)剂量组在第16周时让更多患者达到了研究者总体评估(IGA)评分为0或1的缓解标准(比例分别为26.3%、24.3%、30.9%和9.5%;所有p<0.05)。此外,所有治疗组在第2周时的瘙痒数值评分(NRS)均表现出显著的≥4点的减轻,与安慰剂相比获得显著改善(p<0.05)。
(10)Alumis变构小分子ESK-001治疗中重度斑块状银屑病2期结果积极
近日,Alumis公布其主打项目在研变构小分子ESK-001在STRIDE临床2期试验开放标签扩展期的积极数据。ESK-001是一款潜在“best-in-class”的强效、高选择性酪氨酸激酶2(TYK2)抑制剂变构小分子,可抑制包括白介素-12(IL-12)、白介素-23(IL-23)和IFN-α受体在内几种细胞因子受体的信号传导。28周的的开放标签扩展期数据显示,截至2024年3月1日,随着时间的推移,患者的银屑病面积和严重程度评分(PASI)终点应答呈现剂量依赖性持续增加。大多数患者在接受一天两次最高剂量40 mg治疗时,通过观察(AO)评估有93%患者(n=71)达到主要终点PASI 75(银屑病面积和严重程度指数改善至少75%),当使用改良后无应答者归因(mNRI)方式评估时,则有82.7%患者(n=81)达到主要终点。
同期事件:
1. 2024年第39-40周09.23-10.06国内创新药/改良型新药申请临床/获批临床/申请上市/获批上市数据分析
2. 2024年第39-40周09.23-10.06国内仿制药/生物类似物申报/审批数据分析
3. 2024年第39-40周09.23-10.06国内医药大健康行业政策法规汇总
4. 2024年第39-40周09.23-10.06全球医药大健康行业投融资数据
以上内容均来自{摩熵咨询医药行业观察周报(2024.09.23-2024.10.06)},如需查看或下载完整版报告,可点击!
<END>
想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!



















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论