1.5.1 本周全球TOP10创新药研发进展

(1)潜在“first-in-class”降血脂RNAi疗法获美国FDA突破性疗法认定
9月11日,Arrowhead Pharmaceuticals宣布,美国FDA授予其在研药物plozasiran突破性疗法认定,作为饮食控制的辅助疗法,用于减少患有家族性乳糜微粒血症综合征(FCS)成年患者的甘油三酯水平。FCS是一种严重且罕见的遗传性疾病,患者的甘油三酯水平极高,可能导致急性和潜在致命的胰腺炎,目前美国FDA尚未批准用以治疗FCS患者的治疗方案。Plozasiran是一款靶向APOC3基因的潜在“first-in-class”RNAi疗法,Plozasiran治疗目标是通过下调APOC3降低甘油三酯水平,并将脂质恢复到更正常的水平。之前公布的PALISADE临床3期试验结果显示,plozasiran使经遗传学测试确认的FCS患者的甘油三酯水平相较基线降低了80%,并使患者发生急性胰腺炎的风险降低了83%。
(2)天境生物1类新药普那利单抗注射液拟纳入突破性治疗品种,针对R/R MAS
9月11日,CDE官网公示,天境生物申报的1类新药普那利单抗注射液拟纳入突破性治疗品种,针对适应症为复发难治性风湿性疾病相关噬血细胞性淋巴组织细胞增多症(R/R MAS)。公开资料显示,GM-CSF是一种重要的细胞因子,在自身免疫性疾病的慢性炎症和损伤中发挥重要作用,中和GM-CSF可以抑制炎症反应并让患有类风湿关节炎等自身免疫疾病的患者临床获益。据天境生物公开资料介绍,普那利单抗注射液是一款抗人粒细胞巨噬细胞集落刺激因子(GM-CSF)的中和抗体,具有高亲和力,可特异性结合GM-CSF,并能阻断GM-CSF与其受体结合,从而阻断下游的信号传导和靶细胞激活。
(3)BridgeBio在研基因疗法获再生医学先进疗法认定,针对罕见病
9月12日,BridgeBio Pharma宣布,美国FDA授予其治疗卡纳万病(Canavan disease)的在研基因疗法BBP-812再生医学先进疗法(RMAT)认定。卡纳万病是一种由编码天冬氨酸酶的ASPA基因突变引起的超罕见、可致残或致命的疾病。大多数儿童无法爬行、行走、坐着或说话,在幼时就会面临死亡的威胁。天冬氨酸酶活性的缺乏会导致N-乙酰天冬氨酸(NAA)的积累,并最终导致对髓鞘的毒性。目前,该病尚无获批的疗法。BBP-812能够将ASPA基因的功能拷贝递送到全身并进入大脑,从而可能根治疾病。BridgeBio将利用RMAT认定的优势,包括与FDA的早期和更频繁的互动,以推动BBP-812的加速批准。新闻稿指出,如果获得批准,BBP-812有望成为出生时患有卡纳万病儿童的首个治疗选择。
(4)强生白细胞介素-23抑制剂获批新适应症,治疗溃疡性结肠炎
9月13日,强生(Johnson & Johnson)宣布美国FDA已批准Tremfya(guselkumab)用于治疗中度至重度活动性溃疡性结肠炎(UC)成人患者。Tremfya是一款全人源单克隆抗体,除了靶向IL-23,该抗体也可同时与生产IL-23细胞上的受体CD64相结合,IL-23是由活化的单核细胞/巨噬细胞和树突状细胞分泌的细胞因子,是UC等免疫介导疾病的驱动因素,此次美国FDA的批准是Tremfya获批的第三个适应症。Tremfya于2017年7月首次获FDA批准用于治疗中度至重度斑块状银屑病成人患者,随后于2020年7月获批用于治疗活动性银屑病关节炎成人患者。根据新闻稿,Tremfya是首个获批用于治疗活动性溃疡性结肠炎的双作用机制白细胞介素-23(IL-23)抑制剂。
(5)罗氏PD-L1单抗皮下制剂获批上市,治疗多类型癌症
9月13日,罗氏(Roche)宣布其靶向PD-L1抗体Tecentriq Hybreza(atezolizumab和透明质酸酶)皮下制剂获得美国FDA批准,用于治疗Tecentriq静脉注射剂已获FDA批准的所有成人适应症,包括某些类型的肺癌、肝癌、皮肤癌和软组织癌。Tecentriq是罗氏开发的一种靶向PD-L1的单克隆抗体,Tecentriq Hybreza皮下制剂将Tecentriq与Halozyme Therapeutics的Enhanze药物输送技术相结合,使Tecentriq Hybreza皮下制剂能够迅速扩散并吸收到血液中。根据新闻稿,Tecentriq Hybreza是首个获FDA批准的PD-1/PD-L1抑制剂皮下注射疗法,与传统静脉输注耗时30-60分钟相比,Tecentriq Hybreza皮下注射仅需约7分钟,为患者提供了更加便捷的治疗选择。
(6)辉瑞在研EZH2抑制剂获批临床,针对转移性去势抵抗性前列腺癌
9月13日,辉瑞(Pfizer)公司申报的1类新药PF-06821497片获得CDE临床试验默示许可,适应症为:拟联合恩扎卢胺用于未使用过针对转移性前列腺癌的新型内分泌治疗或化疗的转移性去势抵抗性前列腺癌男性患者的治疗。公开资料显示,EZH2是一种组蛋白甲基转移酶,它通过催化组蛋白H3赖氨酸27(H3K27)的甲基化以控制各种基因表达,从而调节细胞的正常生理功能,EZH2的异常表达与多种癌症的进展和不良预后有关,包括前列腺癌、乳腺癌、肺癌和血液恶性肿瘤等等。PF-06821497(mevrometostat)是一款在研的EZH2抑制剂。据今年3月辉瑞在其肿瘤学创新日期间的披露,到2030年其肿瘤学研发管线有望推出超8款重磅疗法,其中就包括这款EZH2抑制剂。
(7)康诺亚1类新药CM380获批临床,拟开发治疗复发或难治性多发性骨髓瘤
9月13日,CDE官网公示,康诺亚生物申报的1类新药CM380获批临床,拟开发治疗复发或难治性多发性骨髓瘤。根据康诺亚公开资料,CM380是一种GPRC5D/CD3双特异性抗体,可同时靶向识别并特异性结合多发性骨髓瘤细胞表面的GPRC5D,以及T细胞表面CD3受体,将免疫T细胞招募至靶细胞周围,诱导T细胞介导的肿瘤细胞杀伤(TDCC)作用杀伤骨髓瘤细胞。临床前研究显示,CM380具有良好的抑瘤效果且耐受性良好,此外,该产品发生细胞因子释放综合征的可能性较低,本次为该产品首次在中国获批临床。
(8)再生元度普利尤单抗获批新适应症,针对慢性鼻窦炎伴鼻息肉
9月14日,再生元(Regeneron Pharmaceuticals)和赛诺菲(Sanofi)宣布,美国FDA已批准其药品Dupixent(dupilumab)作为病情不能充分控制的慢性鼻窦炎伴鼻息肉(CRSwNP)12至17岁青少年患者的辅助维持治疗。此次获批主要获得来自两项成人CRSwNP积极关键试验(SINUS-24和SINUS-52)中疗效数据的外推(extrapolation)分析结果。Dupixent是一种完全人源化的单克隆抗体,可抑制IL-4和IL-13通路的信号传导,进而抑制2型炎症反应。此前,Dupixent单抗已被FDA批准治疗包括特应性皮炎、哮喘、结节性痒疹和嗜酸性食管炎等疾病,根据新闻稿,Dupixent为美国FDA批准针对此类CRSwNP患者群体的首个治疗方案。
(9)礼来创新湿疹疗法IL-13抑制剂Ebglyss获批上市,治疗特应性皮炎
9月14日,礼来宣布,美国FDA批准其IL-13抑制剂Ebglyss(lebrikizumab),用于治疗中度至重度特应性皮炎(AD)成年和青少年患者(12岁及以上,体重至少40公斤),这些患者尽管使用局部药物治疗但病情仍无法得到控制。Ebglyss是一种单克隆抗体,能高亲和力结合IL-13,有效阻止IL-13Rα1/IL-4Rα异二聚体复合物的形成及其后续信号传导,这种抑制显著减轻了IL-13的生物学效应,而IL-13是特应性皮炎中的关键细胞因子,推动皮肤中的2型炎症反应。Ebglyss由Almirall和礼来公司联合开发,礼来公司拥有在欧洲以外全球其他地区的独家开发和商业化权利,Ebglyss于2023年获得欧盟委员会批准,并于2024年1月在日本获得批准。
(10)罗氏重磅抗体疗法获FDA批准,治疗多发性硬化
9月14日,罗氏(Roche)宣布美国FDA已批准Ocrevus Zunovo(ocrelizumab & hyaluronidase)皮下制剂用于治疗复发性多发性硬化(RMS)和原发性进展型多发性硬化(PPMS)。Ocrevus是一种人源化单克隆抗体,旨在靶向CD20阳性B细胞,这是一种被认为造成髓鞘和神经细胞轴突损伤的特定类型免疫细胞。Ocrevus Zunovo皮下制剂结合了Ocrevus与Halozyme Therapeutics专有的ENHANZE药物递送平台,使Ocrevus能够进入并迅速扩散和吸收到血液中。根据新闻稿,Ocrevus Zunovo是首个获批用于治疗RMS和PPMS的皮下制剂,该药物每年仅需注射两次,每次注射时间仅需10分钟。
1.5.2本周全球TOP10积极/失败临床结果
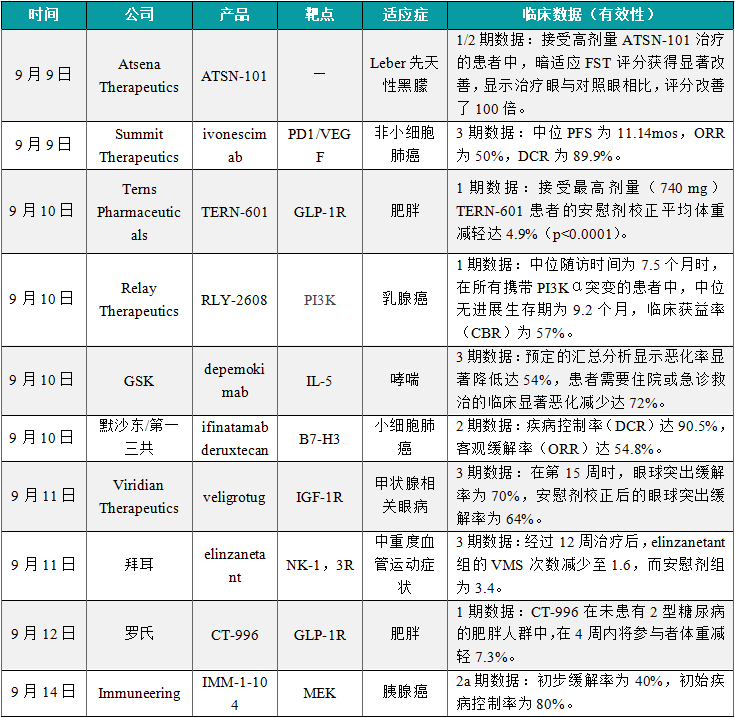
(1)Atsena在研基因疗法ATSN-101的1/2期临床试验结果积极
9月9日,Atsena Therapeutics宣布,在研基因疗法ATSN-101治疗携带GUCY2D双等位基因突变引起的Leber先天性黑朦(LCA1)患者的1/2期临床试验数据已在《柳叶刀》上发表。LCA1是一种单基因眼科疾病,导致视网膜功能的损伤,该病由GUCY2D基因突变引起,导致早期和严重的视力受损或失明,目前尚无LCA1的获批治疗方法。结果显示,接受高剂量ATSN-101治疗的患者中,暗适应FST评分获得显著改善,显示治疗眼与对照眼相比,评分改善了100倍。在接受治疗第28天时就可以观察到改善,并持续了12个月(p=0.012)。BCVA也有一定改善,高剂量组受试者在治疗后12个月时平均在视力表上多看清8个字母(p=0.10)。在进行了MLMT测试的6名高剂量受试者中,3人在12个月时治疗眼的MLMT测试评分达到了满分。
(2)Summit公布PD1/VEGF双抗3期临床结果
9月9日,Summit Therapeutics公司在国际肺癌研究协会(IASLC)2024年世界肺癌大会(WCLC 2024)上公布了3期临床试验HARMONi-2的主要分析数据。试验结果显示,潜在“first-in-class”双特异性抗体ivonescimab与获批重磅免疫检查点抑制剂相比,作为一线疗法,显著降低了PD-L1阳性晚期非小细胞肺癌(NSCLC)患者疾病进展或死亡的风险。在HARMONi-2的主要分析中,ivonescimab单药治疗组中位PFS为11.14mos,ORR为50%,DCR为89.9%,ivonescimab展现了可接受且可控制的安全性,与之前的研究结果一致。行业媒体Fierce Pharma发表的文章表示,这一结果具有改变NSCLC一线标准治疗的潜力。
(3)Terns公布GLP-1/GLP-2受体双激动剂1期试验积极结果
9月10日,Terns Pharmaceuticals宣布其每日一次在研减重疗法TERN-601在肥胖或超重健康成年人中进行的1期试验积极结果,TERN-601是一种口服小分子胰高血糖素样肽-1(GLP-1)受体激动剂,由Terns内部研发。分析显示,TERN-601耐受性良好,在28天的多次给药(MAD)研究中表现出剂量依赖性,且具有统计学显著性的体重减轻效果。接受最高剂量(740 mg)TERN-601患者的安慰剂校正平均体重减轻达4.9%(p<0.0001)。此外,67%最高剂量组受试者体重减少5%或更多。根据该积极结果,公司计划于2025年启动2期临床试验。
(4)Relay宣布PI3K靶向小分子疗法首个人体试验的积极中期数据
9月10日,Relay Therapeutics宣布在研疗法RLY-2608首个人体试验的积极中期数据,数据显示,此前接受过大量治疗,携带PI3Kα突变的HR阳性、HER2阴性局部晚期或转移性乳腺癌患者在接受RLY-2608(600 mg)联合fulvestrant治疗后,表现出具有临床意义的无进展生存期(PFS)。在52名接受RP2D且未携带PTEN或AKT共突变的患者中,中位随访时间为7.5个月时,在所有携带PI3Kα突变的患者中,中位无进展生存期为9.2个月,临床获益率(CBR)为57%,在30名具有可测量疾病的患者中,三分之一的患者达到部分缓解(PR),客观缓解率ORR为33%,近四分之三的患者出现肿瘤缩小。新闻稿指出,RLY-2608是首个针对PI3Kα,具有突变体和异构体(isoform)选择性的别构抑制剂。
(5)GSK超长效疗法3期试验结果公布,治疗哮喘
9月10日,GSK公布了3期临床试验SWIFT-1和SWIFT-2的完整结果,这两项试验评估了在研单抗depemokimab与安慰剂相比,在具有2型炎症特征(以血液嗜酸性粒细胞计数为标志)的严重哮喘成人和青少年患者的疗效和安全性。分析显示,试验达主要终点,该疗法可显著降低患者哮喘发作率达54%,试验亦达成次要终点,与安慰剂相比,患者需要住院或急诊救治的临床显著恶化减少达72%。根据新闻稿,depemokimab是在3期试验中进行评估的首个白细胞介素-5(IL-5)靶向超长效生物制品,Depemokimab能够与IL-5以高亲和力结合,以每六个月给药一次的频率用以治疗重度哮喘患者。
(6)默沙东/第一三共潜在"first-in-class"ADC疗法结果积极
9月10日,默沙东(MSD)公布其进行中IDeate-Lung01临床2期试验剂量优化部分的中期积极结果。IDeate-Lung01是一项全球性、多中心、随机、开放标签的2期试验,包含两个部分,旨在评估ifinatamab deruxtecan在ES-SCLC患者中的安全性和有效性。在试验的第一部分(剂量优化)中,接受12mg/kg(n=42)和8 mg/kg(n=46)ifinatamab deruxtecan治疗的ES-SCLC患者的确认ORR分别为54.8%和26.1%,DCR分别为90.5%和80.4%,中位PFS分别为5.5个月和4.2个月,中位OS分别为11.8个月和9.4个月。根据新闻稿,Ifinatamab deruxtecan是一种潜在"first-in-class"的B7-H3靶向ADC,采用第一三共专有的DXd ADC技术设计而成,分别于2023年4月和2024年2月被美国FDA和欧盟委员会授予孤儿药资格,用于治疗SCLC。
(7)Viridian抗体疗法3期临床试验获得积极顶线数据,治疗甲状腺相关眼病
9月11日,Viridian Therapeutics宣布,在研疗法veligrotug(VRDN-001)在3期临床试验THRIVE中获得积极顶线数据。VRDN-001是一种静脉输注的抗胰岛素样生长因子-1受体(IGF-1R)抗体,用于治疗甲状腺相关眼病(TED)。Veligrotug在THRIVE中达到了所有主要和次要终点。新闻稿指出,这是迄今为止在TED患者中进行的最大规模的抗IGF-1R抗体3期临床试验之一。在第15周时,眼球突出缓解率为70%,安慰剂校正后的眼球突出缓解率为64%(p<0.0001)。值得一提的是,53%的患者3周内眼球突出症状就获得显著改善,此时他们只接受过一次治疗。
(8)拜耳潜在“first-in-class”疗法达到3期临床主要终点,治疗VMS
9月11日,拜耳(Bayer)宣布,将在2024年9月10日至14日举行的更年期协会(The Menopause Society)年会上,展示3期临床试验OASIS 3的详细结果,这项研究提供了在研化合物elinzanetant的有效性数据以及52周的安全性数据,用于治疗与更年期相关的中度至重度血管运动症状。在这项研究中,基线时,elinzanetant组女性平均VMS次数为6.7,安慰剂组为6.8。经过12周治疗后,elinzanetant组的VMS次数减少至1.6,而安慰剂组为3.4。在整个研究期间,VMS的减少效果得以维持,Elinzanetant在52周内的安全性特征良好。根据新闻稿,Elinzanetant是一款潜在“first-in-class”的双重神经激肽-1,3(NK-1,3)受体拮抗剂,口服每天一次,是治疗绝经相关的中度至重度VMS的非激素类疗法。
(9)罗氏口服GLP-1受体激动剂1期临床结果积极
9月12日,罗氏(Roche)在2024年欧洲糖尿病研究协会(EASD)年会上公布了其口服胰高血糖素样肽-1(GLP-1)受体激动剂CT-996的1期临床试验结果。试验结果显示,在队列3患者亚群中(接受较为缓慢的剂量滴定并最终达到120 mg),每日一次口服CT-996在4周内将患者的体重平均降低7.3%,安慰剂同期将体重降低1.2%。与安慰剂相比,CT-996提供了具有临床意义的体重减轻。安全性方面,所有的治疗伴发不良事件(TEAE)均为轻度或中度,没有发现3级以上TEAE。没有出现与在研药物相关的停止用药。CT-996是一款每日一次的口服GLP-1受体小分子激动剂,基于这一积极结果,该公司计划在2025年启动2期临床试验。
(10)Immuneering小分子联合疗法积极数据公布,针对胰腺癌
9月14日,Immuneering公布其进行中的2a期临床试验取得积极初步结果,接受其在研MEK抑制剂IMM-1-104与经调整的吉西他滨/白蛋白紫杉醇一线联合疗法的胰腺癌患者,其疾病控制率高达80%。在这次所公布的2a期试验当中,首批五名接受IMM-1-104联合经调整的吉西他滨/白蛋白紫杉醇治疗的胰腺癌患者中,前两例患者(2/5)已观察到完全或部分缓解,初步缓解率为40%,初始疾病控制率为80%,所有五例患者均继续接受治疗。根据新闻稿,IMM-1-104是一款靶向MAPK通路中重要激酶MEK的抑制剂,旨在通过每日一次给药对MAPK通路进行抑制,美国FDA此前已授予IMM-1-104快速通道资格,用于治疗一线和二线胰腺癌。
同期事件:
1. 2024年第37周09.09-09.15国内创新药/改良型新药申请临床/获批临床/申请上市/获批上市数据分析
2. 2024年第37周09.09-09.15国内仿制药/生物类似物申报/审批数据分析
3. 2024年第37周09.09-09.15国内医药大健康行业政策法规汇总
4. 2024年第37周09.09-09.15全球医药大健康行业投融资数据
以上内容均来自{摩熵咨询医药行业观察周报(2024.09.09-2024.09.15)},如需查看或下载完整版报告,可点击!
<END>
想要解锁更多药物研发信息吗?查询摩熵医药数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!



















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论