1.5.1 本周全球TOP10创新药研发进展
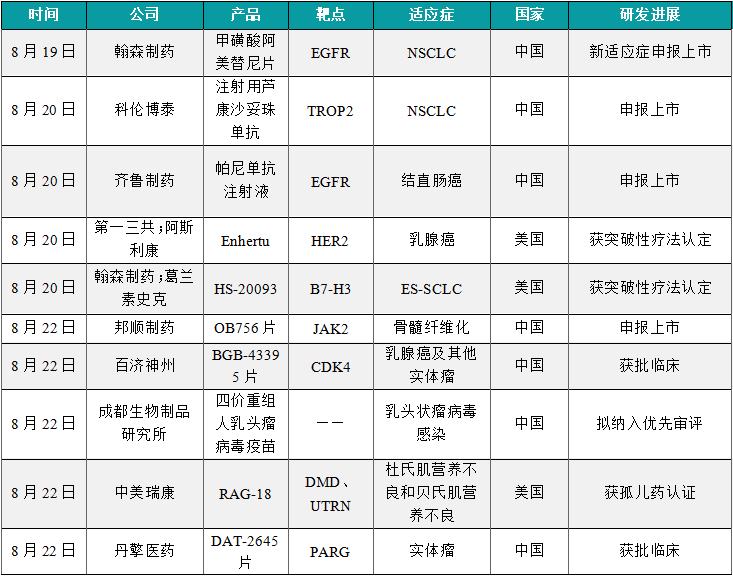
(1)翰森制药肺癌新药甲磺酸阿美替尼片新适应症申报上市
8月19日,翰森制药宣布其自主研发的1类新药甲磺酸阿美替尼片新适应症上市申请获中国国家药品监督管理局受理,用于含铂根治性放化疗后未出现疾病进展的不可切除的局部晚期表皮生长因子受体(EGFR)外显子19缺失或外显子21(L858R)置换突变的非小细胞肺癌(NSCLC)患者治疗,这是阿美替尼片在中国提交的第四个适应症上市申请。作为一款第三代EGFR-TKI,阿美替尼片曾先后于2020年和2021年在中国获批,分别用于二线治疗既往经EGFR-TKI治疗进展,且T790M突变阳性的局部晚期或转移性NSCLC患者,和一线治疗具有EGFR外显子19缺失或外显子21(L858R)置换突变阳性的局部晚期或转移性NSCLC成人患者。此外,阿美替尼片的第三个适应症上市申请于近期获CDE受理,用于具有EGFR外显子19缺失或外显子21(L858R)置换突变阳性的NSCLC成人患者肿瘤切除术后的辅助治疗。
(2)科伦博泰创新ADC新药注射用芦康沙妥珠单抗申报上市
8月20日,科伦博泰注射用芦康沙妥珠单抗递交新药上市申请并获得受理。根据科伦博泰公告,本次申请上市的适应症为:治疗接受EGFR-TKI疗法和含铂化疗治疗失败的局部晚期或转移性EGFR突变非小细胞肺癌(NSCLC)患者。公开资料显示,芦康沙妥珠单抗(注射用SKB264)是科伦博泰与默沙东(MSD)联合开发的一款靶向TROP2的ADC。TROP-2抗癌药物开发的潜力靶点之一。它的过表达在肿瘤生长过程中起着关键作用,与更具侵袭性的疾病和预后不良相关。芦康沙妥珠单抗曾先后4次被CDE纳入突破性治疗品种,分别针对:局部晚期或转移性三阴乳腺癌、局部晚期或转移性EGFR突变非小细胞肺癌、局部晚期或转移性HR阳性/HER2阴性乳腺癌、PD-L1阴性三阴性乳腺癌。
(3)齐鲁制药帕尼单抗生物类似药申报上市
8月20日,CDE官网公示齐鲁制药申报的帕尼单抗注射液生物类似药上市申请获得受理。帕尼单抗是一款靶向EGFR的单抗产品。公开资料显示,帕尼单抗(panitumumab,商品名Vectibix)原研产品由安进公司开发,可特异性针对表皮生长因子受体(EGFR)。EGFR信号通路在细胞增殖和迁移过程中起重要作用,许多癌细胞被发现过度表达EGFR或EGFR被过度激活,使其能不受控制的生长。帕尼单抗在全球范围内获批多项癌症适应症,包括单药治疗肿瘤表达EGFR的转移性结直肠癌(mCRC)患者、与FOLFOX化疗方案形组合一线治疗KRAS 2号外显子野生型的mCRC患者、二线治疗RAS野生型mCRC患者等。
(4)第一三共与阿斯利康联合开发的Enhertu获突破性疗法认定
8月20日,第一三共(Daiichi Sankyo)宣布其与阿斯利康(AstraZeneca)联合开发的重磅抗体偶联药物(ADC)Enhertu(trastuzumab deruxtecan)获得美国FDA授予突破性疗法认定(BTD),用于治疗激素受体(HR)阳性HER2低表达(IHC 1+或IHC 2+/ISH-)或HER2超低表达(定义为带有膜染色的IHC 0)不可切除或转移性乳腺癌患者,这些患者接受过两线内分泌疗法治疗其转移性疾病,或在接受一线内分泌疗法联合CDK4/6抑制剂后6个月内或在接受内分泌辅助疗法后24个月内发生疾病进展。此外,第一三共也同时宣布欧洲药品管理局(EMA)已接受Enhertu新适应症的监管申请,将针对Enhertu作为单药治疗不可切除或转移性HER2低或超低表达成年乳腺癌患者进行评估,这些患者至少接受过一次内分泌疗法治疗转移性疾病。
(5)翰森制药ADC癌症新药HS-20093获FDA突破性疗法认定
8月20日,翰森制药宣布,其合作方葛兰素史克(GSK)就HS-20093(GSK5764227)获美国FDA突破性疗法认定。这是一款B7-H3靶向抗体偶联药物(ADC),正在评估用于含铂化疗期间或之后进展的(复发或难治性)广泛期小细胞肺癌(ES-SCLC)患者治疗。HS-20093是一种新型B7-H3靶向ADC,由全人源化的B7-H3单抗与拓扑异构酶抑制剂(TOPOi)有效载荷共价连接而成,正在中国进行多项用于治疗肺癌、肉瘤、头颈癌及其他实体瘤的1期和2期临床研究。2023年12月20日,翰森制药与GSK订立一项超17亿美元的独家许可协议,授予GSK全球独占许可(不含中国内地、香港、澳门及台湾地区),以开发、生产及商业化HS-20093。
(6)邦顺制药JAK2抑制剂邦瑞替尼申报上市,针对骨髓纤维化
8月22日,邦顺制药的OB756片的1类新药上市申请获得受理。公开资料显示,OB756片是一款JAK2抑制剂邦瑞替尼,是邦顺制药的核心品种。根据邦顺制药早前新闻稿,推测此次上市申请的适应症为骨髓纤维化(MF)。OB756(邦瑞替尼)是一款口服选择性JAK2抑制剂,其可通过靶向抑制JAK2 V617F的激酶活性,阻断JAK/STAT信号传导途径,进而发挥治疗作用。MF是一种弥漫性骨髓纤维组织增生性疾病,属于骨髓增生性肿瘤(MPN)的一种,最终会进展为骨髓衰竭或转化为急性白血病。随着患者JAK2 V617F等突变基因的发现,靶向药物获得了突破性进展,显著延长了患者生存期,但该领域对新型药物疗法的需求仍非常迫切。
(7)百济神州1类新药BGB-43395片获批临床症,针对乳腺癌
8月22日,百济神州1类新药BGB-43395片获批临床,拟用于单药治疗或与氟维司群、来曲唑或其他药物联合治疗晚期或转移性HR+/HER2-乳腺癌及其他实体瘤。公开资料显示,BGB-43395片是一款靶向CDK4的化学药物,是百济神州乳腺癌和妇科癌症管线中的在研产品之一。百济神州在日前发布的2024年半年报中披露,BGB-43395单药治疗组以及与氟维司群和来曲唑的联合治疗组在预期有效剂量范围内进行剂量递增,未观察到剂量限制性毒性。至今已入组超过60例患者,有望在2024年第四季度公布1期试验的首次数据读出结果。
(8)成都生物制品研究所的四价重组人乳头瘤病毒疫苗拟纳入优先审评
8月22日,中国生物成都生物制品研究所四价重组人乳头瘤病毒疫苗(6,11,16,18型)的上市申请拟纳入优先审评,适用于预防因高危型HPV16、HPV18型所致宫颈癌、2级、3级宫颈上皮内瘤样病变(CIN2/3)和原位腺癌、1级宫颈上皮内瘤样病变(CIN1)以及HPV6型、HPV11型、HPV16型、HPV18型引起的感染。据成都生物制品研究所此前新闻稿介绍,这是一款四价HPV疫苗,主要覆盖HPV病毒6、11、16、18等4个亚型,适用于18~45岁女性进行预防性接种。本次拟纳入优先审评的疫苗产品由中国生物研究院研发,成都生物制品研究所进行产业化开发,双方共同开展临床研究,于2018年5月启动3期临床试验。根据访视结果获得期中分析积极建议——“结果达到预设的显著性水平”,表明安全性、有效性良好。
(9)中美瑞康新药RAG-18获FDA孤儿药与儿科罕见病双重认证
8月22日,中美瑞康(Ractigen Therapeutics)宣布其小激活RNA(saRNA)药物RAG-18获得美国FDA的孤儿药认证(ODD)。中美瑞康指出,继上个月RAG-18获得FDA儿科罕见病药物资格认定(RPDD)之后,这一最新认证进一步确立了RAG-18创新性治疗杜氏肌营养不良(DMD)和贝氏肌营养不良(BMD)的潜力。无论DMD基因突变类型如何,RAG-18都可能成为一种具有可转化前景的治疗策略。RAG-18是一款首创作用机制的双链saRNA药物,通过RNA激活(RNAa)机制特异性靶向激活肌肉细胞中UTRN基因表达。由UTRN基因编码的肌营养不良蛋白(utrophin)在结构和功能上与抗肌萎缩蛋白(dystrophin)相似,它的上调可以功能性替代 DMD 肌肉细胞中缺失的抗肌萎缩蛋白,从而治疗所有突变类型的DMD和BMD患者。
(10)丹擎医药PARG抑制剂DAT-2645片获批临床
8月22日,丹擎医药申报的1类新药DAT-2645片获批临床,拟用于携带乳腺癌易感基因1/2(BRCA1/2)功能缺失突变和/或脱氧核糖核酸损伤修复(DDR)通路中其他缺陷的晚期或转移性实体瘤的患者。公开资料显示,这是丹擎医药开发的一款PARG抑制剂,它通过合成致死的机制特异性地杀伤携带特定DNA损伤修复缺陷的肿瘤细胞。据丹擎医药新闻稿介绍,DAT-2645的适应症包括乳腺癌、卵巢癌、胰腺癌、前列腺癌、子宫癌、胃癌、结直肠癌等多种常见癌症,并且有望拓展PARP抑制剂无效的适应症和解决PARP抑制剂耐药的痛点,具有潜在的“广谱治疗性”的临床应用前景。
1.5.2本周全球TOP10积极/失败临床结果


(1)礼来公布tirzepatide 3期积极临床结果,降低94%糖尿病进展风险
8月21日,礼来(Eli Lilly and Company)公布其重磅药物tirzepatide为期三年的SURMOUNT-1临床3期研究的积极顶线结果。分析显示,每周注射一次tirzepatide可使糖尿病前期的肥胖或超重成人进展为2型糖尿病的风险显著降低94%。此外,tirzepatide可使患者在整个治疗期间持续减重。在治疗期结束时,接受15mg剂量治疗的成人体重平均下降22.9%。Tirzepatide是一款葡萄糖依赖性促胰岛素多肽(GIP)和胰高血糖素样肽-1(GLP-1)受体双重激动剂,可同时激活GLP-1受体和GIP受体介导的信号通路。GIP和GLP-1是调控血糖的天然的肠促胰岛素激素。
(2)百时美施贵宝公布Oppo与Yervoy联合疗法的3期临床数据
8月22日,百时美施贵宝公布重磅PD-1抑制剂Oppo(nivolumab)与CTLA-4靶向抗体Yervoy(ipilimumab)联合疗法的临床3期试验结果。Oppo联合Yervoy治疗显示,在临床与统计学上显著延长主要终点OS。接受Oppo加Yervoy联合疗法患者的中位OS为23.7个月(95% CI:18.8–29.4),而接受活性对照药物治疗患者的中位OS为20.6个月(95% CI:17.5–22.5),风险比为0.79(0.65–0.96;p=0.018)。总生存期获益在各患者亚组中大致一致。在临床与统计学上显著改善关键次要终点ORR,接受Oppo加Yervoy联合疗法患者的ORR为36%(95% CI:31-42),而接受活性对照药物治疗患者的ORR为13%(95% CI:10-17)。
(3)Galapagos公司公布CAR-T细胞疗法GLPG5101的 1/2期临床结果
近日,Galapagos公司公布了在欧洲开展的CAR-T细胞疗法GLPG5101治疗复发/难治性非霍奇金淋巴瘤的1/2期ATALANTA-1研究的积极结果。在研究的第一部分,中位随访时间为13.1个月,接受GLPG5101治疗的16例可评估的复发/难治性NHL患者的ORR为87.5%(14/16),完全缓解率(CRR)为75%(12/16)。71%的患者在数据截止时保持缓解。在研究的第二部分,中位随访时间为4.2个月,15例可评估患者的ORR和CRR均为93.3%(14/15)。100%的患者在数据截止时持续缓解。安全性方面,大多数治疗伴发不良事件为1/2级,在研究的第一部分观察到2例3级细胞因子释放综合征(CRS),在研究的第二部分观察到1例3级免疫效应细胞相关神经毒性综合征(ICANS)。
(4)Latigo Biotherapeutics公布LTG-001的1期临床数据
近日,Latigo Biotherapeutics宣布其潜在“best-in-class”非阿片类止痛药候选药物LTG-001的1期临床试验结果良好。LTG-001是一种口服、选择性Nav1.8抑制剂,正在开发用于从根源治疗急性和慢性疼痛。在72名健康受试者中进行的1期临床试验结果表明,LTG-001的耐受性良好,吸收迅速,Tmax(达到最大浓度的时间)约为1.5小时,药代动力学特征可预测,暴露量在整个剂量范围内呈比例增加。快速缓解疼痛对于急性和慢性疼痛的管理至关重要,在本研究中,LTG-001在给药后两小时内就能达到Tmax表明该候选疗法有望快速缓解疼痛。此外,研究剂量下未显示食物影响。
(5)百时美施贵宝公布Breyanzi临床2期结果,94%患者肿瘤完全消失
近日,百时美施贵宝公布其CAR-T细胞疗法Breyanzi临床2期结果。分析显示,在接受Breyanzi作为三线或以上疗法的可评估复发或难治性FL患者中(n=101),总缓解率(ORR)为97%(95% CI:91.6-99.4;单侧p<0.0001),其中94%的患者达成完全缓解(95% CI:87.5-97.8;单侧p<0.0001)。缓解情况持久,中位缓解持续时间在中位随访16.6个月时尚未达成。在12个月时,81.9%的应答者仍持续缓解。在中位随访17.5个月时,尚未达到中位无进展生存期(PFS),80.7%的患者实现了12个月的PFS。在中位随访18.9个月时,Breyanzi展现出可控的安全性特征,没有观察到新的安全信号,并且严重细胞因子释放综合征(CRS)和神经事件(NE)的发生率低。
(6)强生公布双特异性抗体联合疗法的3期临床数据
近日,强生公布双特异性抗体联合疗法的MARIPOSA临床3期研究的积极结果。该研究检视Rybrevant与Lazcluze联合疗法与活性对照TKI药物Tagrisso相比,用以一线治疗EGFR外显子19缺失或外显子21中L858R替代突变的局部晚期或转移性NSCLC患者的疗效与安全性。分析显示,Rybrevant与Lazcluze与活性对照药物相比,可将疾病进展或死亡风险降低30%,联合疗法与活性对照药物组患者的中位无进展生存期(PFS)分别为23.7个月与16.6个月。此外,联合疗法组的中位DOR比活性对照药物长9个月(25.8个月vs16.7个月),这是该研究的次要终点。
(7)默沙东公布Welireg的3期临床数据,治疗晚期RCC
近日,默沙东(MSD)公布了旗下“first-in-class”缺氧诱导因子-2α(HIF-2α)抑制剂Welireg(belzutifan)用于治疗晚期透明细胞肾细胞癌(RCC)患者的积极3期试验结果。第一次中期分析显示,两组的中位PFS均为5.6个月;18个月时,belzutifan组与活性对照组中,分别有24.0%与8.3%的受试者存活且疾病没有产生进展(P=0.002)。此外,belzutifan组患者的客观缓解率超过活性对照组患者6倍。有21.9%的belzutifan组患者(95% CI:17.8-26.5)达成客观缓解,此数值在活性对照组中仅有3.5%(95% CI:1.9-5.9),两者差异具统计学意义(P<0.001)。在中位随访时间为25.7个月的第二次中期分析时,belzutifan组和活性对照组患者的中位OS分别为21.4个月和18.1个月;18个月时,分别有55.2%和50.6%的受试者存活(HR=0.88;95% CI:0.73-1.07;P=0.20)。
(8)艾伯维和Genmab公布双特异性抗体疗法Tepkinly的1/2期积极临床结果
近日,艾伯维和Genmab公布双特异性抗体疗法Tepkinly(epcoritamab)的1/2期积极临床结果,欧盟委员会已经批准Tepkinly(epcoritamab)扩展适应症,用于治疗复发或难治性(R/R)滤泡性淋巴瘤(FL)成人患者,这些患者先前接受过2线以上的系统性疗法。新闻稿表示,Tepkinly是欧盟批准用于治疗R/R FL和R/R弥漫性大B细胞淋巴瘤(DLBCL)的首款皮下注射T细胞接合双特异性抗体。值得一提的是,这款创新疗法也被行业媒体Evaluate列为2023年的十大潜在重磅疗法之一。分析显示,患者的总缓解率(ORR)达83%,完全缓解率(CR)为63%。此外,在中位随访时间为16.2个月时,中位缓解持续时间(DoR)为21.4个月。
(9)Arthrosi Therapeutics公布潜在“best-in-class”痛风疗法AR882的2a期临床结果
近日,Arthrosi Therapeutics公布潜在“best-in-class”痛风疗法AR882的2a期临床结果,美国FDA授予其在研疗法AR882快速通道资格,用于治疗痛风患者。这些患者具有临床可见的痛风石。快速通道资格旨在促进开发和加速审评用于治疗严重疾病并具有未被满足医疗需求的药物。AR882是一种潜在“best-in-class”的强效促尿酸排泄药物,正在开发用于治疗痛风。在一项针对痛风患者的2a期研究(研究201)中,AR882(50 mg)使93%患者的血液尿酸水平降低至<5 mg/dL,而服用两种活性对照药物的患者分别只有11%和33%达到了这一水平。这种强效作用显示AR882在减少痛风发作和消除痛风石方面具有很大的潜力。
(10)第一三共与阿斯利康公布重磅抗体偶联药物Enhertu的3期临床结果
近日,第一三共(Daiichi Sankyo)与阿斯利康(AstraZeneca)公布了联合开发的重磅抗体偶联药物(ADC)Enhertu(trastuzumab deruxtecan)的3期临床结果。分析显示:在HER2低表达患者中,与化疗相比,Enhertu通过盲法独立中心审查(BICR)将疾病进展或死亡风险降低了38%(HR=0.62;95% CI:0.51-0.74;p<0.0001)。Enhertu组的中位无进展生存期(PFS)为13.2个月,而化疗组为8.1个月。在整体试验人群中,Enhertu与化疗相比,疾病进展或死亡风险降低了37%,中位PFS为13.2个月,而化疗组为8.1个月(HR=0.63;95% CI:0.53-0.75;p<0.0001)。此外,预定的探索性分析显示,在HER2低表达和HER2超低表达患者中,患者PFS的临床显著改善表现一致。在HER2超低表达患者中,Enhertu将疾病进展或死亡风险降低了22%,中位PFS为13.2个月,而化疗组为8.3个月(HR=0.78;95% CI:0.50-1.21)。
同期事件:
1. 2024年第34周08.19-08.25国内创新药/改良型新药申请临床/获批临床/申请上市/获批上市数据分析
2. 2024年第34周08.19-08.25国内仿制药/生物类似物申报/审批数据分析
3. 2024年第34周08.19-08.25国内医药大健康行业政策法规汇总
4. 2024年第34周08.19-08.25全球医药大健康行业投融资数据
以上内容均来自{摩熵咨询医药行业观察周报(2024.08.19-2024.08.25)},如需查看或下载报告,可点击!
<END>
想要解锁更多药物研发信息吗?查询摩熵医药数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!


















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论