1.5.1 本周全球TOP10创新药研发进展
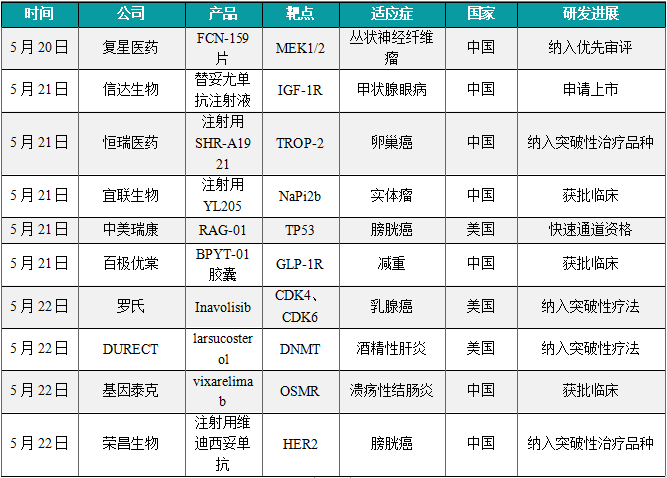
(1)复星医药MEK1/2抑制剂拟纳入优先审评
5月20日,CDE官网公示,复星医药FCN-159片拟纳入优先审评,拟用于治疗2岁及2岁以上儿童1型神经纤维瘤病(NF1)相关的丛状神经纤维瘤(PN)。FCN-159是一款口服选择性MEK1/2抑制剂。1型神经纤维瘤病(NF1)是由NF1基因突变所致的常染色体显性遗传病,以多发性进展性肿瘤和非肿瘤表现为特征。20%~50%的1型神经纤维瘤病表现为丛状神经纤维瘤(PN)。PN沿神经生长并累及神经多分支,多数在儿童期被诊断并在此期间生长最快,且多数逐年增大,破坏肌肉组织、骨骼组织甚至内脏,引起疼痛、功能障碍、毁容和恶变等并发症。根据CDE官网,这是继成人树突状细胞和组织细胞肿瘤适应症之后,FCN-159第二次被拟纳入优先审评。
(2)信达生物IGF-1R抗体申报上市,治疗甲状腺眼病
5月21日,信达生物宣布替妥尤单抗注射液的新药上市申请已获CDE受理,用于甲状腺眼病(Thyroid Eye Disease,TED)的治疗。替妥尤单抗(研发代号:IBI311)是一款重组抗胰岛素样生长因子1受体(IGF-1R)抗体。IGF-1R是一种跨膜酪氨酸激酶受体,在发育、代谢及免疫调节中发挥作用,并在TED患者的OFs、B细胞、T细胞中过表达。替妥尤单抗可阻断IGF-1等相关配体或激动型抗体介导的IGF-1R信号通路激活,减少下游炎症因子的表达,从而抑制OFs活化导致的透明质酸和其他糖胺聚糖合成,减轻炎症反应。
(3)恒瑞医药ADC疗法纳入突破性治疗品种,治疗卵巢癌
5月21日,CDE官网公示,恒瑞医药注射用SHR-A1921拟纳入突破性治疗品种,针对适应症为铂耐药复发上皮性卵巢癌、输卵管癌或原发性腹膜癌。根据恒瑞医药公开资料,这是其自主研发的靶向TROP-2的抗体偶联药物(ADC),此前该药治疗铂耐药复发上皮性卵巢癌已经被美国FDA授予快速通道资格。根据恒瑞医药公开资料介绍,注射用SHR-A1921可与表达TROP-2的肿瘤细胞特异性结合,经肿瘤细胞内吞后在溶酶体内水解释放小分子毒素,从而诱导肿瘤细胞凋亡。此外,SHR-A1921具有明显的旁观者效应,可对靶细胞旁的TROP-2表达阴性的肿瘤细胞进行有效杀伤。
(4)中美瑞康小激活RNA药物获FDA快速通道资格
5月21日,中美瑞康宣布其自主研发的小激活RNA(saRNA)药物RAG-01获得美国FDA授予快速通道资格,用于治疗卡介苗无应答的非肌层浸润性膀胱癌。RAG-01是一款特异性靶向激活肿瘤抑制基因p21的双链saRNA药物,通过RNAa机制激活p21基因的表达,以抑制肿瘤细胞增殖、诱导细胞凋亡和衰老。临床前药效研究表明,通过中美瑞康自主开发的小核酸递送系统,RAG-01的治疗能够明显抑制动物模型中膀胱癌肿瘤的生长,并展示充分的安全性。
(5)宜联生物NaPi2b靶向ADC获批临床
5月21日,CDE官网公示,宜联生物申报的1类新药注射用YL205获得临床试验默示许可,拟开发治疗晚期实体瘤。根据宜联生物官方公开资料,YL205是特异性靶向NaPi2b的下一代抗体偶联药物(ADC),以新型拓扑异构酶I抑制剂为有效载荷。NaPi2b由SLC34A2编码,是2型钠依赖性磷酸盐转运蛋白SLC34家族的三个成员之一。SLC34家族通过跨上皮膜运输磷酸盐,在全身磷酸盐稳态中起关键作用。NaPi2b是一种细胞表面钠依赖性磷酸盐转运蛋白。临床前和早期临床研究表明,NaPi2b在高级别浆液上皮性卵巢癌、输卵管癌和原发性腹膜癌,以及甲状腺癌、乳腺癌、非鳞状非小细胞肺癌中表达,而在正常组织中表达有限,因此其有望作为卵巢癌等癌症治疗的靶点。根据公开资料查询,YL205是全球范围内较早一批进入到临床研究阶段的靶向NaPi2b的ADC。
(6)百极优棠口服GLP-1R激动剂获批临床,用于减重
5月21日,百极优棠申报的1类新药BPYT-01胶囊获得临床试验默示许可,拟开发用于超重和肥胖。公开资料显示,BPYT-01是一款口服小分子GLP-1促泌剂,此前其针对2型糖尿病的临床试验申请已获得CDE批准,并已经完成1期临床研究首剂量入组。BPYT-01是中国科学院上海药物研究所和西双版纳热带植物园基于对药用植物资源开发过程发现的活性化学单体,与百极优棠合作,通过合成工艺开发的小分子GLP-1促泌剂。口服给药后,BPYT-01选择性分布于肠道组织,通过全新作用机制直接促进肠L细胞分泌GLP-1,提高内源性GLP-1水平,显示出与多肽类GLP-RA作用类似的饱腹中枢抑制、摄食减少、体重减轻、高血糖症状改善、受损胰岛β细胞保护等作用。
(7)罗氏小分子联合疗法获FDA授予突破性疗法认定
5月22日,罗氏公司今天宣布,美国FDA授予其在研口服小分子inavolisib联合CDK4/6抑制剂Ibrance(palbociclib)和氟维司群(fulvestrant)突破性疗法认定,用于治疗肿瘤带有PIK3CA突变、激素受体(HR)阳性、人类表皮生长因子受体2(HER2)阴性局部晚期或转移性乳腺癌成年患者。Inavolisib是一种口服疗法,具有高度的体外PI3Kα抑制效力和选择性,能够特异性触发PI3Kα蛋白突变体的分解。通过这种独特的双重作用机制,inavolisib可能为HR阳性/HER2阴性、PIK3CA突变的晚期乳腺癌患者提供耐受良好、持久的疾病控制和潜在改善的结局。
(9)DURECT突破性疗法3期临床即将启动,肝病死亡率降低58%
5月22日,DURECT公司宣布,美国FDA授予其在研疗法larsucosterol突破性疗法认定,用于治疗重度酒精性肝炎(AH)患者。DURECT正在计划启动注册性3期临床试验以确认larsucosterol的有效性和安全性。去年11月公布的结果显示与安慰剂相比,30毫克组患者的90天死亡率降低57%(p=0.014),90毫克组患者的90天死亡率降低58%(p=0.008)。Larsucosterol是一种内源性的硫酸化氧固醇,也是一种表观遗传调节剂。DNA高甲基化是表观遗传失调的一个例子,它会导致转录组重编程和细胞功能障碍,并且已在许多急性(例如AH)和慢性疾病(例如代谢功能障碍相关脂肪性肝炎)中观察到。Larsucosterol为一款DNA甲基转移酶(DNMT1、DNMT3a和3b)抑制剂,可通过抑制DNA甲基化,调节与应激反应、细胞死亡和存活以及脂质生物合成相关的细胞信号通路中基因的表达。
(10)基因泰克OSMR抗体在中国获批临床,治疗溃疡性结肠炎
5月22日,CDE官网公示,基因泰克公司申报的1类新药vixarelimab注射液获批临床,拟开发治疗溃疡性结肠炎。根据公开资料,vixarelimab(RG6536)是一款潜在“first-in-class”阻断OSMRβ的全人源单克隆抗体,目前在国际上处于2期临床阶段。Vixarelimab正是一种选择性OSMRβ靶向的全人源单克隆抗体,它可阻断OSM和IL-31信号传导,同时保留通过LIFR通路的信号传导。该产品治疗结节性痒疹的临床2a期试验此前已经达到主要终点,并获得美国FDA授予突破性疗法认定,用于治疗与结节性痒疹相关的瘙痒。
(11)荣昌生物靶向HER2的ADC纳入突破性治疗品种,治疗膀胱癌
5月22日,CDE官网公示,荣昌生物申报的注射用维迪西妥单抗拟纳入突破性治疗品种,针对适应症为联合特瑞普利单抗注射液围手术期治疗存在HER2表达且计划进行根治性膀胱切除术的肌层浸润性膀胱癌。维迪西妥单抗是荣昌生物研发的靶向HER2的抗体偶联药物(ADC),目前已有胃癌、尿路上皮癌两大适应症获批上市。目前,荣昌生物正在探索维迪西妥单抗与PD-1抑制剂、化疗等联合方案治疗多种实体瘤的潜力。特瑞普利单抗正是一款以PD-1为靶点的单抗药物。
1.5.2本周全球TOP10积极/失败临床结果
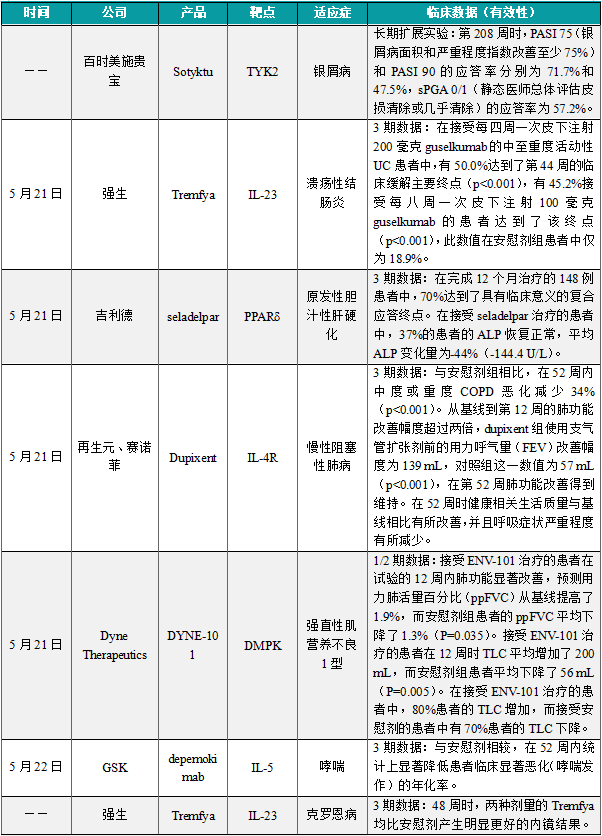
(1)百时美施贵宝TYK2抑制剂长期临床数据公布,疗效维持达4年
近日,百时美施贵宝公布了选择性酪氨酸激酶2(TYK2)抑制剂Sotyktu(deucravacitinib,氘可来昔替尼)治疗中重度斑块状银屑病成人患者的POETYK PSO长期扩展(LTE)试验的最新4年结果。数据显示第208周时,PASI 75(银屑病面积和严重程度指数改善至少75%)和PASI 90的应答率分别为71.7%和47.5%,sPGA 0/1(静态医师总体评估皮损清除或几乎清除)的应答率为57.2%。Sotyktu是一种具有独特作用机制的口服、选择性TYK2变构抑制剂。百时美施贵宝的科学家们设计Sotyktu来选择性地靶向TYK2,从而抑制IL-23、IL-12和I型干扰素(IFN)的信号传导,而这些细胞因子都是参与多种免疫介导疾病发病机制的关键细胞因子。Sotyktu通过与TYK2的调节结构域的高度选择性结合,促成对TYK2及其下游功能的变构抑制。在治疗剂量下,Sotyktu不会抑制JAK1、JAK2或JAK3。
(2)强生IL-23抑制剂3期实验达主要终点,近半溃疡性结肠炎患者达缓解
5月21日,强生公布其抗IL-23抗体Tremfya(guselkumab)在QUASAR临床3期维持研究中,用于治疗中度至重度活动性溃疡性结肠炎(UC)患者的首批数据。Guselkumab是一款通过与IL-23受体的p19亚基结合,选择性抑制IL-23信号传导的人源化单克隆抗体。目前,guselkumab已在美国、加拿大、日本和许多其他国家/地区获得批准,用于治疗中重度斑块状银屑病,以及银屑病关节炎。分析显示,guselkumab达到试验主要终点,在接受每四周一次皮下注射200毫克guselkumab的中至重度活动性UC患者中,有50.0%达到了第44周的临床缓解主要终点(p<0.001),有45.2%接受每八周一次皮下注射100毫克guselkumab的患者达到了该终点(p<0.001),此数值在安慰剂组患者中仅为18.9%。
(3)吉利德PPARδ激动剂3期结果积极,多项肝指标获改善
5月21日,吉利德科学今天公布进行中ASSURE研究的积极中期结果。Seladelpar为一款在研、口服、潜在“first-in-class”的强效选择性过氧化物酶体增殖物活化受体δ(PPARδ)激动剂。分析显示,在完成12个月治疗的148例患者中,70%达到了具有临床意义的复合应答终点。在接受seladelpar治疗的患者中,37%的患者的ALP恢复正常,平均ALP变化量为-44%(-144.4 U/L)。接受其在研药品seladelpar治疗的成人原发性胆汁性肝硬化(PBC)患者的胆汁淤积生物标志物与炎症反应减少,且患者的瘙痒程度获得改善。美国FDA已接受seladelpar用于治疗PBC患者的新药申请并授予其优先审评资格,其中包含用于治疗瘙痒症状以及那些对熊去氧胆酸(UDCA)应答不足或不耐受的非肝硬化或代偿性肝硬化的成人患者。
(4)再生元/赛诺菲重磅抗炎药Dupixent 3期结果公布,COPD首款靶向疗法
5月21日,再生元和赛诺菲在展示了3期临床试验NOTUS的最新数据。该试验评估了Dupixent(dupilumab)用于辅助治疗症状无法控制的慢性阻塞性肺病(COPD)成人患者的疗效。数据显示,接受Dupixent治疗的患者(n=470)与安慰剂组(n=465)相比:在52周内中度或重度COPD恶化减少34%(p<0.001)。从基线到第12周的肺功能改善幅度超过两倍,dupixent组使用支气管扩张剂前的用力呼气量(FEV)改善幅度为139 mL,对照组这一数值为57 mL(p<0.001),在第52周肺功能改善得到维持。在52周时健康相关生活质量与基线相比有所改善,并且呼吸症状严重程度有所减少。。新闻稿指出,这些数据支持Dupixent成为十多年来治疗COPD的首款新疗法,也是治疗COPD的首款靶向疗法。
(5)Dyne抗体偶联反义寡核苷酸疗法DYNE-101积极结果公布
5月21日,Dyne Therapeutics公布了分别用于治疗强直性肌营养不良1型(DM1)的抗体偶联反义寡核苷酸(ASO)疗法DYNE-101的积极1/2期临床试验结果。ENV-101旨在通过抑制过度激活的Hedgehog(Hh)信号通路来提高患者的肺功能并逆转患者肺部的纤维化。试验数据显示,接受ENV-101治疗的患者在试验的12周内肺功能显著改善,预测用力肺活量百分比(ppFVC)从基线提高了1.9%,而安慰剂组患者的ppFVC平均下降了1.3%(P=0.035)。接受ENV-101治疗的患者在12周时TLC平均增加了200 mL,而安慰剂组患者平均下降了56 mL(P=0.005)。在接受ENV-101治疗的患者中,80%患者的TLC增加,而接受安慰剂的患者中有70%患者的TLC下降。
(6)GSK长效哮喘疗法3期实验达主要终点,半年给药一次
5月22日,GSK公布其两项关键3期临床试验SWIFT-1和SWIFT-2的积极结果。分析显示,GSK在研单抗depemokimab达到两项试验的主要终点,即与安慰剂相较,在52周内统计上显著降低患者临床显著恶化(哮喘发作)的年化率。在两项试验中,接受depemokimab或安慰剂治疗患者中,由于治疗引起的不良事件的总体发生率和严重程度相似。根据新闻稿,depemokimab可能成为仅须每6个月给药一次、用于治疗严重哮喘的首个获批超长效生物制品。
(7)强生IL-23单抗达3期主要终点,治疗克罗恩病
近日,强生公布其IL-23靶向抗体Tremfya(guselkumab)在中度至重度活动性克罗恩病(CD)成人患者中的首个3期试验结果。分析显示,两种皮下维持剂量(每4周200毫克[q4w]和每8周100毫克[q8w])的Tremfya均优于安慰剂和Stelara。数据显示,与安慰剂相比,两种维持剂量的Tremfya均达到了复合共同主要终点。48周时,两种剂量的Tremfya均比Stelara产生明显更好的内镜结果。Tremfya高剂量与低剂量队列患者的内镜应答(endoscopic response)率分别为52.7%(p<0.001)与47.9%(p=0.009),Stelara组队列在此数值上为37.1%。而在内镜缓解(endoscopic remission)率此一指标上,Tremfya高剂量与低剂量队列患者分别为37.2%(p=0.001)与33.2%(p=0.024),相较之下Stelara组在此数值上仅为24.7%。
(8)Rezolute小分子RZ402达2期临床主要终点,治疗糖尿病性黄斑水肿
近日,Rezolute公布其在研小分子RZ402用于治疗糖尿病性黄斑水肿(DME)患者2期试验的积极结果,这些患者以往未接受过或接受过有限抗血管生长因子(anti-VEGF)注射。RZ402是一种口服、选择性和强效的小分子血浆激肽释放酶抑制剂(PKI),用于慢性治疗糖尿病性黄斑水肿。分析显示,RZ402达到黄斑水肿改善与安全性的两个主要终点。与安慰剂相比,接受所有RZ402剂量水平患者的CST均显著改善(最高达约50微米;p=0.02),且在研究过程中和治疗结束时,患者的CST持续呈下降趋势。
(9)辉瑞ADC疗法临床结果积极,治疗非小细胞肺癌
5月24日,辉瑞公司的抗体偶联药物(ADC)sigvotatug vedotin在治疗非小细胞肺癌(NSCLC)的1期临床试验中获得积极结果。基于这一结果,辉瑞已经启动关键性3期临床试验,评估这款ADC作为二线或三线疗法,治疗非鳞状NSCLC患者的效果。Sigvotatug vedotin是一款靶向整合素β6(IB6)的抗体偶联药物,最初由Seagen公司开发,对抗体的工程化改造让sigvotatug vedotin对IB6具有特异性,不与其它整合素结合,从而提高了该ADC的肿瘤选择性。在1期临床试验中,确认客观缓解率(cORR)为19.5%。而在未接受过紫杉烷治疗的非鳞状NSCLC患者亚群中,cORR达到32.5%。
(10)赛诺菲BTK抑制剂rilzabrutinib达2期临床主要终点
5月24日,赛诺菲(Sanofi)宣布其潜在“first-in-class”可逆布鲁顿氏酪氨酸激酶(BTK)抑制剂rilzabrutinib在一项2期研究中展现积极结果。Rilzabrutinib是一种口服、可逆、共价BTK抑制剂,有望成为多种免疫介导疾病的“first-in-class”或“best-in-class”治疗药物。分析显示,在第12周时,接受高剂量和低剂量rilzabrutinib治疗患者发生哮喘失控事件的相对风险分别降低了36%(OR:0.584 [0.253,1.349])和25%(OR:0.570 [0.202,1.608])。患者的哮喘症状也出现数值上显著并具临床意义的改善,哮喘控制问卷ACQ-5的最小二乘(LS)平均差异为-0.54/-0.59。ACQ-5的改善早在第2周就已观察到。
同期事件:
1. 2024年第21周05.20-05.26国内创新药/改良型新药申请临床/获批临床/申请上市/获批上市数据分析
2. 2024年第21周05.20-05.26国内仿制药/生物类似物申报/审批数据分析
3. 2024年第21周05.20-05.26国内医药大健康行业政策法规汇总
4. 2024年第21周05.20-05.26全球医药大健康行业投融资数据
以上内容均来自{摩熵咨询医药行业观察周报(2024.05.20-2024.05.26)},如需查看或下载报告,可点击!
<END>
想要解锁更多药物研发信息吗?查询摩熵医药数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!



















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论