1.4.1 本周全球TOP10创新药研发进展
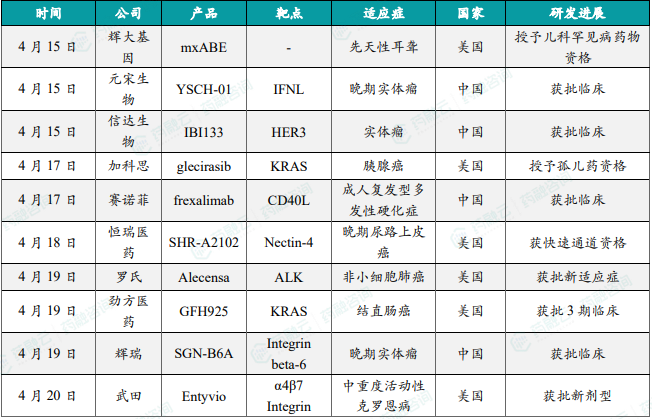
- 辉大基因新型基因疗法mxABE获FDA授予儿科罕见病药物资格
4月15日,辉大基因宣布,美国FDA授予公司的迷你型dCas13X-RNA碱基编辑器(mxABE)疗法儿科罕见病药物资格(RPDD),用于治疗OTOF(otoferlin)基因中Q829X突变相关的儿童听力损失。研究人员引入了一种通过AAV9变体传递的增强型迷你型dCas13X-RNA碱基编辑器。该疗法在人源化OTOFQ829X/Q829X小鼠中产生约80%的腺苷到肌苷转化效率,在内毛细胞实现了近100%的转染效率。在OTOFQ829X/Q829X小鼠出生后0~3天期间,研究人员观察到小鼠内毛细胞中几乎100%的OTOFQ829X表达恢复。听觉功能也明显改善,达到与野生型小鼠相似的水平,这种增强持续了至少7个月。辉大基因联合创始人陆英明博士表示,本次也是该公司第四个项目获得FDA儿科罕见病药物资格和孤儿药资格双认定。
- 元宋生物溶瘤病毒1类新药“重组L-IFN腺病毒注射液(YSCH-01)”在中国获批临床
4月15日,元宋生物宣布其溶瘤病毒1类新药“重组L-IFN腺病毒注射液(YSCH-01)”获得中国国家药品监督管理局药品审评中心(CDE)批准临床,拟用于晚期实体瘤,包括但不限于头颈部鳞癌、卵巢癌、非小细胞肺癌(NSCLC)等的治疗。“重组L-IFN腺病毒注射液”(YSCH-01)是元宋生物一款基于“癌症的靶向基因-病毒治疗(CTGVT)”策略构建的溶瘤病毒产品,该策略是将基因治疗与溶瘤病毒治疗结合起来,将抗癌基因插入到溶瘤病毒中而成,这一策略的抑瘤效果有望增加到数十甚至百倍的抗癌效果。YSCH-01的临床前研究证实,其具有双重调控、安全性高、广谱抗癌的特点。该产品此前已于2023年12月在美国获批IND。
- 信达生物1类新药HER3靶向ADC在中国获批临床
4月15日,信达生物1类新药IBI133获批临床,拟开发治疗不可切除的局部晚期或转移性实体瘤。根据信达生物公开资料,这是一款靶向HER3的抗体偶联药物(ADC)。HER3是受体酪氨酸激酶EGFR家族的成员之一,其在实体瘤中广泛表达,与肿瘤生长扩散、耐药和不良预后相关,有研究显示,HER3可能在高达75%的非小细胞肺癌(NSCLC)患者中表达,因此它也成为治疗NSCLC的潜在靶点,靶向HER3的各种药物的研发已在EGFR突变/TKI耐药的肿瘤治疗中开始展现出一定前景。信达生物已经在澳大利亚启动了IBI133治疗晚期或转移性实体瘤的1/2期、首次人体临床研究。该研究将探索IBI133单药治疗的最大耐受剂量(MTD)和推荐扩展剂量,以及该产品单药治疗在特定肿瘤人群中的疗效、安全性和耐受性。
- 加科思KRAS抑制剂glecirasib获FDA授予孤儿药资格,针对胰腺癌
4月17日,加科思宣布其KRAS G12C抑制剂戈来雷塞(glecirasib)获美国FDA授予孤儿药资格,针对适应症为胰腺癌。戈来雷塞是加科思在研的一种强效的、不可逆的KRAS G12C抑制剂,其通过共价结合于KRAS G12C的12位突变的半胱氨酸残基上,使KRAS G12C锁定在非活化状态,从而阻断KRAS依赖的信号转导,抑制肿瘤细胞增殖,并诱导细胞凋亡。戈来雷塞可作为单药用于治疗带有KRAS G12C突变的非小细胞肺癌、结直肠癌等实体瘤,与SHP2i、EGFRi等联合用药,有望实现更优疗效,以及克服继发性耐药。戈来雷塞此前已被中国国家药监局药品审评中心(CDE)纳入突破性治疗品种,用于治疗KRAS G12C突变的二线或以上胰腺癌患者。
- 赛诺菲CD40L单抗Frexalimab在中国获批临床,治疗多发性硬化
4月17日,赛诺菲(Sanofi)1类新药frexalimab注射液获得两项临床试验默示许可,分别拟开发治疗成人复发型多发性硬化(RMS)、成人非复发性继发进展型多发性硬化(nrSPMS)。Frexalimab(SAR441344)是赛诺菲在研的一种新型单克隆抗体,该产品被认为能够阻断适应性(T和B细胞)和先天性(巨噬细胞和树突状细胞)免疫细胞活化和功能所必需的共刺激CD40/CD40L细胞通路,而不会导致淋巴细胞耗竭。赛诺菲已经启动了frexalimab的两项3期临床研究,分别用于治疗成人非复发性继发进展型多发性硬化(nrSPMS)以及复发性多发性硬化(RMS)。除了针对多发性硬化,赛诺菲目前还正在2期临床研究中评估frexalimab治疗其他自身免疫性疾病的潜力,包括干燥综合征、系统性红斑狼疮、1型糖尿病等。
- 恒瑞医药Nectin-4靶向ADC获FDA快速通道资格,治疗晚期尿路上皮癌
4月18日,恒瑞医药宣布其自主研发的靶向Nectin-4的抗体偶联药物(ADC)注射用SHR-A2102获美国FDA授予快速通道资格,用于治疗晚期尿路上皮癌。Nectin-4蛋白是属于免疫球蛋白超家族的Nectin家族。Nectin家族与钙黏着蛋白共同作用,对粘着连接和紧密连接的产生和维持具有显著影响,它们调节多种细胞行为,包括细胞粘附、生长、分化、迁移和凋亡。SHR-A2102为一款靶向Nectin-4的ADC,其有效载荷是拓扑异构酶抑制剂(TOPi)。此前,该产品用于治疗晚期实体瘤的临床试验申请已获得FDA许可。SHR-A2102单药或联合其他抗肿瘤治疗用于晚期实体瘤的临床试验申请也获得中国NMPA的许可,目前已进入2期临床试验阶段。根据新闻稿,这也是该公司第4款产品获得FDA快速通道资格。
- 罗氏精准小分子抗癌疗法ALK抑制剂Alecensa再获FDA批准
4月19日,罗氏旗下基因泰克(Genentech)今日宣布,美国FDA已批准Alecensa(alectinib)作为手术切除肿瘤后的辅助治疗,用于治疗间变性淋巴瘤激酶(ALK)阳性非小细胞肺癌(NSCLC)患者(肿瘤直径≥4厘米或者存在淋巴结阳性)。Alecensa是一种ALK抑制剂,已被批准用作一线和二线治疗ALK阳性转移性NSCLC患者。它在患者中显示出显著疗效,包括那些携带CNS转移瘤的患者,现在随着这一批准,这些益处可以延伸至早期疾病患者。新闻稿指出,Alecensa是首个获批用于治疗经手术切除肿瘤的早期ALK阳性NSCLC患者的ALK抑制剂。
- 劲方医药KRAS G12C抑制剂GFH925在美国获批3期临床,治疗结直肠癌
4月19日,劲方医药宣布该公司自主研发的KRAS G12C抑制剂GFH925单药疗法获得美国FDA临床试验许可,可针对KRAS G12C突变型难治、转移性结直肠癌患者开展一项多中心、开放标签、随机对照3期试验。作为一款高效口服新分子实体化合物,GFH925通过共价不可逆修饰KRAS G12C蛋白突变体半胱氨酸残基,抑制该蛋白介导的GTP/GDP交换,从而下调KRAS蛋白活化水平。此外,GFH925抑制KRAS蛋白后可进而抑制下游信号传导通路,诱导肿瘤细胞凋亡及细胞周期阻滞,达到抗肿瘤效果。GFH925的新药上市申请已获得中国国家药监局药品审评中心(CDE)受理并纳入优先审评,同时获得两项突破性疗法认定。
- 辉瑞靶向IB6潜在“first-in-class”抗体偶联药物在中国获批临床
4月19日,Seagen公司申报的1类新药SGN-B6A获得临床试验默示许可,拟开发治疗晚期实体瘤成人患者。SGN-B6A(sigvotatug vedotin)是一款靶向整合素β6的潜在“first-in-class”抗体偶联药物(ADC),2023年3月,辉瑞(Pfizer)宣布以约430亿美元收购Seagen公司,从而将这款ADC产品纳入其研发管线。在临床前研究中,SGN-B6A已在非小细胞肺癌、胰腺癌、膀胱癌等模型中证明了体内活性和良好的安全性。此外,该产品还在治疗非小细胞肺癌患者的1期临床试验中表现出良好的安全性和令人鼓舞的抗癌活性,经确认的客观缓解率(cORR)为33.3%(n=27)。
- 武田α4β7整合素抑制剂vedolizumab皮下制剂获FDA批准
4月20日,武田(Takeda)宣布,美国FDA已批准Entyvio(vedolizumab,维得利珠单抗)皮下注射制剂,用于中度至重度活动性克罗恩病(CD)成人患者在接受Entyvio静脉注射制剂诱导治疗后的维持治疗。Entyvio是一种人源化单抗药物,作为一种肠道选择性的生物制剂,可以特异性拮抗α4β7整合素,抑制其与肠粘膜细胞粘附分子1(MAdCAM-1)的结合,但不抑制其与血管细胞粘附分子1(VCAM-1)的结合。此次批准主要基于关键3期临床试验VISIBLE 2的数据,在第52周,与安慰剂相比,接受Entyvio皮下注射制剂的患者临床缓解率显著增加,为48.0%(132/275),安慰剂组为34.3%(46/134),p=0.008,达到了研究的主要终点。Entyvio皮下注射制剂已在欧盟及50多个国家和地区获批上市。Entyvio静脉注射制剂已在包括美国和欧盟在内的70多个国家和地区获得上市许可。
1.4.2本周全球TOP10积极/失败临床结果
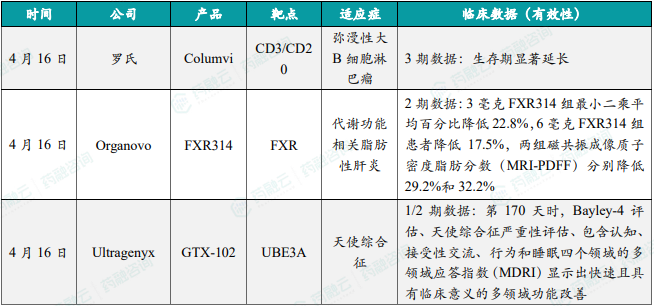
- 罗氏CD3/CD20双特异性抗体Columvi达临床3期主要终点
4月16日,罗氏(Roche)公司宣布其3期试验STARGLO达到总生存期(OS)主要终点。Columvi是一款能够同时靶向CD3与CD20的双特异性抗体。分析显示,与活性对照药物相较,使用其双特异性抗体Columvi(glofitamab)联合吉西他滨和奥沙利铂治疗的复发或难治性(R/R)弥漫性大B细胞淋巴瘤(DLBCL)患者的生存期显著延长,这些患者之前至少接受过一线治疗,并且不适合进行自体干细胞移植,安全性方面,该组合疗法的安全性与各个组分的已知安全性一致。根据新闻稿,Columvi是首个获得美国FDA加速批准和欧盟委员会有条件上市的固定时间治疗的双特异性抗体,用于治疗接受过两线或两线以上全身治疗的R/R DLBCL患者。
- Organovo靶向FXR的MASH疗法FXR314取得2期试验积极结果
4月16日,Organovo Holdings公布其在研药物FXR314用于治疗代谢功能相关脂肪性肝炎(MASH)患者的2期试验积极结果。FXR314是一款潜在“best-in-class”非类固醇、非胆汁酸的口服FXR激动剂,开发用以治疗炎症性肠病(IBD)、MASH与原发性胆汁性肝硬化。研究结果表明,与基线相较,FXR314组受试者的肝脏脂肪含量在统计学上显著降低,治疗结束时3毫克FXR314组患者的肝脂肪最小二乘平均百分比降低22.8%(p=0.0010),6毫克FXR314组患者降低17.5%(p=0.0267),而安慰剂组则降低6.1%,3毫克和6毫克FXR314组患者的磁共振成像质子密度脂肪分数(MRI-PDFF)降低>30%的受试者比例分别为29.2%(p=0.0023)和32.2%(p=0.0020),而安慰剂组为9.5%。此外,FXR314展现良好的安全性与耐受性。
- Ultragenyx反义寡核苷酸疗法GTX-102的 1/2期临床试验获得最新数据
4月16日,Ultragenyx宣布其用于治疗天使综合征(Angelman syndrome)的在研疗法GTX-102在1/2期临床试验中获得的最新数据。GTX-102可以促进神经元细胞中父系UBE3A的等位基因表达,产生患者体内所缺失的关键蛋白产物。数据分析显示,接受GTX-102治疗的扩展队列A和B的患者,在第170天时,通过Bayley-4评估的认知能力和接受性交流与自然历史数据相比,获得快速且具有临床意义的改善;通过天使综合征严重性评估检测的行为和睡眠表现显示出超过此前剂量递增队列在第170天观察到的疗效;包含认知、接受性交流、行为和睡眠四个领域的多领域应答指数(MDRI)分析结果显示,总净应答为+2.0(p<0.0001)。此外,部分剂量递增队列患者在第758天显示出长期和持续的临床益处,远超过自然历史数据。基于这些数据,该公司计划启动关键性3期临床试验。
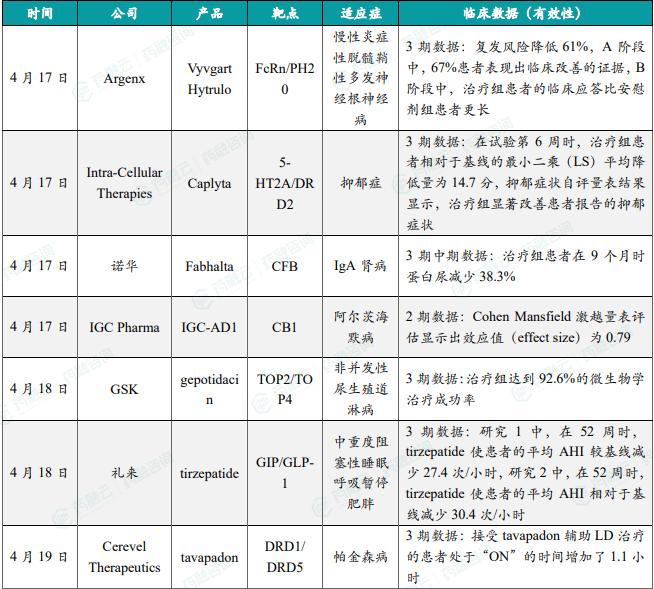
- Argenx公布潜在“first-in-class”疗法Vyvgart Hytrulo的 3期试验积极结果
4月17日,Argenx公布其3期ADHERE试验的积极数据,该试验评估其Vyvgart Hytrulo皮下注射液用于治疗慢性炎症性脱髓鞘性多发神经根神经病(CIDP)成人患者的作用。分析显示,该疗法能够显著改善CIDP患者的临床症状并降低复发风险,与安慰剂相比,接受该疗法治疗患者的复发风险降低了61%,在开放标签A阶段中,67%接受Vyvgart Hytrulo治疗的患者表现出临床改善的证据(ECI,evidence of clinical improvement),其中40%的患者在第4周达到ECI,在B阶段中,接受Vyvgart Hytrulo治疗的患者的临床应答比安慰剂组患者更长,这表现在患者复发风险具统计学与临床上的改善。该试验的数据已提交给美国FDA,作为Vyvgart Hytrulo用于治疗CIDP的补充生物制品许可申请(sBLA)的一部分。该申请于2024年2月获得优先审评资格,PDUFA目标日期为2024年6月21日。
- Intra-Cellular抑郁症小分子疗法Caplyta的3期试验达主要终点
4月17日,Intra-Cellular Therapies宣布其小分子疗法Caplyta(lumateperone)作为抑郁症(MDD)辅助疗法的3期试验(Study 501)积极顶线结果。分析显示,在试验第6周时,接受每日一次42 mg lumateperone治疗患者的Montgomery-Åsberg抑郁量表总分具有统计学和临床意义的降低。在调整后的意向治疗(mITT)人群中,lumateperone组患者相对于基线的最小二乘(LS)平均降低量为14.7分,而安慰剂为9.8分,在第6周时,与安慰剂相比,lumateperone组患者的临床整体印象-严重程度(CGI-S)评分显示具统计学与临床意义的降低(p<0.0001),该疗法达到试验主要终点与关键次要终点,可有效缓解患者抑郁症状。在这项研究中,lumateperone的总体安全性与耐受性良好。
- 诺华公布口服特异性替代补体途径因子B抑制剂Fabhalta的 3期临床中期分析结果
4月17日,诺华(Novartis)公布了其潜在重磅疗法Fabhalta(iptacopan)在治疗IgA肾病(IgAN)患者中进行的APPLAUSE-IgAN临床3期研究的预定中期分析结果。Iptacopan是一种口服特异性替代补体途径因子B抑制剂,能高效抑制补体替代通路中因子B。这项预定的中期分析包括疗效分析(250例患者)与安全性分析(443例患者)。患者24小时UPCR的数据显示,与接受安慰剂与支持性治疗的患者相比,iptacopan治疗组患者在9个月时蛋白尿减少38.3%(p<0.0001),达成试验主要终点。该研究还表明,iptacopan的耐受性与安全性良好,与之前报告的数据一致。Iptacopan曾被行业媒体Evaluate列为10款值得关注的潜在重磅疗法之一,其中原因之一在于该疗法具有治疗多种适应症的潜力。
- IGC公布阿尔茨海默病创新疗法IGC-AD1的2期临床积极结果
4月17日,IGC Pharma公司宣布其在研疗法IGC-AD1治疗阿尔茨海默病2期临床试验的中期数据。IGC-AD1是一种基于THC的复方配方,THC是大麻中具有精神活性的大麻素,IGC-AD1旨在针对神经炎症和CB1受体功能障碍。结果采用Cohen Mansfield激越量表(CMAI)评估基线和第2周测量的激越症状变化,显示出效应值(effect size)为0.79(p=0.071),表明疗法组与安慰剂组之间存在大幅度差异。迄今为止,患者已经接受超过1000剂口服给药,未观察到剂量限制性不良事件,凸显了IGC-AD1的安全性特征。新闻稿指出,在2023年获批治疗阿尔茨海默病激越症状的疗法在3期临床试验中,治疗12周后的CMAI效应值为0.5。这一结果显示了IGC-AD1作为一种治疗选择的潜力。
- GSK潜在“first-in-class”口服抗生素gepotidacin达关键性3期临床终点
4月18日,GSK宣布其潜在“first-in-class”口服抗生素gepotidacin在针对青少年和成人非并发性尿生殖道淋病的关键性3期临床试验EAGLE-1中取得积极结果。Gepotidacin由GSK科学家发现,是一种在研潜在“first-in-class”的三氮杂苊烯(triazaacenaphthylene)抗生素,通过一种创新作用机制和结合位点抑制细菌DNA复制。试验显示,gepotidacin与常见的淋病联合治疗方案(肌肉注射头孢曲松加口服阿奇霉素)相比,达到非劣效性标准,gepotidacin显示出92.6%的治疗成功率,相较之下后者的成功率为91.2%。gepotidacin的安全性和耐受性与1期和2期试验中的结果一致。受试者中最常报告的不良事件(AEs)与胃肠道(GI)相关。所有不良事件均为轻度或中度(1级或2级)。新闻稿指出,如果获批,它将成为20多年来uUTI领域首款新类型口服抗生素。
- 礼来GIP/GLP-1受体双重激动剂Tirzepatide 3期试验积极结果公布
4月18日,礼来宣布其GIP/GLP-1受体双重激动剂Tirzepatide的临床3期试验积极结果。分析显示,两项研究皆达成主要终点,无论患者是否接受PAP治疗,tirzepatide皆显著改善中重度OSA肥胖患者的睡眠呼吸暂停症状。研究1评估tirzepatide在未接受PAP治疗患者中的作用,分析显示,在52周时,tirzepatide使患者的平均AHI较基线减少27.4次/小时,安慰剂则减少4.8次/小时。研究2评估tirzepatide在正在接受并计划持续接受PAP治疗患者中的作用,在52周时,tirzepatide使患者的平均AHI相对于基线减少30.4次/小时,而安慰剂则减少6.0次/小时。根据此积极结果,礼来计划递交相关监管申请,值得一提的是,tirzepatide已获FDA授予快速通道资格,用以治疗中重度OSA肥胖患者。
- Cerevel公布帕金森小分子疗法Tavapadone关键3期试验结果
4月19日,Cerevel Therapeutics公布其帕金森病小分子疗法Tavapadone的3期试验积极顶线结果。Tavapadon是一款在研选择性D1/D5受体部分激动剂,目前正在研究将其作为单药和作为LD辅助疗法用以治疗帕金森病患者。分析显示,该试验达到主要终点。与接受LD和安慰剂治疗的患者相比,接受tavapadon辅助LD治疗的患者处于“ON”的时间增加了1.1小时,且没有出现令人困扰的运动障碍,这一结果具有临床与统计学意义(1.7小时vs. 0.6小时,p<0.0001)。此外,tavapadon治疗组还观察到“OFF”时间显著减少(关键的次要终点)。Tavapadon的总体耐受性良好。根据新闻稿,tavapadon是首个获检视用于治疗帕金森病的选择性D1/D5受体部分激动剂。
同期事件:
1.2024年第17周04.15-04.21国内创新药/改良型新药申请临床/获批临床/申请上市/获批上市数据分析
2.2024年第17周04.15-04.21国内仿制药/生物类似物申报/审批数据分析
3.2024年第17周04.15-04.21全球医药大健康行业投融资数据
以上内容均来自{药融云医药行业观察周报(2024.04.15-2024.04.21)},如需查看或下载报告,可点击!
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!


















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论