1.5.1 本周全球TOP10创新药研发进展
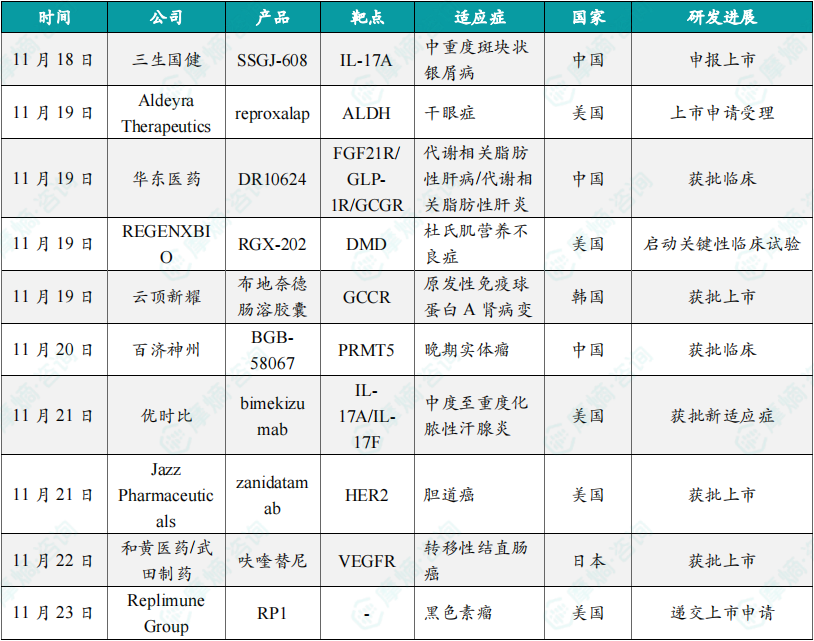
(1)三生国健重组抗IL-17A单抗新药申报上市,针对成人中重度斑块状银屑病
11月18日,三生国健宣布该公司递交的重组抗IL-17A人源化单克隆抗体注射液(SSGJ-608)上市申请已获得中国国家药品监督管理局受理,用于治疗成人中重度斑块状银屑病。SSGJ-608是三生国健自主研发的抗IL-17A创新单抗,它可特异性结合人IL-17A,并能阻断IL-17A与其受体的结合,有效抑制炎性因子的释放,达到治疗银屑病的效果。今年8月,608治疗成人中重度斑块状银屑病的关键注册性3期临床研究完成揭盲及最终统计分析,所有主要疗效终点、关键次要疗效终点和所有次要疗效终点均成功达到。根据三生国健新闻稿介绍,该产品有望实现维持治疗期给药方案间隔长,且各种疗效指标在维持治疗期持续升高并保持稳定。
(2)Aldeyra潜在“first-in-class”干眼症创新药上市申请获FDA受理
11月19日,美国FDA已受理其所重新提交用于治疗干眼症的创新眼用药物reproxalap的新药申请(NDA),该申请的PDUFA日期为2025年4月2日。Reproxalap是一款潜在“first-in-class”的在研小分子活性醛化物质抑制剂。活性醛化物质含量会在眼部或系统性发炎时上升,造成眼睛发炎、泪水分泌降低、眼睛发红以及改变泪水内脂质组成,许多干眼症患者具有较高的活性醛化物质含量。2023年10月31日,Aldeyra与艾伯维达成了一项选择权协议。根据协议条款,艾伯维可选择获得reproxalap在美国的共同独家开发、生产和商业化许可。如果艾伯维行使选择权,将向Aldeyra支付1亿美元的预付款项,此外,Aldeyra还将有资格获得最高3亿美元的监管和商业里程碑付款。
(3)华东医药长效三靶点激动剂DR10624在中国获批临床
11月19日,华东医药发布公告称其长效三靶点激动剂DR10624在中国获批临床,拟开发治疗代谢相关脂肪性肝病/代谢相关脂肪性肝炎。DR10624为华东医药控股子公司道尔生物自主研发的一款长效三靶点激动剂,其为靶向FGFR1c/Klothoβ(FGF21R)、GLP-1受体(GLP-1R)和GCG受体(GCGR)的候选创新蛋白药物,由N端靶向GLP1R/GCGR的嵌合肽段与工程化改造的IgG1 Fc融合,并在Fc的C末端融合重组的FGF21突变体。临床前研究结果显示,DR10624具有较强的代谢调节和改善的药效。根据华东医药公告,DR10624此前已经先后在中国获批临床,针对适应症包括体重管理、2型糖尿病和重度高甘油三酯血症。
(4)REGENXBIO公司潜在“best-in-class”基因疗法启动关键性临床,针对杜氏肌营养不良症
11月19日,REGENXBIO公司宣布,在研疗法RGX-202的临床试验AFFINITY DUCHENNE已进入关键性阶段并完成首位患者给药。RGX-202是一种潜在“best-in-class”的基因疗法,旨在改善杜氏肌营养不良症患者的肌肉功能和预后。RGX-202的独特之处在于编码的微抗肌萎缩蛋白中包含了关键的C末端(CT)结构域,在临床前研究中,CT结构域已被证明可保护肌肉免受收缩引起的压力并改善其自我修复能力。新闻稿指出,RGX-202是一种潜在“best-in-class”杜氏肌营养不良症(DMD)基因疗法。该公司还宣布了这一研究1/2期部分的新数据,包括首次公布患者功能性数据。
(5)云顶新耀IgA肾病新药布地奈德肠溶胶囊在韩国获得完全批准
11月19日,云顶新耀宣布韩国食品药品安全部(MFDS)已完全批准该公司的布地奈德肠溶胶囊的新药上市许可申请,用于治疗罹患原发性免疫球蛋白A肾病变(IgAN)的成人患者。布地奈德肠溶胶囊专为IgA肾病患者研制,通过特殊的迟释及缓释双重制剂工艺,将布地奈德靶向释放于回肠末端的黏膜B细胞,达到治疗IgA肾病的作用。此次布地奈德肠溶胶囊韩国获批基于全球3期临床试验NefIgArd研究,该产品已经于今年相继在中国澳门地区、中国香港地区、新加坡与中国台湾地区获批。今年7月,中国NMPA正式受理耐该产品最终临床试验阶段完整数据的补充申请,该产品有望获得NMPA获得完全批准。
(6)百济神州1类癌症创新药PRMT5抑制剂获批临床,针对晚期实体瘤
11月20日,中国国家药监局药品审评中心(CDE)官网公示,百济神州申报的1类新药BGB-58067片获得临床试验默示许可,拟开发治疗晚期实体瘤患者。根据百济神州公开资料,BGB-58067是一款PRMT5抑制剂,PRMT5是“合成致死”领域的新靶点,该公司研发的BGB-58067为第二代MTA协同PRMT5抑制剂,可选择性杀伤MTAP缺失肿瘤细胞,同时避免影响正常血液细胞。研究表明,在MTAP缺失细胞中极具活性和选择性,具有良好的血脑屏障穿透力和颅内药效,拥有理想的半衰期,可以实现每日给药。根据CDE官网查询,这是该产品首次在中国获批临床。
(7)优时比IL-17A/ IL-17F抑制剂在美国获批新适应症,治疗化脓性汗腺炎
11月21日,优时比宣布美国FDA已批准Bimzelx(bimekizumab)用于治疗中度至重度化脓性汗腺炎(HS)成人患者。Bimzelx是一款人源化的IgG1单克隆抗体,能够与IL-17A、IL-17F和IL-17AF细胞因子选择性结合。IL-17A与IL-17F具有大于50%的结构同源性和重叠的生物学功能。Bimzelx最早于2023年10月获FDA批准,用于治疗适合接受全身治疗或光疗的中重度斑块状银屑病成人患者。根据新闻稿,这次批准标志着FDA授予Bimzelx的第5项适应症。行业媒体Fierce Biotech曾称Bimzelx具有成为潜在重磅药物的潜力。
(8)Jazz Pharmaceuticals旗下突破性HER2靶向双特异性抗体获FDA加速批准
11月21日,Jazz Pharmaceuticals公司宣布,美国FDA已加速批准与Zymeworks联合开发的双特异性抗体Ziihera(zanidatamab)上市,用于治疗经FDA批准检测确诊为HER2阳性(IHC 3+)的经治无法切除或转移性胆道癌(BTC)成人患者。Ziihera是一种具有新作用机制的HER2靶向双特异性抗体,可靶向HER2蛋白上两个不重复的抗原表位。FDA曾授予Ziihera突破性疗法认定,用以治疗经治HER2基因扩增胆道癌患者。Zanidatamab亦获FDA授予快速通道资格、孤儿药资格治疗胃食管腺癌。
(9)和黄医药/武田抗癌小分子抑制剂在日本上市,治疗转移性结直肠癌患
11月22日,和黄医药宣布,继FRUZAQLA®(呋喹替尼)1毫克/5毫克胶囊在日本取得定价批准,并由其合作伙伴武田(Takeda)推出商业上市用于治疗经治的转移性结直肠癌患者后,和黄医药将收到一项里程碑付款。早前,呋喹替尼已取得日本厚生劳动省(MHLW)的生产及销售批准。根据和黄医药新闻稿介绍,呋喹替尼是日本超过十年来首个获批用于治疗转移性结直肠癌的口服创新靶向疗法,无论患者的生物标志物状态如何。该产品获批用于治疗无法彻底治愈及无法切除,且化疗后病情进展的晚期或复发性结直肠癌。
(10)Replimune Group突破性溶瘤病毒疗法递交上市申请
11月23日,Replimune Group宣布,已向美国FDA提交RP1(vusolimogene oderparepvec)的生物制品许可申请(BLA),与PD-1抑制剂nivolumab联用,用于治疗先前接受过PD-1靶向疗法治疗的晚期黑色素瘤成年患者。RP1是一款基于单纯疱疹病毒(HSV)的溶瘤病毒疗法。它同时表达GALV-GP R-蛋白和粒细胞巨噬细胞集落刺激因子(GM-CSF),旨在增强肿瘤杀伤效力,癌细胞死亡的免疫原性,并激活全身性的抗肿瘤免疫反应。本次申请通过加速批准通道提交,此外,公司还宣布FDA已授予RP1联合nivolumab在相同适应症中的突破性疗法认定(BTD)。
1.5.2本周全球TOP10积极/失败临床结果
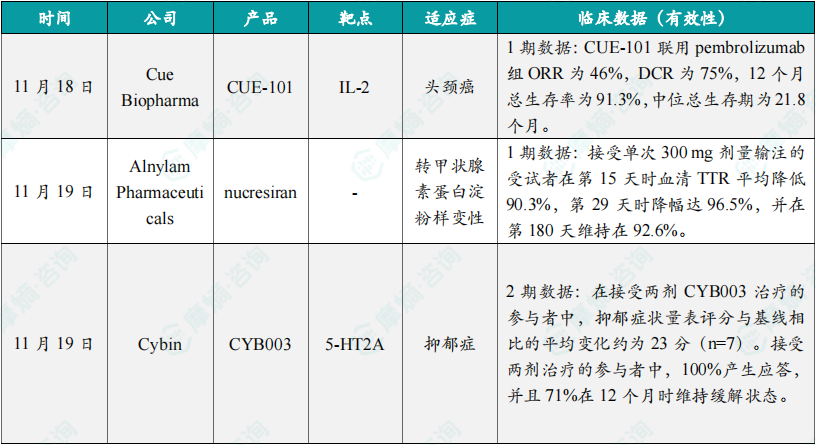
(1)Cue Biopharma旗下基于白细胞介素-2的T细胞诱导剂 1期临床数据公布
11月18日,Cue Biopharma公司公布其CUE-101治疗头颈癌的1期临床试验的积极新数据。CUE-101是该公司开发的一款基于白细胞介素-2的T细胞诱导剂,旨在选择性调节和激活HPV阳性T细胞,以提高疗效,同时减少传统免疫疗法的副作用。分析显示,接受CUE-101联用PD-1抑制剂pembrolizumab一线治疗的HPV阳性R/M HNSCC患者的客观缓解率(ORR)为46%,疾病控制率(DCR)为75%,12个月时的总生存率为91.3%,中位总生存期(OS)为21.8个月。而在历史研究KEYNOTE-048中,pembrolizumab单药治疗的ORR为19%,12个月时的总生存率为51%,中位OS为12.3个月。
(2)Alnylam下一代RNAi疗法1期临床研究最新数据亮眼,治疗罕见病
11月19日,Alnylam Pharmaceuticals公布其下一代RNAi疗法nucresiran(曾用名ALN-TTRsc04)用于治疗转甲状腺素蛋白(ATTR)淀粉样变性患者的1期临床研究最新数据。Nucresiran是一种在研RNAi疗法,通过Alnylam专有IKARIA平台所开发,旨在迅速降低突变型和野生型TTR的水平,从根本上治疗ATTR淀粉样变性。分析显示,接受单次300 mg剂量输注的受试者在第15天时血清TTR平均降低90.3%,第29天时降幅达96.5%,并在第180天维持在92.6%。数据表明,nucresiran具有每半年或每年进行一次皮下注射的潜力,详细结果公布于2024年美国心脏协会(AHA)科学年会当中。Alnylam计划在2025年第一季度公布3期临床开发方案。
(3)Cybin公司抑郁症突破性疗法2期临床结果公布,100%患者产生应答
11月19日,Cybin公司公布了在研疗法CYB003在2期临床试验中的12个月疗效数据。CYB003是该公司专有的氘代裸盖菇素类似物,正在开发用于辅助治疗抑郁症(MDD)。此前,CYB003已获得美国FDA授予的突破性疗法认定。12个月的数据显示,在接受剂量为16 mg的CYB003治疗的患者队列中,共有8名参与者完成了12个月的随访,其中7名接受了两剂CYB003的治疗。在接受两剂CYB003治疗的参与者中,抑郁症状量表(MADRS)评分与基线相比的平均变化约为23分(n=7)。接受两剂治疗的参与者中,100%产生应答,并且71%在12个月时维持缓解状态(remission)。
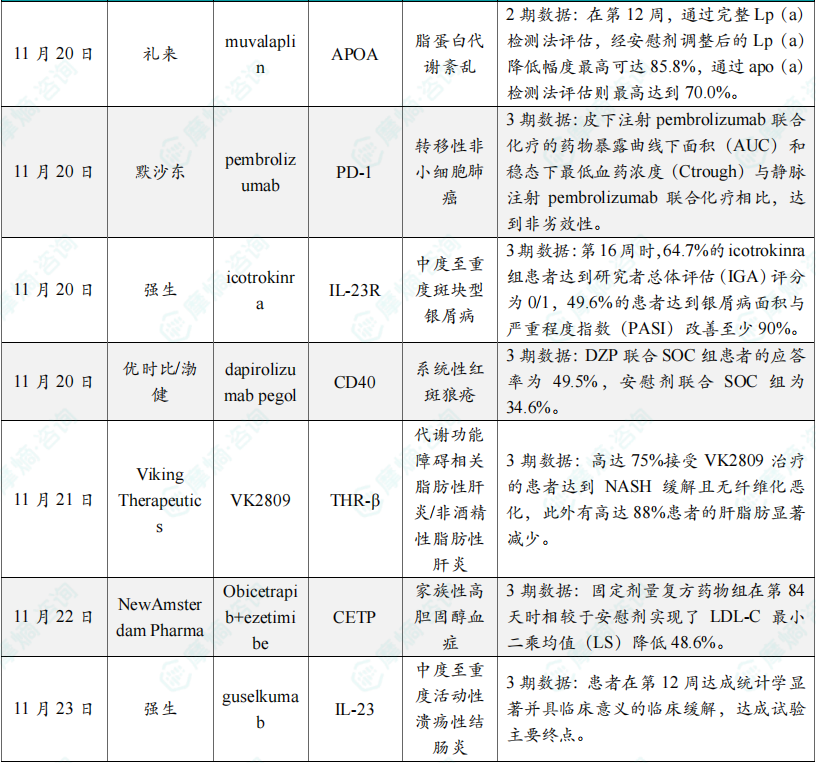
(4)礼来口服脂蛋白抑制剂2期临床结果公布,显著降低患者脂蛋白水平
11月20日,礼来公司(Eli Lilly and Company)宣布,其在研每日一次口服脂蛋白(a)——Lp(a)抑制剂muvalaplin在2期临床试验中取得了积极结果。Muvalaplin是一种口服给药的小分子,通过阻断apo(a)-apo B100相互作用,同时避免与同源蛋白纤溶酶原(plasminogen)的相互作用,抑制Lp(a)形成。2期临床数据分析显示,在第12周的主要终点中,muvalaplin(10 mg、60 mg和240 mg)显著降低患者的Lp(a)水平。通过完整Lp(a)检测法评估,经安慰剂调整后的Lp(a)降低幅度最高可达85.8%,通过apo(a)检测法评估则最高达到70.0%。在安全性方面,muvalaplin的不良事件发生率与安慰剂组相似,大部分为轻微事件,显示其良好的耐受性和安全性。
(5)默沙东pembrolizumab皮下注射制剂关键3期试验达主要终点
11月20日,默沙东宣布其关键性3期临床试验MK-3475A-D77取得了积极的顶线结果。分析显示,试验达到药代动力学(PK)的双重主要终点。结果表明,皮下注射pembrolizumab联合化疗的药物暴露曲线下面积(AUC)和稳态下最低血药浓度(Ctrough)与静脉注射pembrolizumab联合化疗相比,达到非劣效性。此外,次要终点结果显示,皮下注射pembrolizumab联合化疗的疗效和安全性与静脉注射pembrolizumab联合化疗总体一致。默沙东计划将MK-3475A-D77的研究结果提交给全球监管机构进行讨论。
(6)强生IL-23R靶向拮抗多肽icotrokinra关键性3期结果积极,近75%患者缓解
11月20日,强生公司宣布其关键性3期研究ICONIC-LEAD取得了积极的顶线结果。其潜在“first-in-class”IL-23受体(IL-23R)靶向拮抗多肽icotrokinra(JNJ-2113)达到试验双主要终点,显著改善12岁及以上中度至重度斑块型银屑病(PsO)成人和青少年患者的症状。分析显示,每日一次icotrokinra显著改善了中度至重度斑块型银屑病患者的皮肤状况。第16周时,64.7%的icotrokinra组患者达到研究者总体评估(IGA)评分为0/1(皮肤症状清除或几乎清除),49.6%的患者达到银屑病面积与严重程度指数(PASI)改善至少90%。根据新闻稿,icotrokinra是旨在阻断IL-23R的首个在研靶向口服多肽。
(7)优时比/渤健系统性红斑狼疮创新疗法3期临床结果公布,显著改善疾病活动程度
11月20日,优时比和渤健公布了3期PHOENYCS GO研究的详细结果。分析显示,该试验达到主要终点,两家公司联合开发的在研药物dapirolizumab pegol(DZP)与标准治疗(SOC)联用能够显著改善中度至重度系统性红斑狼疮(SLE)患者的疾病活动程度。Dapirolizumab pegol是一种新型、在研、靶向CD40配体(CD40L,也被称为CD154)并与聚乙二醇(PEG)偶联的抗体片段(Fab)。结果显示,DZP联合SOC组患者的应答率(49.5%)比安慰剂联合SOC组(34.6%)高出14.6%(95% CI:3.3,25.8;p=0.0110)。更高的BICLA应答率反映了基线时所有受影响器官的治疗应答,并与有意义的临床益处相关。
(8)Viking Therapeutics新型甲状腺受体β激动剂2b期临床达主、次要终点
11月21日,Viking Therapeutics公布了其新型、潜在“best-in-class”肝脏选择性甲状腺受体β亚型(TRβ)激动剂VK2809在2b期VOYAGE研究中,用以治疗代谢功能障碍相关脂肪性肝炎(MASH)/非酒精性脂肪性肝炎(NASH)患者的52周最终数据。主要终点方面,研究中的缓解率(定义为肝脂肪减少≥30%的患者比例)在第52周达到64%至88%,所有治疗队列结果均显著优于安慰剂组。在次要终点评估中,针对NASH缓解且无纤维化恶化,接受VK2809治疗患者的缓解率为63%至75%,而安慰剂组为29%。在改善纤维化且无NASH恶化的次要终点中,接受VK2809治疗的患者纤维化改善率为44%至57%,而安慰剂组为34%。
(9)NewAmsterdam小分子疗法达3期临床主要终点,降低胆固醇近50%
11月22日,NewAmsterdam Pharma宣布,3期临床试验TANDEM达到所有共同主要终点,TANDEM试验结果将支持obicetrapib(10 mg)和ezetimibe(10 mg)固定剂量复方药物全球监管申请的递交。Obicetrapib是一款口服、选择性CETP抑制剂,CETP是一种将胆固醇从高密度脂蛋白胆固醇(HDL-C,又称为好胆固醇)中转移到LDL-C(又称为坏胆固醇)中的转运蛋白。该药物适用于杂合子家族性高胆固醇血症(HeFH),动脉粥样硬化性心血管疾病(ASCVD)成人患者,或携带多项ASCVD风险因素的成人患者。分析显示,TANDEM试验达成了所有共同主要终点,固定剂量复方药物组在第84天时相较于安慰剂实现了LDL-C最小二乘均值(LS)降低48.6%(p<0.0001)。
(10)强生IL-23抗体guselkumab皮下注射制剂达主要与所有次要终点
11月23日,强生宣布已向美国FDA提交补充生物制品许可申请(sBLA),寻求批准其抗IL-23抗体Tremfya(guselkumab)作为皮下注射(SC)诱导方案,用于治疗中度至重度活动性溃疡性结肠炎(UC)的成人患者。此次申请基于3期ASTRO研究的积极数据,该研究评估了Tremfya皮下注射诱导治疗UC的疗效和安全性。患者在第0、4和8周分别接受400 mg Tremfya皮下注射诱导治疗。分析显示,患者在第12周达成统计学显著并具临床意义的临床缓解,达成试验主要终点。此外,患者亦达成所有的次要终点,包括内镜改善和组织学-内镜黏膜改善(HEMI)。ASTRO研究的安全性数据与过往试验的结果一致。
同期事件:
1. 2024年第47周11.18-11.24国内创新药/改良型新药申请临床/获批临床/申请上市/获批上市数据分析
2. 2024年第47周11.18-11.24国内仿制药/生物类似物申报/审批数据分析
3. 2024年第47周11.18-11.24国内医药大健康行业政策法规汇总
4. 2024年第47周11.18-11.24全球医药大健康行业投融资数据
以上内容均来自{摩熵咨询医药行业观察周报(2024.11.18-2024.11.24)},如需查看或下载完整版报告,可点击!
想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!



















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论