
11月1日,华海药业发布公告,称旗下子公司华奥泰生物获得新西兰药品和医疗器械安全管理局(简称“MEDSAFE”)、健康及残疾伦理委员会(简称“HDEC”)批准,在当地开展HB0056注射液的1期临床试验。

截图来源:企业公告
HB0056是一款同时靶向TSLP和IL-11的双特异性抗体,拟定适应症为哮喘。根据华海药业公告介绍,目前全球尚无其它同时靶向TSLP和IL-11的双特异性抗体进入临床。
2024年8月,公司下属子公司华奥泰向MEDSAFE及HDEC提交了HB0056注射液的临床试验申请;近日MEDSAFE及HDEC批准华奥泰在新西兰进行 HB0056注射液I期临床试验。截至目前,公司在该项目上已合计投入研发费用约人民币4,573万元。
据摩熵医药(原药融云)数据库显示,HB0056为重组人源化IgG1型双特异性抗体,同时靶向人胸腺基质淋巴细胞生成素(TSLP)以及白介素11(IL-11)。作为全球首个进入临床的同时靶向TSLP和IL-11双特异性抗体,HB0056能同时阻断IL-11与TSLP信号通路,抑制其生物学活性;其中,HB0056阻断TSLP信号通路的体外生物学活性显著优于已上市的TSLP单抗药物Tezepelumab(系 AstraZeneca 研发的上市药物)。
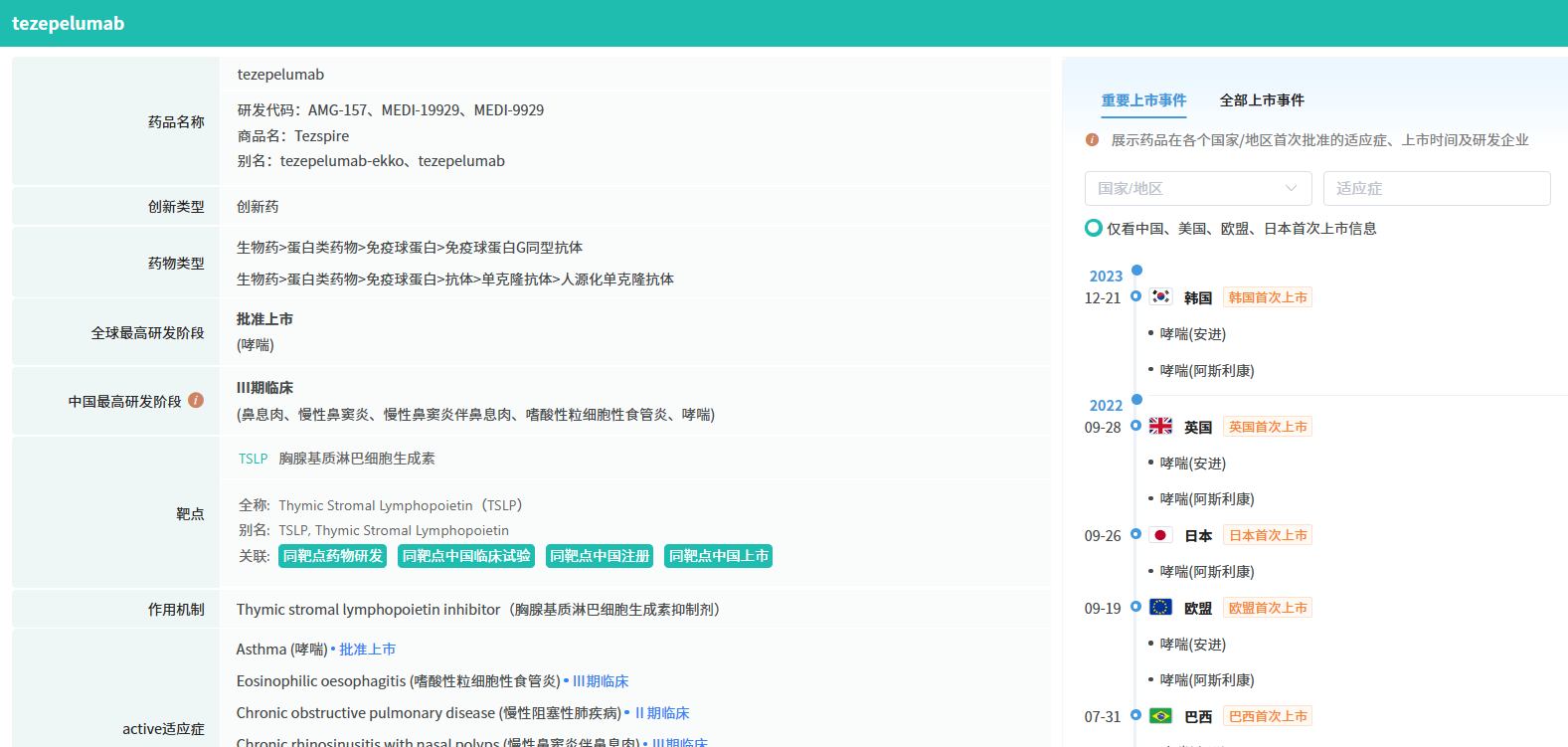
截图来源:摩熵医药全球药物研发数据库
同时,HB0056可抑制MRC-5细胞(人胚肺成纤维细胞)纤维化相关基因的表达,并在研究过程中体现出双靶点协同增 1 效的作用潜力。此外,体内药效学研究表明,HB0056对于血清OVA特异IgE、BALF灌洗液中嗜酸性粒细胞数量及肺部组织嗜酸性粒细胞浸润指标的改善效果优越,也体现出双靶点协同增效治疗哮喘的潜力。
目前全球尚无同时靶向TSLP和IL-11的双特异性抗体进入临床。对于TSLP单抗目前已有由AstraZeneca研发的上市药物Tezepelumab,被美国食品药品监督管理局获批适应症为哮喘;对于IL-11和IL-11R目前尚无已上市药物,全球范围内研究进展最快的是LassenTherapeutics的 IL-11R在研药物,目前正在临床II期,开发适应症为甲状腺眼病等。
参考来源:
[1] 企业公告
[2] 摩熵医药(原药融云)数据库
<END>
想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论