
10月25日,据CDE官网最新公示,科伦博泰申报的注射用芦康沙妥珠单抗拟纳入优先审评,用于经表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)治疗失败的局部晚期或转移性EGFR突变非小细胞肺癌成人患者。

截图来源:CDE官网
据摩熵医药(原药融云)数据库显示,芦康沙妥珠单抗是科伦博泰与默沙东(MSD)联合开发的一款靶向TROP-2的抗体偶联药物(ADC)。TROP-2抗癌药物开发的潜力靶点之一。它的过表达在肿瘤生长过程中起着关键作用,与更具侵袭性的疾病和预后不良相关。根据CDE官网查询可知,这是芦康沙妥珠单抗第三次被CDE拟纳入优先审评,也是第二次针对肺癌适应症被拟纳入优先审评。
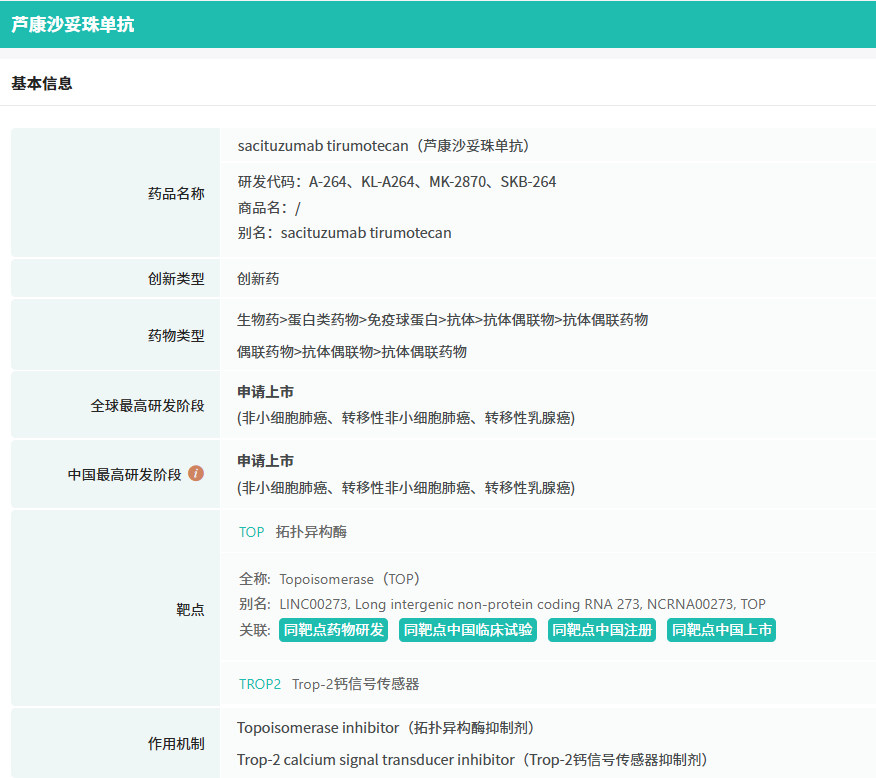
截图来源:摩熵医药(原药融云)全球药物研发数据库
目前,芦康沙妥珠单抗已有两项适应症上市申请获得CDE受理,并被纳入优先审评,分别为:用于既往至少接受过2种系统治疗的不可切除的局部晚期或转移性三阴性乳腺癌成人患者;治疗接受EGFR-TKI疗法和含铂化疗治疗失败的局部晚期或转移性EGFR突变非小细胞肺癌患者。本次是芦康沙妥珠单抗第三次拟纳入优先审评,针对适应症为:经EGFR-TKI治疗失败的局部晚期或转移性EGFR突变非小细胞肺癌成人患者。
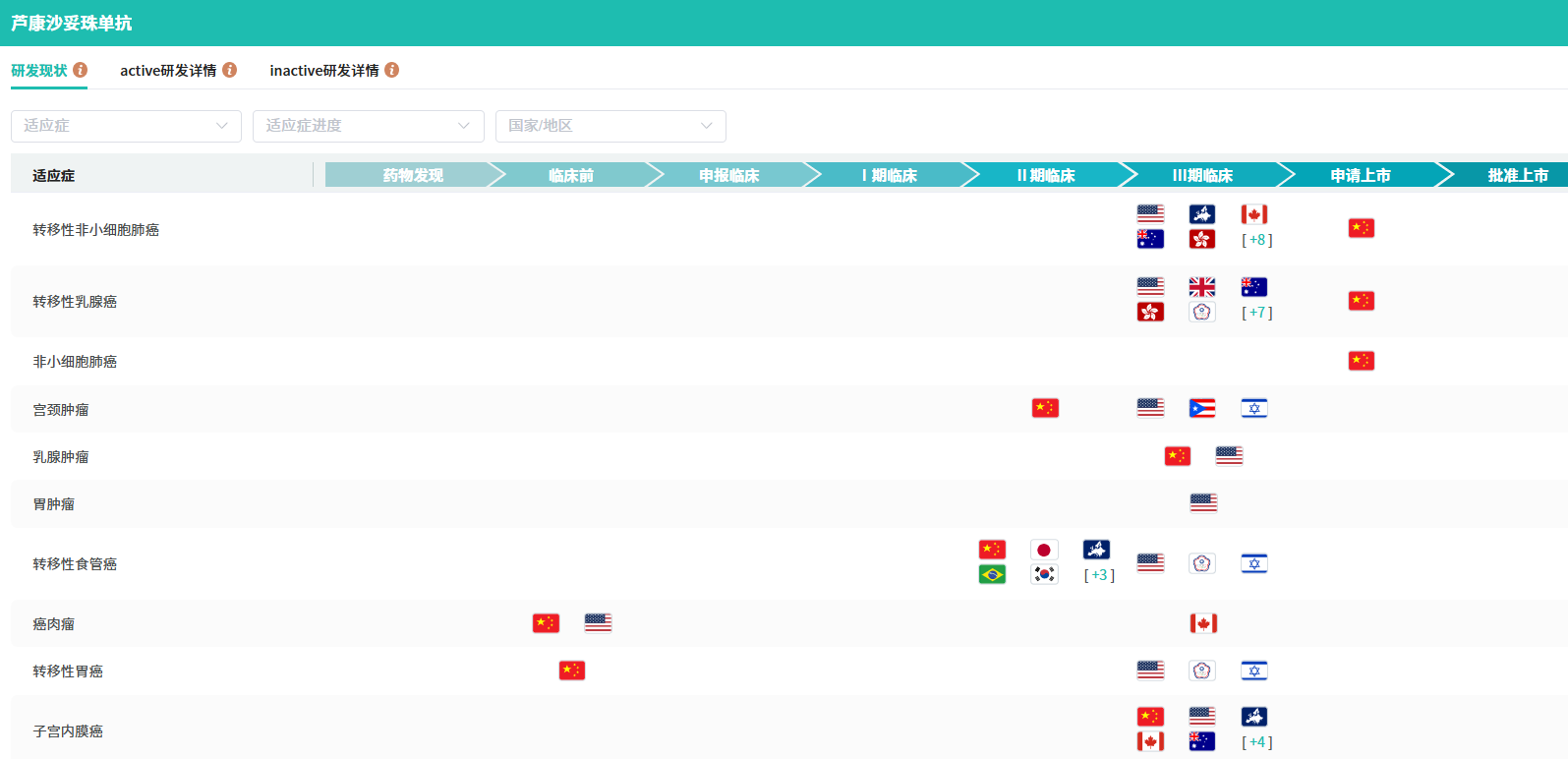
截图来源:摩熵医药(原药融云)全球药物研发数据库
根据科伦博泰今年4月发表的新闻稿介绍,目前有五项针对芦康沙妥珠单抗用于NSCLC的3期研究正在进行中。包括两项3L+ EGFR突变NSCLC患者及2L EGFR突变NSCLC患者的全球3期研究,一项在中国开展的用于2L EGFR突变NSCLC患者的3期研究,以及两项芦康沙妥珠单抗联合帕博利珠单抗用于表达PD-L1≥50%的转移性NSCLC患者及用于未获得病理完全缓解的可切除NSCLC患者的全球3期研究。
2024年美国癌症研究协会(AACR)年会公布了芦康沙妥珠单抗用于既往接受过治疗的晚期非小细胞肺癌(NSCLC)患者的2期研究的最新疗效和安全性结果。结果显示,在EGFR突变型NSCLC患者亚组(既往接受EGFR-TKI治疗期间或之后病情有所进展且其中50%的患者至少经历过1L化疗失败)中,芦康沙妥珠单抗的客观缓解率(ORR)为60%,中位无进展生存期(PFS)为11.5个月,中位总生存期(OS)为22.7个月。
本次芦康沙妥珠单抗针对新适应症被拟纳入优先审评,意味着该产品再次获得认可,并将加速来到患者身边。
<END>
想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论