
近期,NMPA正式发布了实施药品注册申请电子申报的公告,其中:
--时间为2023年1月1日起,包括了药品注册申请以及补充资料等;无需提交纸质申报资料;
--电子申报资料相关技术要求由药审中心另行发布;
--受理行政许可电子文书与纸质文书具有同等法律效力;
--2022年12月30日起,eCTD进行申报的,无需再提交纸质申报资料
此前CDE/NMPA已经发布若干电子文件相关公告等。
为提高药品审评审批效率,国家药监局决定药品注册申请申报资料实施电子形式提交,具体要求公告如下:
一、自2023年1月1日起,申请人提交的国家药监局审评审批药品注册申请以及审评过程中补充资料等,调整为以电子形式提交申报资料,申请人无需提交纸质申报资料。现有工作程序不变。
二、申请人应当按照现行法规及电子申报资料要求准备电子申报资料,将光盘提交至国家药监局药品审评中心(以下简称药审中心)提出申请。药审中心将基于电子申报资料开展受理、审评和审批工作。电子申报资料相关技术要求由药审中心另行发布。
三、自本公告实施之日起,药品注册申请受理行政许可电子文书由“药品业务应用系统”“药品eCTD注册系统”即时推送,受理行政许可电子文书与纸质文书具有同等法律效力。
四、自本公告实施之日起,申请人采用药品电子通用技术文档(eCTD)进行申报的,无需再提交纸质申报资料,其他要求仍需按照《关于实施药品电子通用技术文档申报的公告》(2021年第119号)执行。
国家药监局
2022年11月30日
此前2022年11月4日,征求意见稿有关于电子文档结构、申报资料电子光盘技术要求、关于药品注册申请电子申报有关要求等,详见:
关于注册申请电子申报,期待正式文件要求!
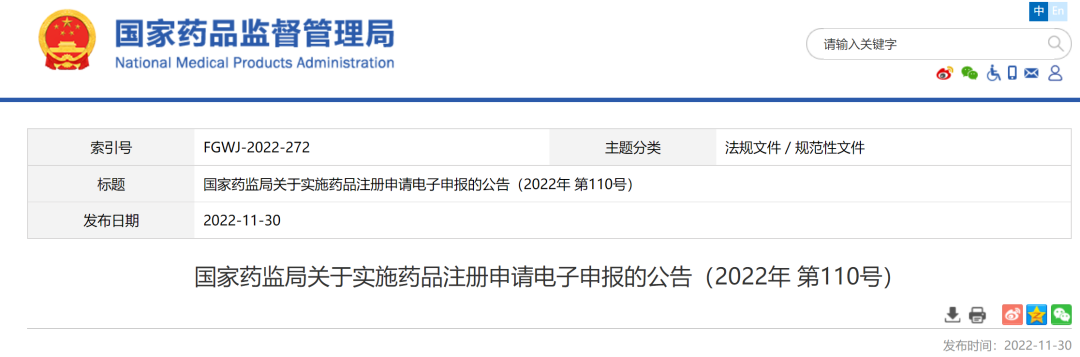
附件2
关于药品注册申请电子申报有关要求的通知
(征求意见稿)
按照国家药监局《关于药品注册申请实施电子申报的公告》要求,自2022年12月1日起,国家药监局审评审批的药品注册申请及审评过程中的补充资料等调整为以电子形式进行递交,现就电子申报具体要求通知如下:
一、电子申报资料准备
申请人应当按照现行法规、申报资料电子光盘技术要求及药品注册申请电子文档结构等相关要求准备电子申报资料(含承诺书),并将光盘寄送至药审中心提交药品注册申请。申请人需对电子申报资料进行电子签名,电子签名的申领和使用详见药审中心网站“申请人之窗”栏目“CA直通车”。
光盘盒封面及档案袋封面要求详见申报资料电子光盘技术要求。
二、电子申报资料受理与接收
(一)药审中心在收到药品注册申请光盘后5个工作日内,对申报资料进行受理形式审查。受理行政许可电子文书均由“药品业务应用系统”及“药品eCTD注册系统”推送并以短信提醒,申请人可即时查询和打印,药审中心不再邮寄受理行政许可纸质文书。
(二)对于药品注册申请形式审查不符合要求需要补正或不予受理的,或审评过程中的补充资料等不符合《药品审评中心补充资料工作程序(试行)》等相关接收要求的,申报资料光盘由药审中心按程序进行销毁处理,不再退回申请人,请申请人留好备份。
三、其他要求
(一)关于光盘数据可读性
药审中心收到申请人提交的光盘后,对可正常读取的光盘进行签收和接收;如光盘损坏或数据无法读取,药审中心将及时与申请人进行沟通并提醒重新递交,原光盘将按照销毁程序处理。
(二)关于光盘整理
申请人需按本通知要求提交2套完整电子申报资料光盘(含临床试验数据库,应单独装盒),分别供电子申报资料审评和核查使用。后续随着信息化工作逐步推进,药审中心将及时调整相关要求。
(三)关于原料药登记资料
原料药登记资料应采用PDF格式文件进行整理,电子签名等相关要求参照申报资料电子光盘技术要求。
附件3
申报资料电子光盘技术要求
(征求意见稿)
一、版面要求
本通知对于电子注册申报资料的文字体例及页面设置等要求,请参考《国家药监局药审中心关于发布〈药品注册申报资料格式体例与整理规范〉的通告》(2020年第12号)的相关要求。
二、文件格式
1.PDF格式的文件版本应为1.4、1.5、1.6、1.7或PDF/A-1、PDF/A-2。PDF文件中的内容需要符合可复制、可搜索的要求,建议申请人使用由源文件(如WORD文件)转化形成的PDF文件,不使用扫描后创建的PDF文件。如申报资料包含无法访问电子来源的文件或需要第三方签章的文件,该部分资料可以是扫描后创建的PDF文件。扫描后创建的PDF文件属于纸质文件的数字转化,建议参考中华人民共和国档案行业标准《纸质档案数字化规范》(DA/T31—2017)有关要求。对于上述需要扫描后创建的PDF文件,应启动光学字符识别(OCR)功能,确保内容可复制、可搜索。
申请人可通过以下操作检查确认内容已正确转换:一是突出显示某一文本区域;二是检索某个词或短语。若未能突出显示文本区域或检索结果中未能显示词或短语,则证明OCR并未识别该文本。
2.临床试验数据文件相关格式要求详见药审中心网站《药物临床试验数据递交指导原则(试行)》。
三、文件名称
电子申报资料文件及文件夹命名仅允许使用下列字符:汉字、英文字母“a”至“z”、数字“0”至“9”、中划线“-”和下划线“_”。对于申报资料中的任一文件,由根目录文件夹开始的所有文件夹和文件名(含扩展名)路径长度不应超过180个字符,单一文件夹或文件名称(含扩展名)长度不应超过64个字符(32个汉字)。
四、文件大小
申请人需控制申报资料中单个PDF文件在200MB以内。针对大于200MB的文件,建议申请人按照内容进行拆分,并通过标题名称来反映原文件被拆分,例如:文件标题-1、文件标题-2等。单个临床数据库文件(xpt格式)最大可允许4GB。
申报资料内容较多,容量需求较大时,申请人应使用一张DVD光盘而不是多张CD光盘进行提交。如果无法只提供一张光盘,或者大型提交不得不使用多张光盘,可按照模块进行拆分,除非单个模块大小超过光盘容量限制,否则不建议将单个模块的提交文档拆分到多张光盘上。
申请人应对中文申报资料在文件内部和文件之间建立书签和适当的超文本链接。
五、页码编制
页码编制要求请参考《国家药监局药审中心关于发布〈药品注册申报资料格式体例与整理规范〉的通告》(2020年第12号)的相关要求。
六、文件压缩、加密
申请人不得对提交的申报资料中的文件进行任何压缩处理,不得对提交的媒体介质以及申报资料中任何级别的单个文件/文件夹进行安全设置或密码保护。文件设置应允许打印及文本和图形选择。
七、电子签名要求
申请人需对申报资料中的所有PDF文件使用申请人或注册代理机构的电子签名,对申请表还需使用法定代表人的电子签名。电子签名的申领和使用详见药审中心网站“申请人之窗”栏目“CA直通车”。
药审中心将对申报资料中“申请表”章节及《承诺书》的所有PDF文件进行电子签名校验,校验不通过的申报资料将无法进入后续申报流程。
八、光盘要求
申请人准备的电子申报资料,需通过物理电子媒介提交。目前只接受一次写入型光盘作为存储介质,包括CD-R、DVD+R、DVD-R这三类。不得使用双面DVD或对提交的申报资料设置密码保护。
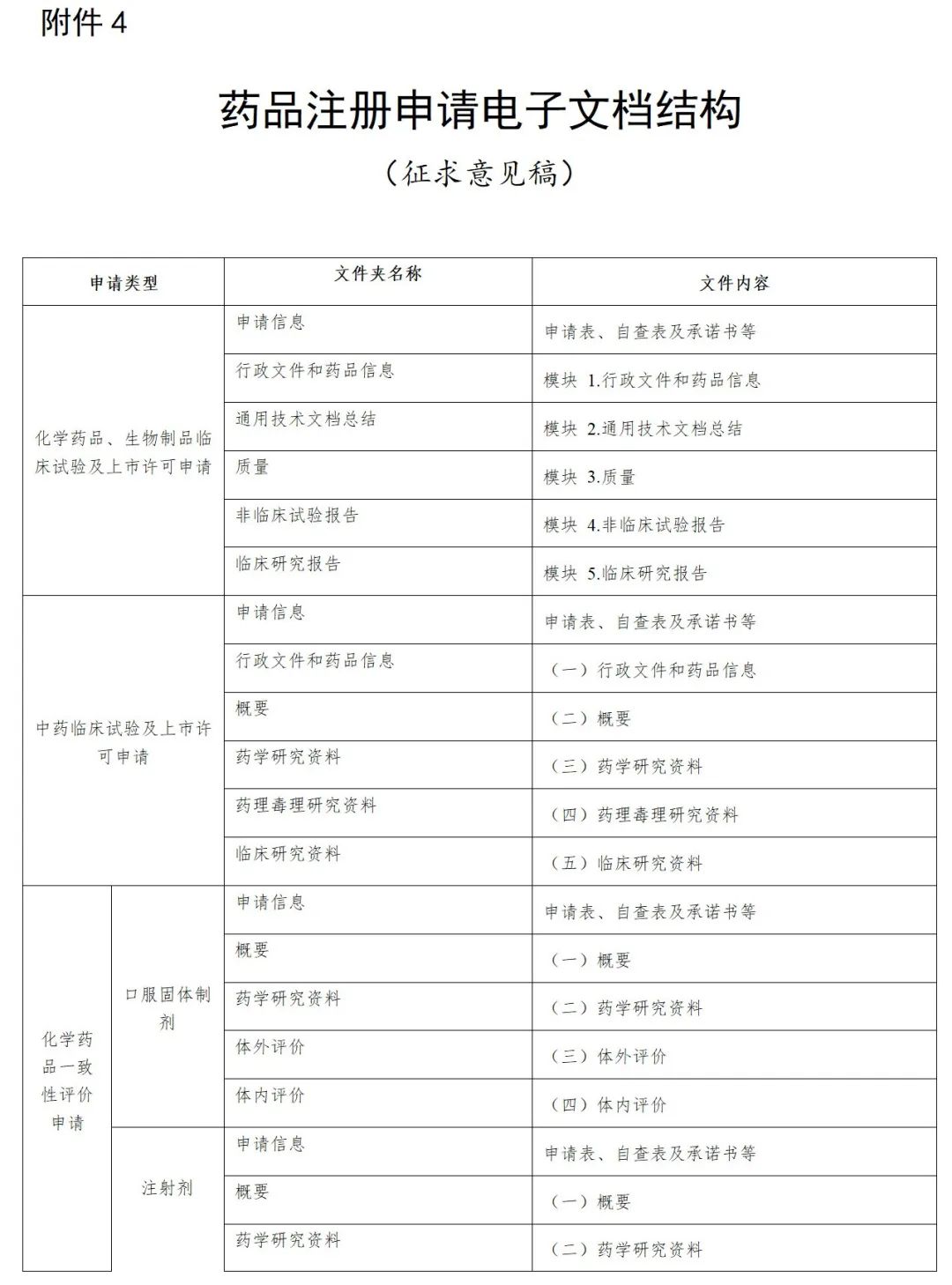
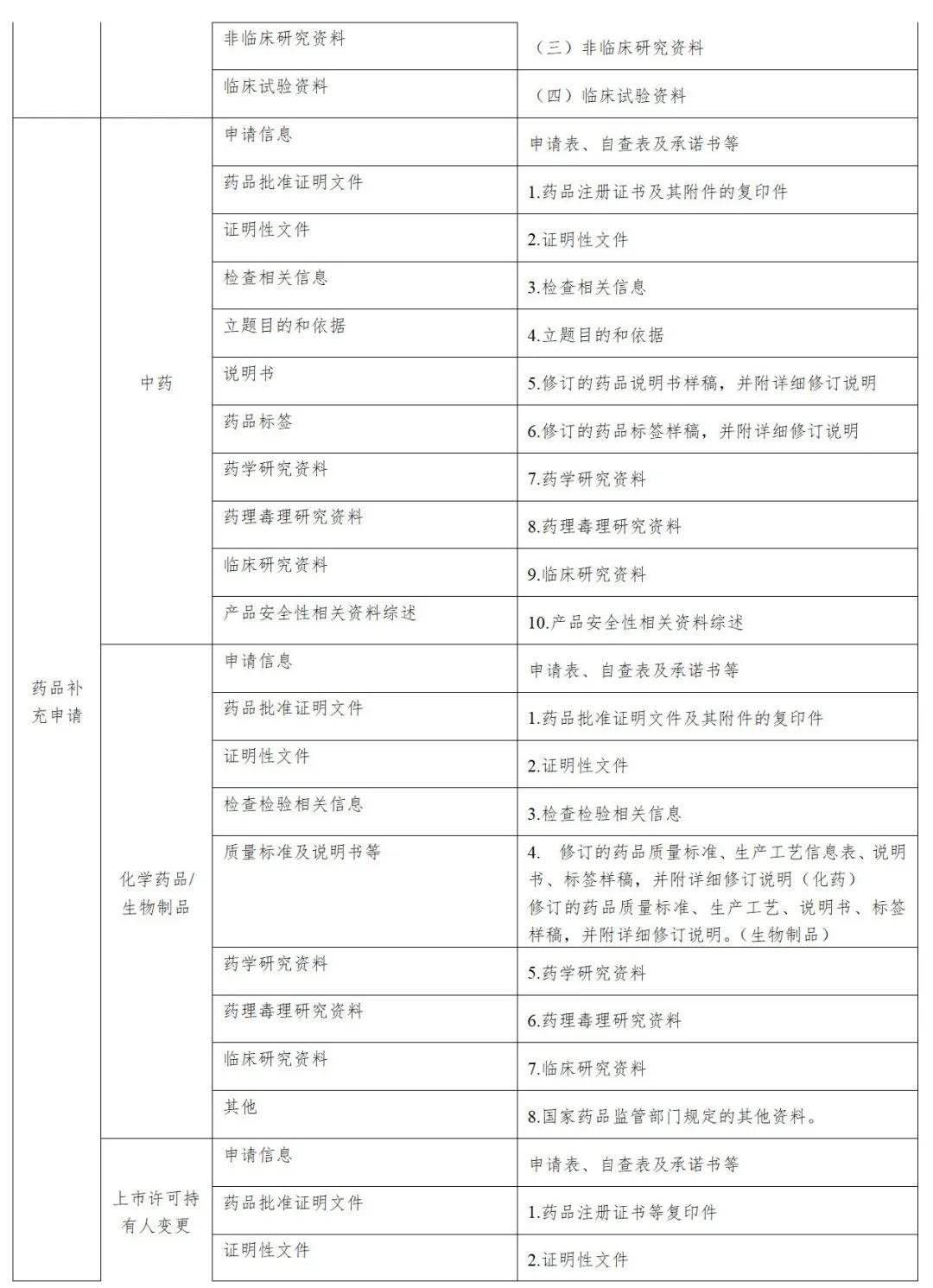
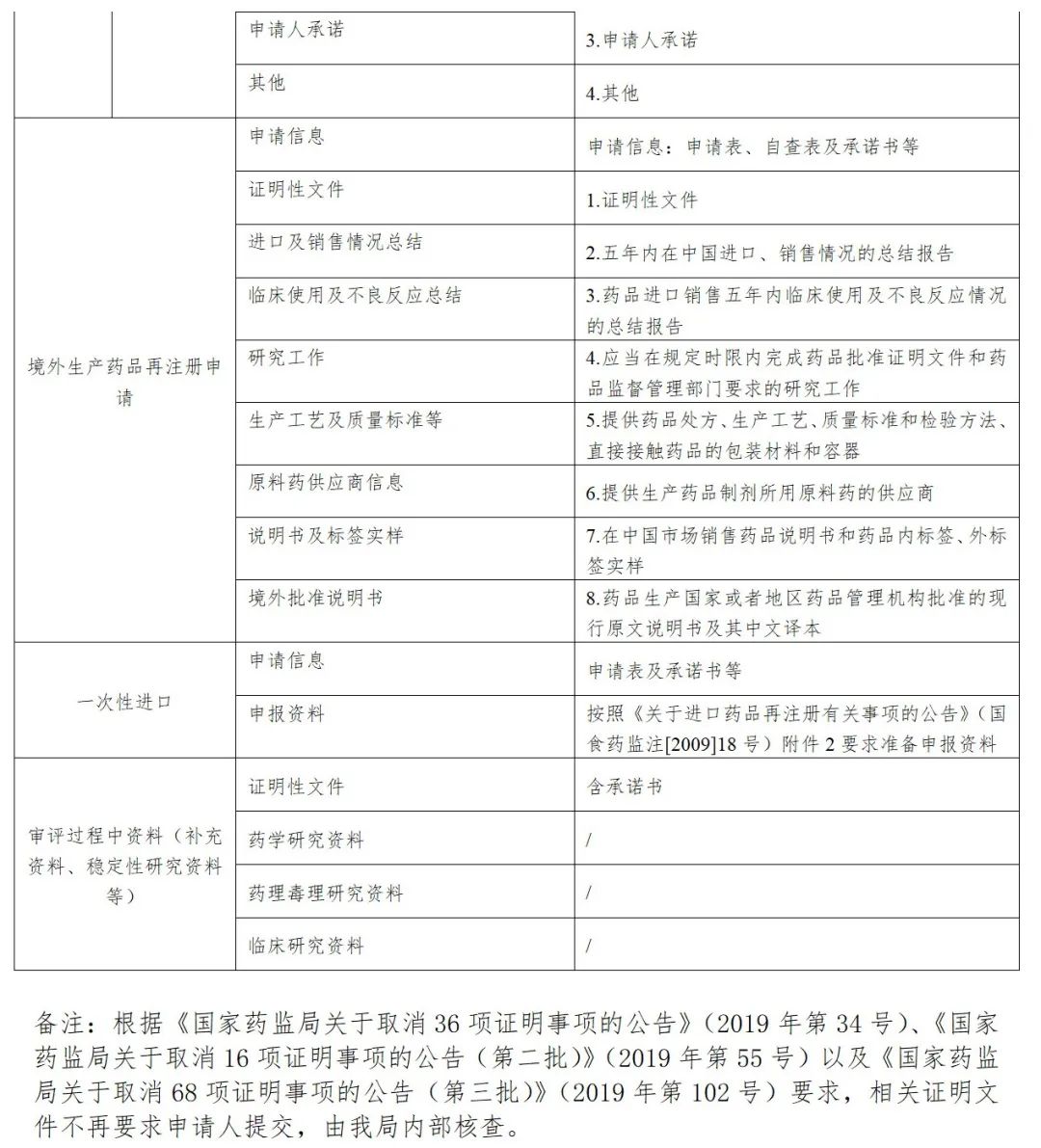
申请人应将光盘装入光盘硬盒中,光盘盒封面一般包括:申请事项、资料类型、注册分类、药品名称、规格、申报单位、数据核对码、受理号等内容,本套光盘共*张、本盘为第*张、联系人及电话等信息,加盖申请人或注册代理机构公章。光盘盒应封装于档案袋中,档案袋封面内容应与光盘盒封面保持一致。
申报资料光盘应使用“药品业务应用系统”及“药品eCTD注册系统”打印的封面;临床试验数据库光盘封面要求请参照药审中心网站《关于提交临床试验统计数据库和人体药代动力学全部图谱的通知》及《关于补交“临床试验数据库”资料的通知》相关要求执行;审评过程中的补充资料、稳定性研究资料和证明性文件光盘及档案袋封面见附件。
申请人应对提交的存储介质承担全部责任,直至该存储介质交付至监管机构。在运输过程中,承载申报资料的存储介质的安全性和完整性由申请人负责。申报资料存储介质交付至监管机构之后,其安全性和完整性由监管机构负责。
九、计算机病毒检查
申请人需对提交的电子申报资料提前进行计算机病毒检查,并在《承诺书》中提供计算机病毒检查声明。监管机构接收到申报资料后将进行计算机病毒检查,如发现计算机病毒将导致申报资料无法进入后续申报流程。
附:审评过程中电子资料光盘盒封面模板


附件5
承 诺 书
(征求意见稿)
我公司递交XXX(药品名称)的XXX(申请事项),申请表数据核对码:XXX(药品注册申请适用),受理号:XXX(审评过程中的补充资料、稳定性研究资料、证明性文件等情形适用),现承诺:
1. 已按《申报资料电子光盘技术要求》对所提交的全套电子申报资料进行了电子签章,且2套电子申报资料光盘内容完全一致。
2. 我公司将及时在药审中心门户网站“申请人之窗”如实填写邮寄或现场提交信息。
3. 我公司已使用XX查毒软件(软件版本号XX,病毒库版本号XX),对本次提交的电子申报资料进行计算机病毒检查,检查未发现计算机病毒。如因计算机病毒检查结果异常导致申报资料无法进入后续申报流程,相关责任与风险由我公司承担。
4. 我公司承诺知悉以上事项的内容,确认承诺自愿、真实,如有虚假,我公司愿意承担相应法律责任。
申请人/注册代理机构名称:(加盖公章)
日期:
<END>







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论