
导读:2月10日,CDE发布了《对我国〈以药动学参数为终点评价指标的化学药物仿制药人体生物等效性研究技术指导原则〉中关于多规格豁免BE药学评价标准“处方比例相似性”相关问题的问答(试行)》,详情见下。

为规范和指导化学药物仿制药的研究和开发,促进多规格豁免BE的药学研究和评价工作,在国家药品监督管理局的部署下,药审中心组织制定了《对我国〈以药动学参数为终点评价指标的化学药物仿制药人体生物等效性研究技术指导原则〉中关于多规格豁免BE药学评价标准“处方比例相似性”相关问题的问答(试行)》(见附件)。
根据《国家药监局综合司关于印发药品技术指导原则发布程序的通知》(药监综药管〔2020〕9号)要求,经国家药品监督管理局审查同意,现予发布,自发布之日起施行。
特此通告。
附件:对我国《以药动学参数为终点评价指标的化学药物仿制药人体生物等效性研究技术指导原则》中关于多规格豁免BE药学评价标准“处方比例相似性”相关问题的问答(试行)
国家药监局药审中心
2022年1月21日
《对我国〈以药动学参数为终点评价指标的化学药物仿制药人体生物等效性研究技术指导原则〉中关于多规格豁免BE药学评价标准“处方比例相似性”相关问题的问答(试行)》
原国家食品药品监督管理总局于 2016 年 3 月发布了《以药动学参数为终点评价指标的化学药物仿制药人体生物等效性研究技术指导原则》,该指导原则提出:对于多规格口服固体制剂(如,常释制剂:片剂和胶囊,调释制剂:肠溶片、缓释片剂、缓释胶囊等),可以基于其中某一规格(通常建议为最高规格)的人体生物等效性试验结果,采用体外药学评价的方法豁免其他规格人体生物等效性研究。药学评价方法包括:1)各规格制剂在不同 pH 介质中体外溶出曲线相似;2)各规格制剂的处方比例相似。其中处方比例相似是指以下两种情况:1)不同规格之间所有活性和非活性组分组成比例相似。2)对于高活性的药物(原料药在制剂中所占重量比例低):①不同规格的制剂重量一致(差异不超过10%);②各规格使用相同的非活性组分;③规格的变更系通过改变活性组分的用量以及一个或多个非活性组分的用量来实现。为更好的指导企业进行仿制药的开发,降低研发成本,提高研发效率,现对该指导原则中的“处方比例相似性”的相关问题进行解读。
一、“不同规格”、“各规格”的具体所指?
答:“不同规格”、“各规格”是指仿制药拟豁免规格与仿制药 BE 规格相比。
二、“组成比例相似”如何理解?
答:对于常释制剂:“组成比例相似”包括以下情况:①不同规格之间所有非活性和活性组分组成比例完全相同;②不同规格之间所有非活性成分和活性成份比例基本相同,即在处方等比放大或缩小的基础上,不同规格之间非活性成分的变化幅度在《已上市化学药品变更研究的技术指导原则(试行)》辅料用量变更中的普通口服固体制剂中等变更允许的范围内;③不同规格之间非活性成分和活性成分的比例不相似,如申请人申请豁免,应提供可视为处方相似的充分理由, 监管机构在审评期间进行综合评估。[8]
对于调释制剂:“组成比例相似”包括以下情况:①不同规格之间所有非活性成分与活性成份的比例完全相同;②不同规格之间非活性成分与活性成分的比例不完全相同,如申请人申请豁免,应证明比例是合理的,且与产品的药物释放机制相适应。审评期间基于整体资料进行综合评估。[8]
三、“高活性药物”如何判断?
“高活性药物”是活性成分的含量在制剂中相对较低的药物,如,活性成分的含量在片芯和胶囊内容物的占比<5%[1,3]。
四、不同规格之间非活性成分的变化幅度如何计算?
答:非活性组分是除活性成分外的其它成分[1,2],当不同规格活性成分和非活性成分非等比例变化时,先计算不同规格的非活性成分相对于单剂量处方的比例,后计算不同规格间的差值[3,4,5]。当处方中非活性变化种类多于一种时,非活性成分的变化幅度应为各非活性成分变化量的绝对值之和。
五、具体实例
(一)例 1:常释片剂 1

例1中 20mg 规格为 BE 规格。拟申请豁免的 10mg 规格与 BE 规格的所有活性和非活性组分组成比例完全相同, 属于常释制剂“不同规格之间所有活性和非活性组分组成比例完全相同”,结合 BE 规格制剂符合生物等效性要求,且两个规格仿制药在不同 pH 介质中体外溶出曲线相似的前提条件,可以豁免 10mg 规格的 BE 试验。
(二)例 2:常释片剂 2
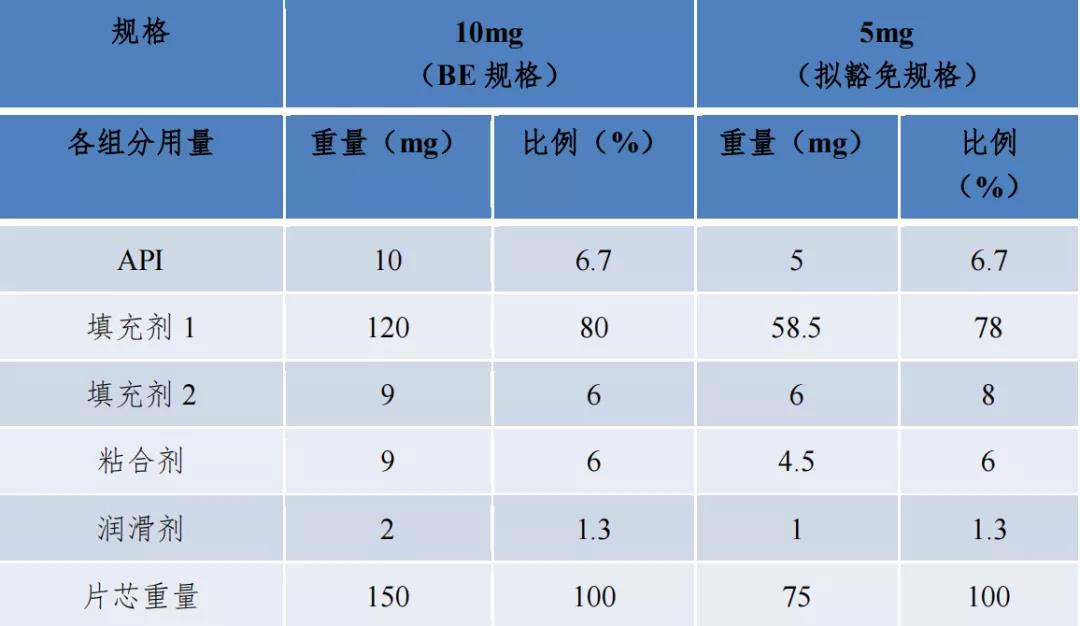
例 2 中 10mg 规格为 BE 规格。拟申请豁免 5mg 规格在BE 规格处方等比缩小的基础上,调整了填充剂 1、填充剂 2 的用量。按问题 4 计算方式,计算 5mg 规格与 BE 规格的填充剂 1 变化幅度 80%-78%=2%,填充剂 2 变化幅度 8%- 6%=2%,填充剂总变化幅度 4%,小于《已上市化学药品药学变更研究技术指导原则》(试行)辅料用量变更中的Ⅱ类变更允许的范围(±10% )内,故 5mg 规格属于常释制剂“不同规格之间所有非活性成分和活性成份比例基本相同”的情形。结合 BE 规格制剂符合生物等效性要求,且各规格仿制药在不同 pH 介质中体外溶出曲线相似的前提条件,可以豁免 BE 试验。
(三)例 3:缓释制剂


例 3 中 200mg 规格为 BE 规格。拟申请豁免 50mg、150mg 规格与 BE 规格的所有活性和非活性组分组成比例完全相同,属于调释制剂“不同规格之间所有活性和非活性组分组成比例完全相同”,结合 BE 规格制剂符合生物等效性要求,两个规格制剂与 BE 制剂释药原理相同,且两个规格与 BE 规格仿制药在三种 pH 介质中体外溶出曲线相似的前提条件,可以豁免 50mg、150mg 规格的 BE 试验。
(四)例 4:普通片剂 3(高活性药物)

例 4 中 15mg 规格为 BE 规格。拟申请豁免的 10mg 规格与 BE 规格相比,原料药在制剂中所占重量比例均小于5%,属于高活性药物。不同规格的制剂重量一致,各规格使用相同的非活性组分,规格的变更系通过改变活性组分的用量以及填充剂用量实现的。结合 BE 规格制剂符合生物等效性要求,且各规格仿制药在不同 pH 介质中体外溶出曲线相似的前提条件,可以豁免 10mg 规格的 BE 试验。
















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论