
7月3日,上海发布《药品挂网申报工作服务指南(国家组织药品集中采购品种范围外药品)》和《药品信息变更工作服务指南》,对于药品挂网申报和药品信息变更的受理部门、受理事项、受理范围,以及需要提交的申请资料等作了明确。

◆ 事项名称
药品申报挂网工作
◆ 受理部门
上海市医药集中招标采购事务管理所(以下简称“市药事所”)
◆ 办理依据
1.《国家医疗保障局办公室关于印发<医药集中采购平台服务规范1.0版>的通知》(医保办发〔2024〕1号);
2.《国家医疗保障局关于在医疗保障服务领域推动“高效办成一件事”的通知》(医保发〔2024〕2号);
3.《国家医疗保障局办公室关于落实信息互联互通推进挂网药品价格治理的通知》(医保办函〔2023〕67号);
4.《国家医疗保障局办公室关于促进同通用名同厂牌药品省际间价格公平诚信、透明均衡的通知》(医保办函〔2023〕104号);
5.《关于进一步优化本市药品分类挂网全面议价采购有关事项的通知》(沪药事药品〔2022〕18号);
6.《关于优化本市药品挂网采购机制推动高效办成一件事的通知》(沪药事药品〔2024〕24号)。
◆ 受理范围
除国家组织药品集中采购品种范围以外的药品。
◆ 申请材料
1.知识产权承诺书。企业填写《知识产权承诺书》并加盖公章后上传。
2.总代授权证明。包含总代协议、总代授权书,授权书内容由企业自拟,须包含进口及代理企业相关信息、授权书有效期等信息,并加盖代理企业公章及签名。
3.药品批准证明文件,如《药品注册证书》《药品再注册批准通知书》等。须在有效期内并包含企业名称、药品通用名、剂型、注册分类、规格、批准文号等信息。
4.药品说明书。须包含清晰的药品通用名、商品名、规格包装、包装材质、企业名称、批准文号、药品有效期等信息。
5.外包装图片。应为产品实物图片,须包含清晰的企业名称、药品通用名、规格包装等信息。
6.已取得的国家药品编码。
7.药品质量层次及标识相关证明材料。
8.企业申报价格。
9.外省市挂网记录。须上传除上海市以外的所有外省市价格信息及相关证明材料,若无外省市价格,则上传《无外省市价格承诺书》。
10.国家挂网药品监测价(若有)。
◆ 办理时间
15个工作日(自企业提交的申报信息预审通过后起)
◆ 办理流程
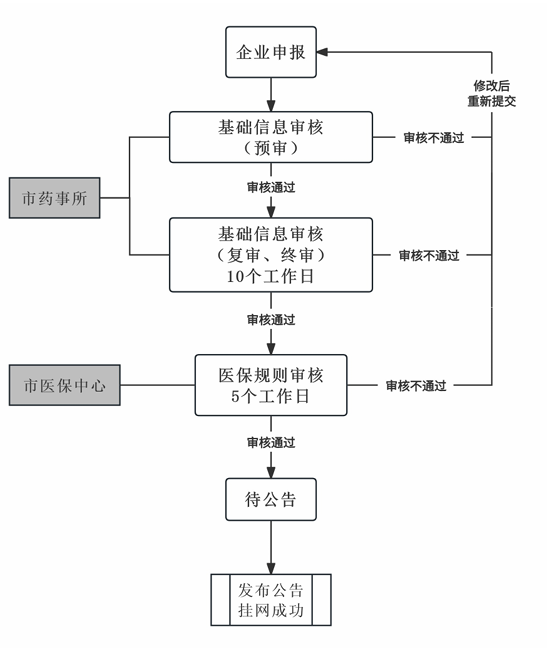
1.申请
企业通过门户网站(www.smpaa.cn)登录上海市医保招采子系统企业业务登录模块,进入“药品→药品信息管理”模块维护相应证照,包括“批件管理、说明书管理、外包装图片管理”模块。
维护完成后,企业进入“我的药品库→药品新申报”模块,根据药品类型填写“挂网类型”模块,勾选国家药品编码,并按《医药集中采购平台服务规范1.0版》要求依次填写药品“基础信息→标识信息→价格信息”模块,最后提交申报。企业应对药品申报资料的真实性负责,申报信息以企业承诺为准。
申报信息提交后,企业可进入“药品→药品信息管理→本企业药品维护流程查询”模块中查询药品审核进度。
2.审核
(1)基础信息审核
药品申报信息提交后,企业端流程状态显示为“已提交,待受理”,市药事所负责对企业申报信息及上传资料进行预审,对于信息填报无误,申报资料齐全、证明充分且符合规范的通过预审,企业端显示为“受理审核中”,之后进入复审和终审环节。
(2)医保规则审核
基础信息终审通过后,市医保中心进行医保规则的维护及审核。审核通过后进入待发布确认流程。
(3)审核不通过
企业填报信息有误或申报资料不符合规范的,基础信息或医保规则审核不通过,附审核意见退回企业,经修改后按照再次提交时间重新排队审核。
3.发布确认及公告
上述审核完成的产品,发布确认后自动生成公告并发布在招采子系统,不再通过门户网站进行发布。
原则上每周二发布审核通过的药品挂网信息,周四生效,如遇法定节假日视具体情况提前或延后发布。

◆ 事项名称
药品信息变更工作
◆ 受理部门
上海市医药集中招标采购事务管理所(以下简称“市药事所”)
◆ 受理依据
1.《中华人民共和国药品管理法》;
2.《药品注册管理办法》;
3.《药品生产监督管理办法》;
4.《药品上市后变更管理办法(试行)》;
5.药品监督管理部门公布的涉及药品变更的各相关文件;
6.国家医保信息业务编码标准数据库。
◆ 受理事项
1.药品基础信息变更(除国家组织药品集中采购本市中选药品以外的药品)
2.药品标识信息变更
◆ 受理范围
1.药品基础信息变更包括但不限于:国家药品编码、药品通用名、商品名、表述剂型、规格包装、企业名称(上市许可持有人、受委托生产企业、进口分包装企业)、批准文号、本位码等信息变更。
2.药品标识信息变更包括:毒性、麻醉、精神、放射性、国家基药、本市基药、OTC、原研、参比制剂、创新药、优先审评审批、通过一致性评价(制造工艺变更)、通过一致性评价(制造工艺未变更)、视同通过一致性评价、国家短缺清单。
◆ 申请资料
1.变更申请公文。须写明变更事项并加盖企业公章;
2.药品批准证明文件。如《药品注册证书》、《药品再注册批准通知书》、《药品补充申请批准通知书》等;
3.药品说明书。上传说明书完整实物图;
4.外包装图片。上传外包装完整实物图,须包含清晰的企业名称、药品通用名、规格包装等信息;
5.药监部门其他证明材料。如进口药品转国内分包装补充批件、国家药监局备案信息公示等;
6.药品标识相关证明材料。
◆ 办理时间
15个工作日(自企业提交的申报信息预审通过后起)
◆ 办理流程

1.申请
企业通过门户网站(www.smpaa.cn)登录上海市医保招采子系统企业业务登录模块,进入“药品→药品信息管理”模块维护相应证照,包括“批件管理、说明书管理、外包装图片管理”模块。
维护完成后,企业进入“我的药品库→选取药品→基础信息变更或标识信息变更”模块,并按要求上传相关资料。企业应对药品资料的真实性负责,变更信息以企业承诺为准。
变更信息提交后,企业可进入“药品→药品信息管理→本企业药品维护流程查询”模块中查询药品审核进度。
2.审核
(1)基础信息审核
药品变更信息提交后,企业端流程状态显示为“已提交,待受理”,市药事所负责对企业变更信息及上传资料进行预审,对于信息填报无误,申报资料齐全、证明充分且符合规范的通过预审,企业端显示为“受理审核中”,之后进入复审和终审环节。
(2)医保规则审核
基础信息终审通过后,涉及医保规则发生变化的流转至市医保中心对医保规则进行维护及审核,审核通过后进入待发布确认流程。
(3)审核不通过
企业填报信息有误或申报资料不符合规范的,基础信息或医保规则审核不通过,附审核意见退回企业,经修改后按照再次提交时间重新排队审核。
3.发布确认及公告
药品基础信息变更发布时确认变更后药品编码生效日期及原药品编码失效日期。原药品编码10个自然日过渡期(节假日顺加)后采购规则做医药机构失效,不再保留“限药店”状态。
发布确认后自动生成公告并发布在招采子系统,不再通过门户网站进行发布。药品标识信息变更直接发布确认,不发布相关公告,变更后标识信息可在“我的药品库”进行查看。
原则上每周二发布审核通过的药品变更信息,周四生效,如遇法定节假日视具体情况提前或延后发布。

◆编辑 | 拾一










































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论