01
相关法规的要求

注:不同的产品依据相关的标准、指导原则、法规要求进行。
02
二类医疗器械的注册流程

周期(含审批)
不含临床试验约需18个月;含临床试验约需18-36个月及以上。详情如下。
1、从产品立项到完成检测预计使用4-7个月。
2、如产品需做临床试验则需耗时6-12个月,具体视产品而定。
3、申报注册全过程需8个月(158个工作日,每月按20个工作日,不计节假日)。此处未将整改、资料发布等不确定因素的耗时计入。
03
三类医疗器械的注册流程

周期(含审批)
不含临床试验约需18个月;含临床试验约需18-36个月及以上。详情如下。
1、从产品立项到完成检测预计使用4-7个月。
2、如产品需做临床试验则需耗时6-12个月,具体视产品而定。
3、申报注册全过程需8个月(约158个工作日,每月按20个工作日,不计节假日)。此处未将整改、资料发布等不确定因素的耗时计入。
04
延续注册的流程

05
注册办理的流程

06
生产许可事项的办理流程
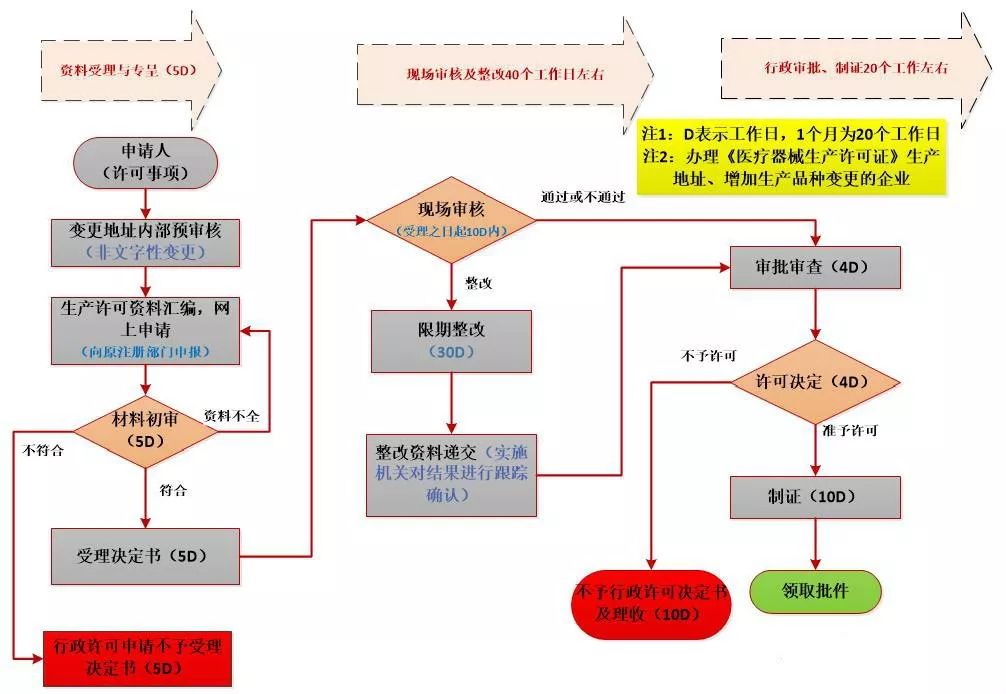
07
登记事项的办理流程

08
注册资料的说明

09
分类界定的流程

10
创新审批的流程
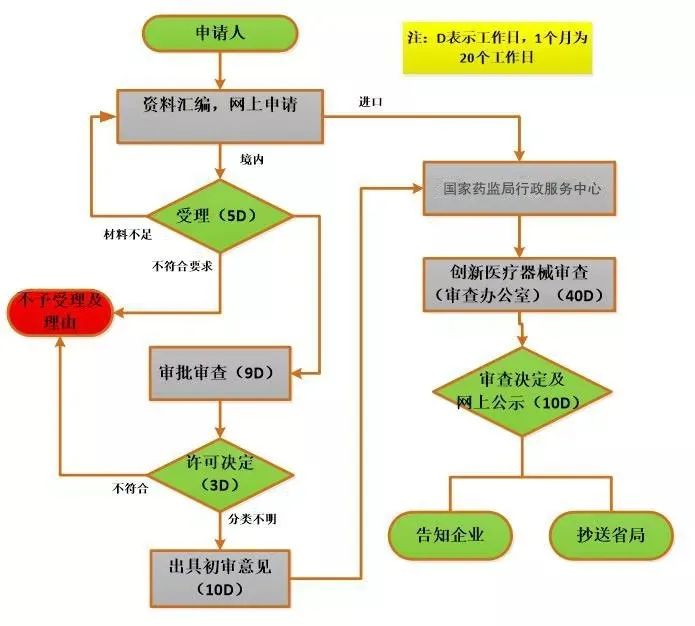
收费:免费。
周期:省药监局审批约需35个工作日;国家药监局审批约需50个工作日。
本公众号所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。所有文章仅代表作者观点,不代表本站立场。
<END>

【关于生物药知识云享】
“生物药知识云享”围绕我国生物医药产业链,专注于生物制药行业资讯整理,分享行业动态,前沿技术,政策法规等,旨在给大家提供资料参考,欢迎大家扫码关注,也欢迎广大生物医药同仁提供建议,谢谢






































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论