"药学研究"相关的结果
-

-

肠溶制剂的药学研究中不容忽视的关键点
为提高患者顺应性或者提高药效,某些药物需要制成肠溶制剂。对于在胃里容易降解失效或者对胃有刺激性的药物来说,肠溶颗粒剂或肠溶片剂可以控制药物在肠道内定位释放,减缓患者服药后的不良反应,从而改善患者的服药顺应性。那么肠溶制剂在研发中有哪些关键点呢? -

药学研究中不能轻视的相容性
药学申报资料M4的3.2.P.2.6中明确要求了相容性的研究内容,在药学研究中相容性直接影响药品的质量和安全。相容性的研究不但包括原辅料的相容性,还包括与包装材料,生产组件及给药器具的相容性。本文以化药注射液为例,阐述在药学研究中不可轻视的相容性研究有哪些,并对相应的研究方法与考察的指标进行了讨论和小结。 -

美国IND药学资料的关键要点
创新药的研发是一个高风险、高投入、长周期的过程。自1992年FDA的处方药用户收费法案(PDUFA)审查发布后,导致提交上市申请到批准上市的平均和中位数时间显著下降,FDA开始在不损失药物安全性和有效性的前提下,转向怎么提高药物开发的效率。现行法规中FDA允许在IND阶段提交各种数据的数量和深度有较大的灵活性。FDA对于IND申请的基本要求进行了澄清,可帮助加快新药进入临床试验和评估I期研究需要的安全性。 -

CDE指导原则再次3连发!滴眼剂药学研究、药物注册沟通交流等
刚刚,CDE又连续发布3项指导原则,分别为:《化学药品仿制药溶液型滴眼剂药学研究技术指导原则》、《真实世界证据支持药物注册申请的沟通交流指导原则(试行)》、《药物真实世界研究设计与方案框架指导原则(试行)》。 -
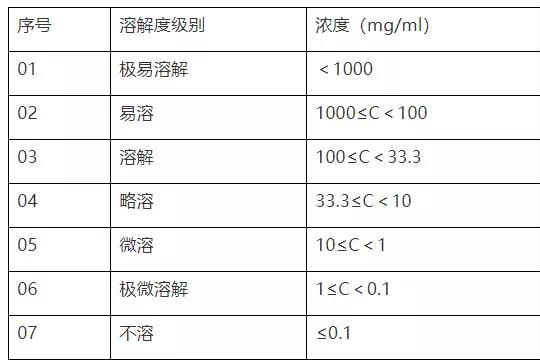
溶解性试验研究和药学方法开发关联
药物发挥作用并且安全,就是口服吸收;往往口服吸收利用度需要克服的是溶解性差和渗透性低等2大因素;所以溶解度是实现药物在全身循环中所需浓度的重要参数之一,来实现药物的药理反应和作用。水溶性差的药物通常需要高剂量才能在口服后达到治疗血浆浓度,在制剂开发和仿制药开发中低水溶性是主要考虑问题。 -
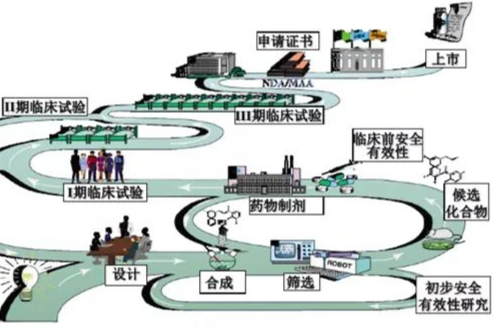
2021创新药药学研究知识点大全
2021创新药药学研究知识点大全,一个创新药的研究开发需要经历:疾病市场调研、分子机理研究、靶标的选择确认、分子设计、先导化合物合成及优化、药效药代和毒性初筛、临床前研究、临床研究、新药审评及上市等环节,从新药立项到最终上市,需要经历大约8-10年时间周期,所谓:“十年磨一剑”。新药药学研究经历了一个从发现到认知再到确认的过程,在这个过程中,安全性和有效性始终是筛选或淘汰候选药物的”金标准”,药学研究任务的顺利开展是支持后期临床前研究和临床研究的重要前提,是保证拟上市药物质量可控性的关键所在。


































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息