"生物制品"相关的结果
-
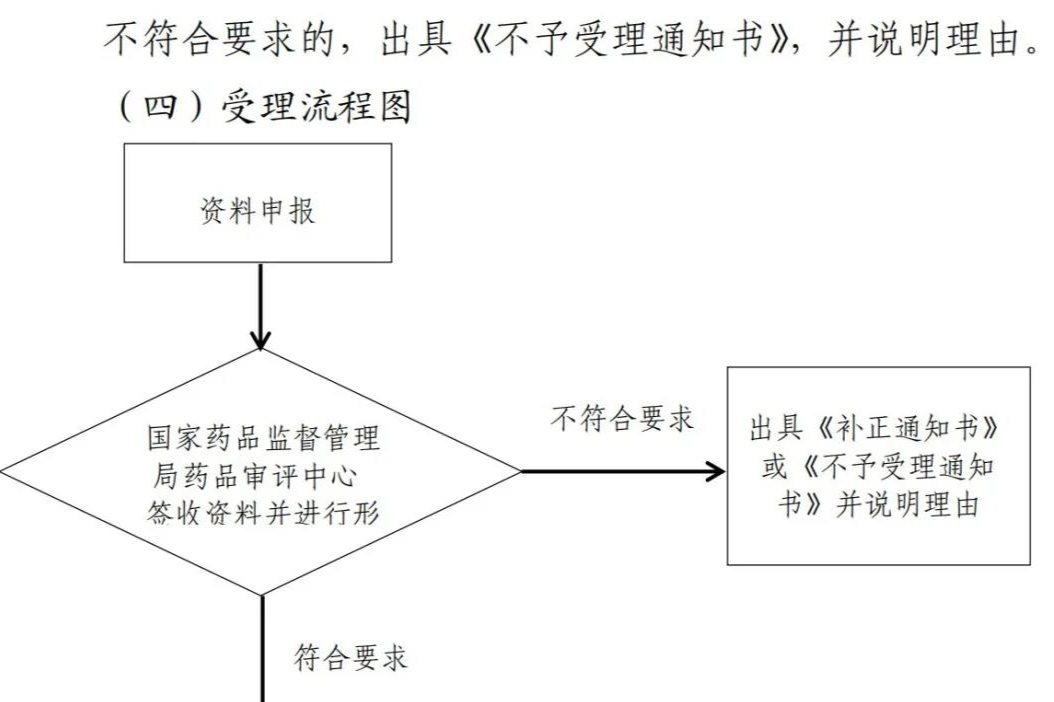
CDE发布《生物制品变更受理审查指南(试行)》
根据《国家药监局关于实施〈药品注册管理办法〉有关事宜的公告》(2020年第46号),为推进相关配套规范性文件、技术指导原则起草制定工作,在国家药品监督管理局的部署下,药审中心组织制定了《生物制品变更受理审查指南(试行)》(见附件)。根据《国家药监局综合司关于印发药品技术指导原则发布程序的通知》(药监综药管〔2020〕9号)要求,经国家药品监督管理局审核同意,现予发布,自发布之日起施行。生物制品259203年前 -

生物制品批签发管理办法发布
《生物制品批签发管理办法》已于2020年11月19日经国家市场监督管理总局2020年第11次局务会议审议通过,现予公布,自2021年3月1日起施行。 -

从《深化医药卫生体制改革》看生物制品未来规划
2020年7月23日,国务院办公厅发布了《深化医药卫生体制改革2020年下半年重点工作任务的通知》,其中明确提到“加强药品和医疗防护物资储备,加大疫苗、药物和快速检测技术研发投入”与“有序扩大国家组织集中采购和使用药品品种范围”




































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息