"欧盟药品"相关的结果
-
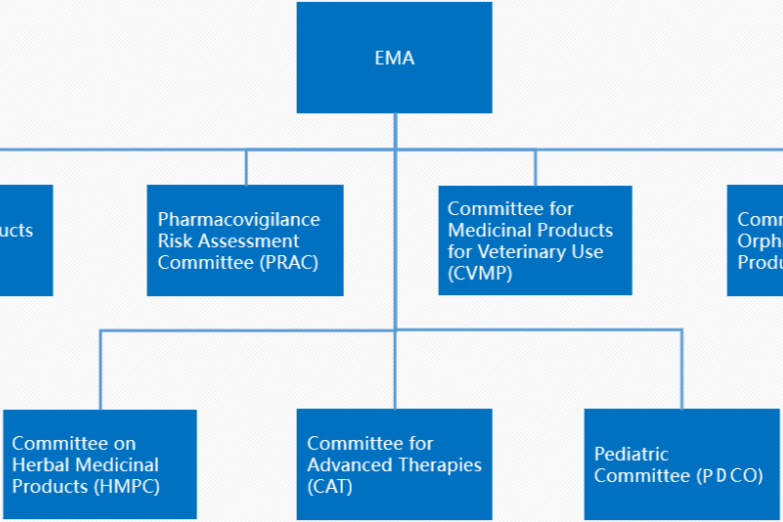
欧盟药品集中、分权、互认、成员国等审批程序【温故知新】
目前,欧盟药品注册审批程序有集中审批程序(CP)、互认可审批程序(MRP)、分权审批程序(DCP)和成员国审批程序(INP)这几种途径,欧盟集中审批药品(Centralized Procedure, CP)是一种由欧洲药品管理局(EMA)负责审评、欧盟委员会(EC)负责批准的药品上市许可程序。根据法规(EC)726/2004,集中审批程序允许通过一次上市许可申请(MAA)......


































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息