
近期Epitomee Medical Ltd.(以色列特拉维夫证券交易所:EPIT)宣布,其Epitomee®胶囊已正式获得美国食品药品监督管理局(FDA)的批准。这是一种尖端的可吞咽医疗设备,旨在帮助BMI在25-40kg/m²的成年人进行体重管理,使用者仍需配合饮食和运动。这种新颖的无药物治疗为数百万注重健康的美国居民提供了全新选择。

用于体重管理的Epitomee®胶囊获FDA批准!Epitomee®胶囊已正式获得FDA批准,这是一种突破性的口服处方设备,旨在帮助BMI在25-40kg/m²之间的超重和肥胖成年人进行体重管理,使用者仍需配合饮食和运动。这种创新的无药物解决方案通过增加饱腹感,助力人们实现更健康的生活方式。
Epitomee®胶囊提供了一种创新的处方选择,在一众体重管理方式中脱颖而出,它作为无药物替代方案,有别于注射治疗。FDA批准Epitomee®胶囊适用于BMI在25及以上的成年人,这为更广泛的患者群体提供了可能,他们期望找到更易于耐受且便于使用的体重管理方式。Epitomee®设备封装在标准尺寸的自行可吞咽胶囊中。当Epitomee®胶囊被患者吞下并到达胃部后,会吸收胃部的水分并形成三维基质,占据胃部空间,产生饱腹感,从而帮助患者减肥。Epitomee®胶囊的作用机制是纯机械性的,不涉及任何化学活性。胶囊直接作用于胃肠道(GI)内。

Epitomee®胶囊在RESET研究后获得美国FDA批准:该研究是一项前瞻性、随机、双盲、并进行了安慰剂对照的多中心试验。该研究招募了279名超重和肥胖的成人参与者,部分伴有前期糖尿病。参与研究的9个试验点均位于美国9个不同州。符合条件的受试者被随机分配到测试组或安慰剂组。受试者每天服用两次试验设备胶囊或安慰剂,并配合饮食和运动,持续24周。研究显示,两项共同的主要目标均已达成。RESET研究表明,与对照组相比,设备组受试者的减重效果更加显著(P<0.0001)。治疗响应者的共同主要目标也已达成:在随机分配24周后,Epitomee治疗组中体重减少至少5%的受试者比例为55.5%(置信区间:46.1-64.6),明显高于>35%的阈值(P<0.0001)。
研究还表明,在整个研究期间,Epitomee®疗法具有良好的安全性。Epitomee®治疗组的患者耐受性良好,退出研究的患者人数少于对照组。研究中未发现严重的不良设备反应(SADE)。此外,接受Epitomee®治疗的受试者在IWQOL-Lite-CT问卷的多个项目中都显示生活质量得到了更好的改善。
公司还在参与RESET研究的9个试验site中的3个进行了额外ELECT研究。在这项研究中,设备组和安慰剂组的受试者再继续服用24周的Epitomee®胶囊。研究显示,在48周的研究期间,Epitomee®治疗设备组受试者的安全性良好。
公司联合创始人兼董事会主席Shimon Eckhouse博士就获得FDA批准发表评论:“FDA对Epitomee®胶囊的批准标志着体重管理领域的一个重要里程碑。其创新方法为患者提供了安全有效的选择。通过这种简单、无药物的胶囊来管理体重,这种疗法为那些寻求改善健康和生活质量的人们提供了新的可能性。”
Epitomee Medical Ltd.的CEO Dan Hashimshony博士也表示:“我们为Epitomee®的无药物口服体重管理方式获得FDA批准感到自豪。这是我们采取创新方法应对全球肥胖问题的成果。我们的胶囊为数以百万计、面临体重管理挑战的人们提供了一种安全、有效且无药物的解决方案。展望未来,我们期待将这一突破性产品引入美国市场,并寻求战略合作伙伴,以充分实现其商业潜力。”
关于Epitomee Medical Ltd.
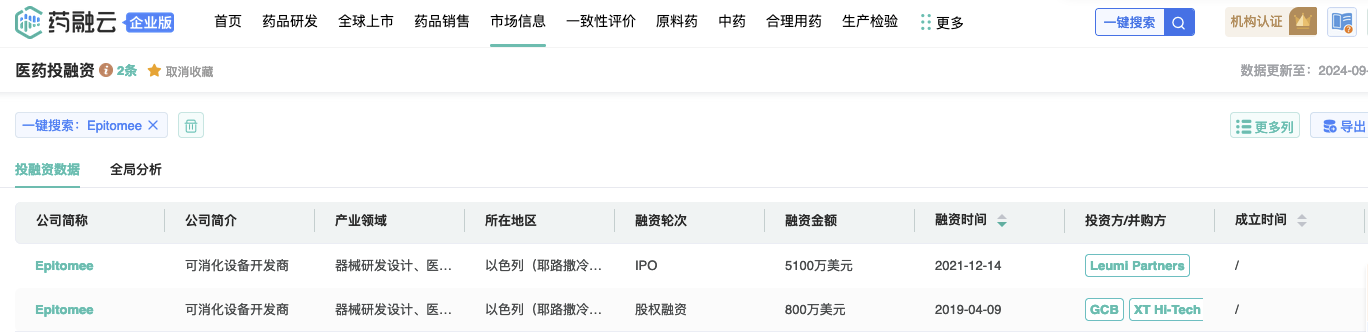
图片来源:药融云数据库
Epitomee Medical Ltd.(特拉维夫证券交易所:EPIT)是一家成立于2005年的上市公司,由Shimon Eckhouse博士联合创立,并由CEO Dan Hashimshony博士领导。该公司是一家开创性的健康解决方案公司,致力于推进创新疗法。Epitomee Medical专注于安全性、有效性和生活质量的提升,力争走在变革性医疗解决方案的前沿。
公司正致力于推动两个主要领域的发展:体重管理和生物药物给药。除了其旗舰体重管理解决方案外,Epitomee Medical还在开发一个平台,专注于生物药物的口服给药。该创新平台旨在将药物输送至吸收部位,提高生物利用度。
此文仅用于向医疗卫生专业人士提供科学信息,不代表平台立场,不作任何用药推荐
参考来源:
[1] CDE/NMPA官网
[2] 药融云数据库
[3] FDA/EMA/PMDA
[4] 相关公司公开披露(正文图片均来自企业官方,除非另有说明)
[5] Epitomee Medical(https://epitomeemedical.com/)
[6] WHO世界肥胖报告;https://www.prnasia.com/story/461124-1.shtml等等
<END>
想要解锁更多药物研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!

















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论