
9月13日,恒瑞医药其子公司苏州盛迪亚生物医药的注射用瑞康曲妥珠单抗品种上市许可申请获CDE受理,并且近日该产品已被CDE纳入优先审评,适应症为:用于既往接受过至少一种系统治疗的局部晚期或转移性HER2突变成人非小细胞肺癌患者的治疗。

截图来源:CDE
据药融云数据库显示,注射用瑞康曲妥珠单抗是恒瑞医药自主研发的、以HER2为靶点的抗体药物偶联物,拟用于HER2表达或突变的晚期实体瘤的治疗。瑞康曲妥珠单抗可特异性结合肿瘤细胞表面上的HER2,随后偶联物被内吞至细胞内并转运至溶酶体中,通过携带的载药在肿瘤细胞内产生药物作用,诱导肿瘤细胞的凋亡。

截图来源:全球药物研发数据库
瑞康曲妥珠单抗已获批开展多项临床研究,其中乳腺癌、胃癌或胃食管结合部腺癌、结直肠癌以及非小细胞肺癌均进入III期研发阶段,旨在为HER2基因异常的肿瘤患者提供新的治疗选择,为后续研究及药物惠及患者提供更多的临床证据。
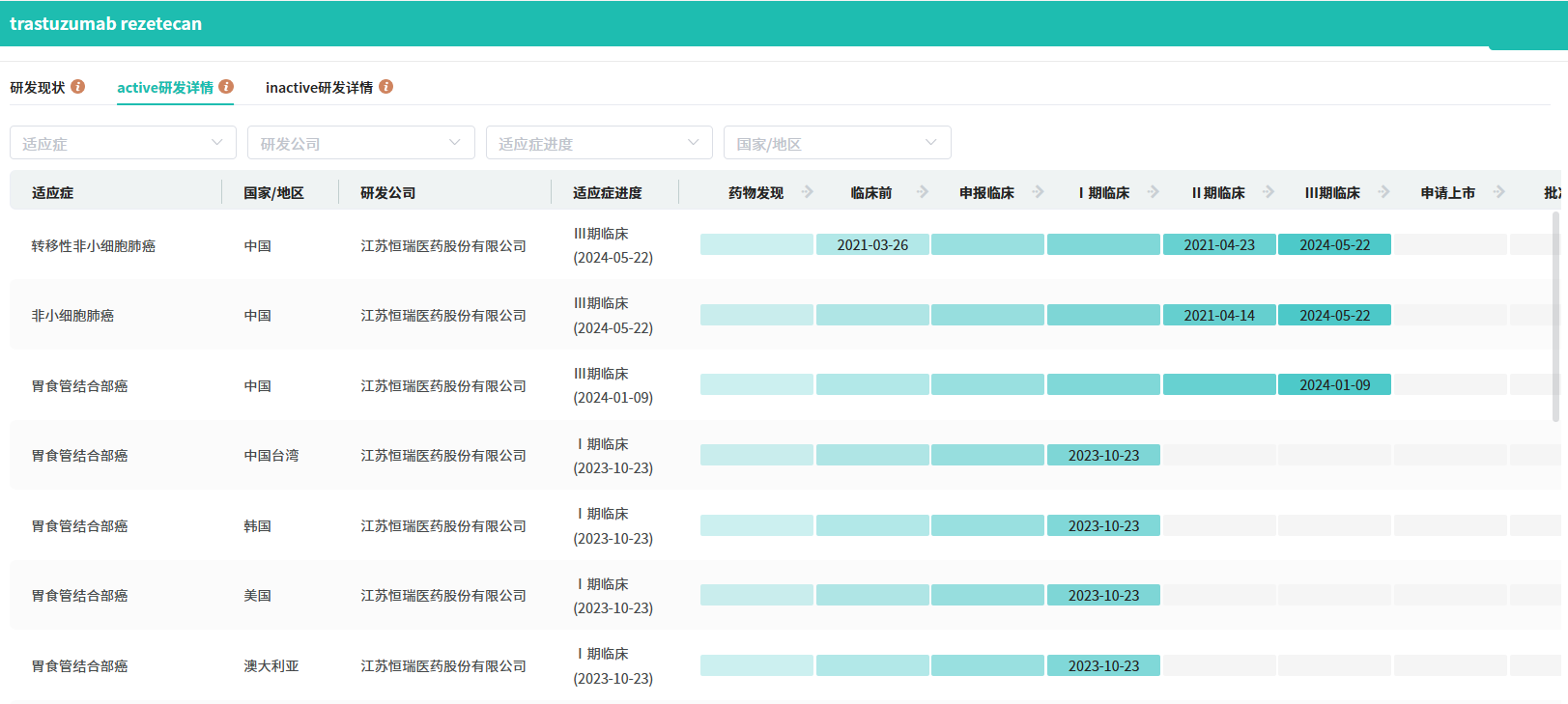
截图来源:全球药物研发数据库
本次瑞康曲妥珠单抗申报上市的适应症为非小细胞肺癌。2024年6月,瑞康曲妥珠单抗治疗HER2突变非小细胞肺癌(NSCLC)患者的2期临床试验(SHR-A1811-I-103)主要研究终点结果达到方案预设的优效标准。
2024年7月,恒瑞医药宣布1/2期临床研究SHR-A1811-I-103研究的1期阶段主要结果在《自然》子刊Signal Transduction and Targeted Therapy发布。结果显示,全剂量组经研究者评估确认的客观缓解率(ORR)为38.1%,疾病控制率(DCR)为90.5%,中位反应持续时间(DOR)为10.3个月,中位无进展生存期(PFS)为9.5个月。4.8mg/kg剂量组(RP2D, N=43)经研究者评估确认的ORR为41.9%,DCR为95.3%,中位DoR为13.7个月,中位PFS为8.4个月。
根据恒瑞医药新闻稿,该公司多年来深刻关注中国HER2表达或突变肿瘤领域的治疗现状,持续探索更多有效的治疗方案。经过10年的ADC研发积累,恒瑞医药目前已有包括SHR-A1811在内的12个新型、具有差异化的ADC分子成功获批临床,6款产品实现国际同步开发,还有多个创新药产品布局各个实体肿瘤治疗领域,以期为患者带来更多的治疗选择。
参考资料:
[1] CDE官网
[2] 药融云数据库
[3] 中国国家药监局药品审评中心官网. Retrieved Sep 12,2024,from https://www.cde.org.cn/main/xxgk/listpage/4b5255eb0a84820cef4ca3e8b6bbe20c
[4] 恒瑞医药ADC创新药注射用瑞康曲妥珠单抗上市申报获受理且已被纳入优先审评. RetrievedSep13,2024,fromhttps://mp.weixin.qq.com/s/fuwAy2RQfH1N_GKfKSfI2Q
<END>
想要解锁更多药物研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!


































![医药高地:核药!恒瑞医药镥[177Lu]氧奥曲肽注射液获批临床](https://yaorongyun-public.oss-cn-shanghai.aliyuncs.com/images/covers/202302/09/e3938ad9f1d23e2fd043611c4a98c02a.png)














 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论