
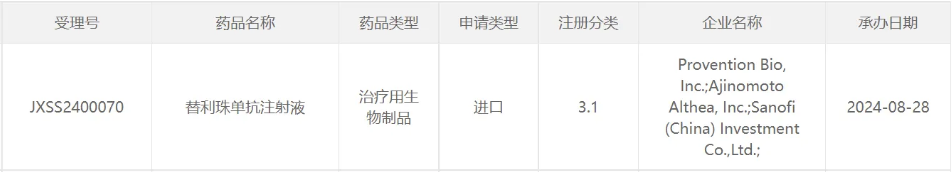
8月28日,中国国家药监局(NMPA)药品审评中心(CDE)官网公示,赛诺菲(Sanofi)申报的替利珠单抗注射液的上市申请获得受理。8月20日,该药拟纳入优先审评,用于延缓成人和8岁及以上儿童1型糖尿病患者从2期进展至3期的速度。该产品已在2022年11月获FDA批准上市。
替利珠单抗(teplizumab)是一款CD3单抗药物,是用于延缓1型糖尿病发病的创新靶向疗法。值得一提的是,它还曾入选《时代》周刊发布的2023年度最佳发明(The Best Inventions of 2023)榜单。
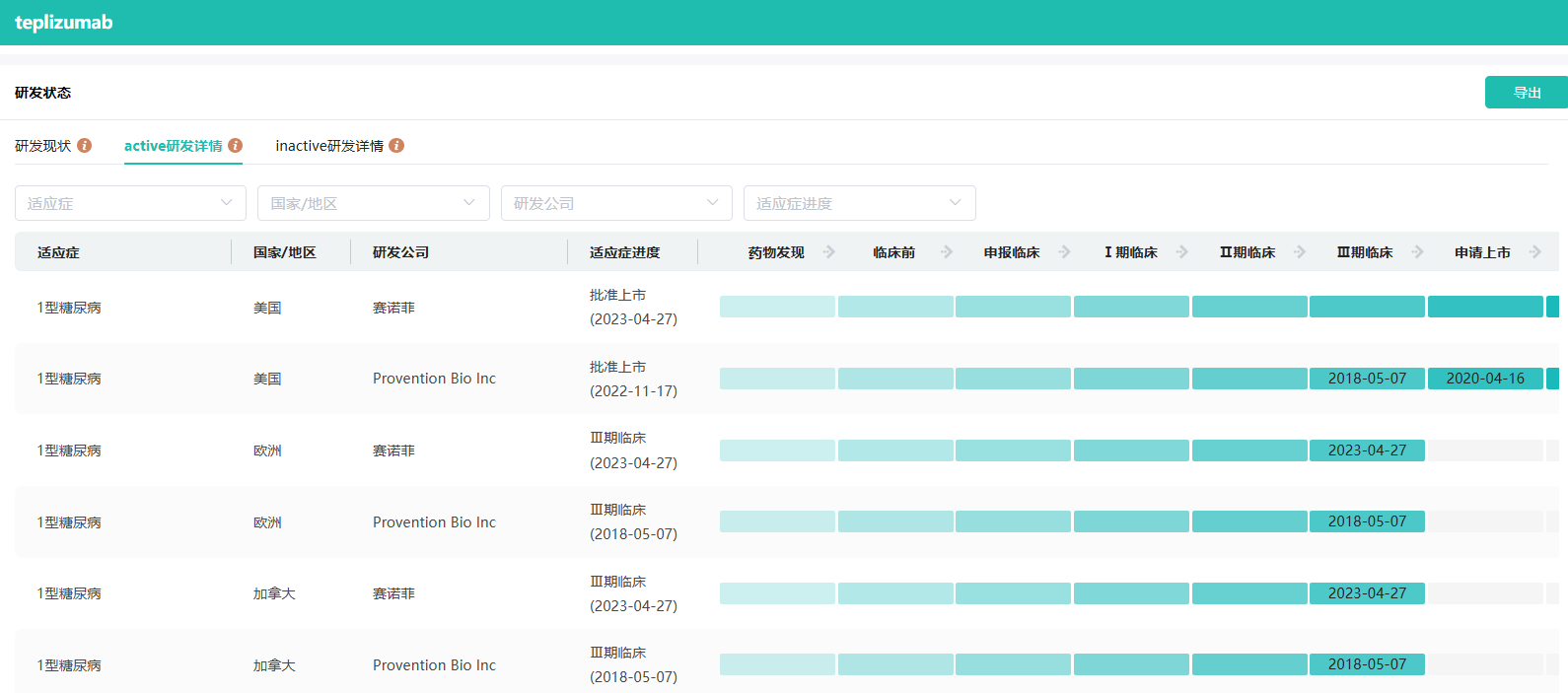
替利珠单抗是一种“first-in-class”CD3靶向单克隆抗体,它能从病因上实现对胰岛β细胞的保护,进而延缓1型糖尿病发病近3年。该药于2022年11月在美国获批(商品名为Tzield),用于延缓成人和8岁及以上儿童1型糖尿病患者从2期进展为3期。这也是FDA批准的首个延缓1型糖尿病发病的创新靶向疗法。

2007年10月,礼来与MacroGenics达成协议,以6.41亿美元的总交易额获得替利珠单抗的开发与商业化权益。不过,礼来在三年后终止了双方的合作。
2018年5月,Provention Bio从MacroGenics手中收购了替利珠单抗的所有权益,并将其作为核心产品,公司也基于此募资5600万美元IPO。
2022年10月,赛诺菲与Provention Bio达成合作,获得替利珠单抗的美国商业化权益。在替利珠单抗顺利获得FDA批准后,赛诺菲出手29亿美元并购Provention Bio,获得该产品的所有权益。
参考来源:
[1] NMPA官网
[2] 药融云数据库
<END>
想要解锁更多药物研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!

















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论