
近日,恒瑞医药及子公司苏州盛迪亚生物医药有限公司收到国家药品监督管理局下发的《受理通知书》,公司提交的苹果酸法米替尼胶囊、注射用卡瑞利珠单抗的药品上市许可申请获国家药监局受理,拟定适应症为注射用卡瑞利珠单抗联合苹果酸法米替尼胶囊治疗既往经过含铂化疗失败的复发或转移性宫颈癌患者。
此次提交的上市申请是基于一项关键性临床II期研究——卡瑞利珠单抗联合苹果酸法米替尼对比卡瑞利珠单抗单药或研究者选择化疗治疗复发转移性宫颈癌的随机、开放、对照、多中心的II期临床研究(试验编号:SHR-1210-II-217)。研究结果表明,卡瑞利珠单抗联合苹果酸法米替尼较卡瑞利珠单药相比,可显著提高患者的客观缓解率,起效快、缓解可持续,并且可延长复发转移性宫颈癌患者的总生存期[1]。该研究成果于今年10月亮相2023年欧洲肿瘤内科学会(ESMO)年会简短口头(Mini Oral)报告环节。
关于SHR-1210-II-217研究
SHR-1210-Ⅱ-217研究由复旦大学附属肿瘤医院吴小华教授担任主要研究者,全国33家中心共同参与。研究主要终点是由独立评审委员会(BIRC)基于RECISTv1.1标准评估的客观缓解率(ORR),次要终点包括研究者基于RECISTv1.1标准评估的ORR、疾病控制率(DCR)、客观缓解持续时间(DOR)、无进展生存期(PFS)、总生存期(OS)、安全性等。
本研究共纳入194例受试者,其中卡瑞利珠单抗联合法米替尼组105例,卡瑞利珠单抗单药组54例,研究者选择化疗组35例。研究结果显示,卡瑞利珠单抗联合法米替尼治疗既往经过至少一线治疗的复发转移性宫颈癌患者的ORR可达41%,且起效迅速、缓解持续时间长。研究证实,卡瑞利珠单抗联合法米替尼相较卡瑞利珠单抗单药或研究者选择化疗能够显著提高ORR,延长PFS和OS,同时总体毒性可控、可耐受[1]。该研究显示卡瑞利珠单抗联合法米替尼是目前针对既往一线治疗失败的复发转移性宫颈癌的最高客观缓解率获益组合,该研究也是全球首个免疫治疗联合小分子酪氨酸激酶抑制剂对比免疫治疗单药治疗复发转移性宫颈癌获得成功的随机、对照研究。
关于卡瑞利珠单抗与苹果酸法米替尼
卡瑞利珠单抗是恒瑞医药自主研发的一款人源化PD-1单克隆抗体,可与人PD-1受体结合并阻断PD-1/PD-L1通路,恢复机体的抗肿瘤免疫力,从而形成癌症免疫治疗基础。于2019年5月获批上市,目前已在肺癌、肝癌、食管癌、鼻咽癌以及淋巴瘤五大瘤种中获批了9个适应症,其中8个适应症已纳入国家医保目录,为获批适应症和覆盖瘤种数量领先的国产PD-1产品。
法米替尼是恒瑞医药自主研发的小分子多靶点酪氨酸激酶抑制剂,对多种受体酪氨酸激酶有抑制活性,属于多靶点抗血管生成靶向药。
目前,恒瑞医药还在推进卡瑞利珠单抗联合法米替尼在非小细胞肺癌、泌尿系统和妇科系统肿瘤等领域的临床研究。其中,卡瑞利珠单抗联合法米替尼一线治疗复发转移性宫颈癌的III期临床研究(试验编号:SHR-1210-III-329)已于2021年开展并且即将完成入组,若该试验最终取得阳性结果,或将成为复发转移性宫颈癌一线治疗中首个去化疗方案,为宫颈癌患者提供更多的治疗选择。
卡瑞利珠单抗适应症查询
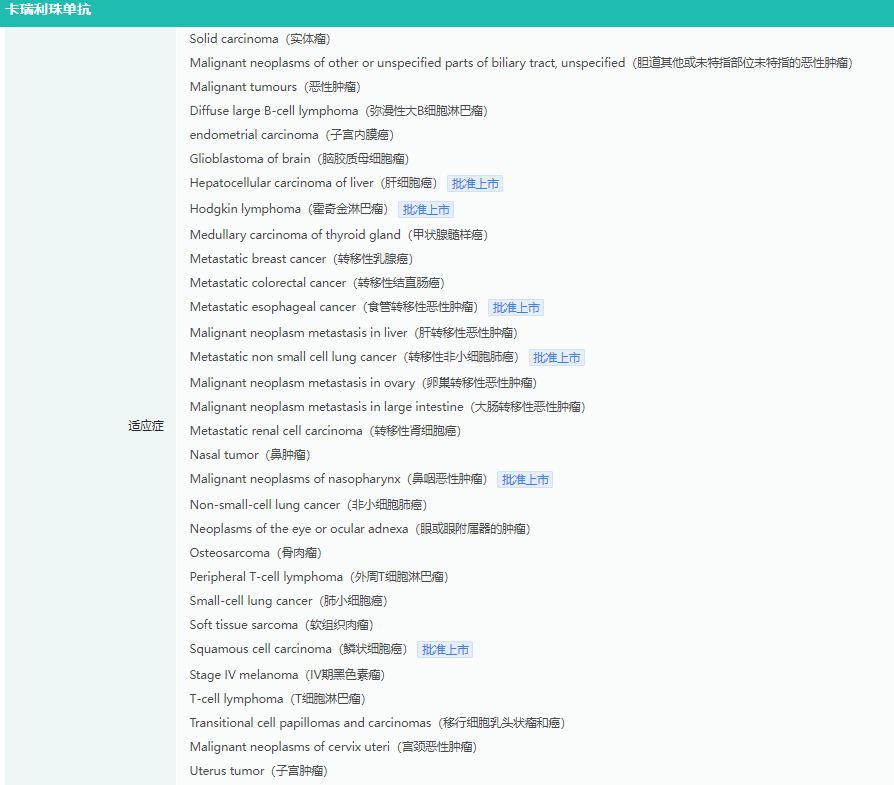
截图来源:药融云全球药物研发数据库
参考资料:
恒瑞医药
药融云数据库
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!











































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论