
2023年11月29日,华赛伯曼宣布,公司自主研发的首款TIL细胞1类新药——HS-IT101注射液(受理编号:CXSL2300599)用于治疗晚期实体瘤的IND申请获得NMPA临床试验默示许可。
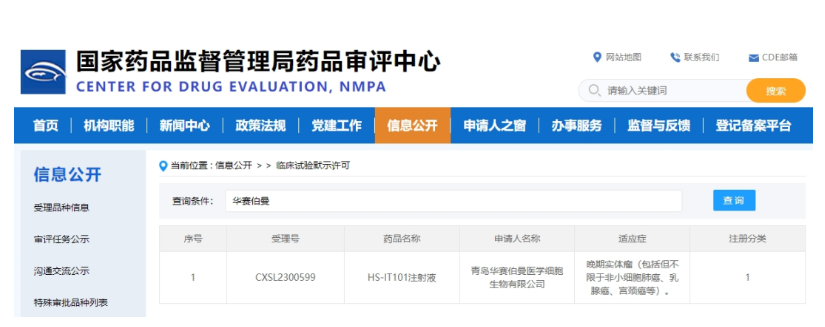
截图来源:CED官网
TIL疗法是指从肿瘤组织中分离自然浸润淋巴细胞,通过体外扩增和功能优化后,重新回输到患者体内。TIL具有多种TCR克隆性、选择性肿瘤归巢能力和较低的非肿瘤靶向毒性等优势,使得TIL疗法成为最有可能攻克实体瘤的细胞免疫疗法。
HS-IT101是华赛伯曼自主研发的自体天然加强TIL产品,该产品是华赛伯曼首款获批进入临床的产品。华赛伯曼具有独创的全自动化工艺生产平台PowerTexp®,是目前有报道的唯一一家实现TIL细胞培养全封闭自动化工艺的企业,凭借着强大的工艺优势,HS-IT101有着超过95%的培养成功率,为未来临床快速推进夯实基础。同时HS-IT101注射液还有着微量肿瘤组织即可满足生产需求,制备周期短,临床端低剂量白介素2用药等特点,大幅降低了临床试验的难度,目前已确定中国医学科学院肿瘤医院作为一期组长单位,李宁副院长作为牵头PI,完成了立项和伦理的审批,未来将快速启动一期临床试验。
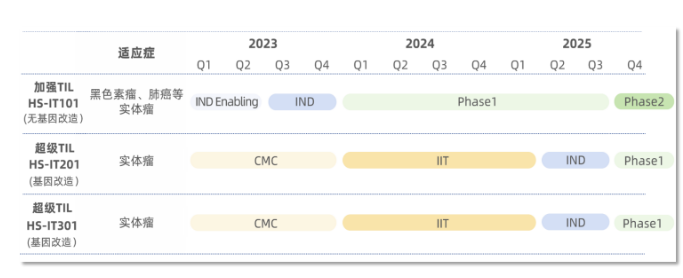
华赛伯曼致力于做全球创新性、领先性的抗实体肿瘤TIL细胞药物,企业经过四年多的发展,通过自主研发,搭建了PowerTexp®高效TIL生产工艺平台,TMExpT®肿瘤微环境调控表达平台,为第二代基因改造的超级TIL及通用T细胞产品提供强有力的研发支撑。目前公司的管线已经布局有自体天然加强TIL产品HS-IT101和基因改造超级TIL产品HS-IT201、HS-IT301。超级TIL产品将慢病毒技术和基因逻辑调控方法相结合,精准调控插入TIL中目的基因的表达,已经在体外及类器官中显现出良好的效果,也即将进入IIT临床研究。
华赛伯曼董事长高青表示:“HS-IT101的临床获批标志着华赛伯曼从早研阶段进入正式临床阶段,是企业发展的重要里程碑。未来公司将缜密规划,快速推动一期临床。
目前免疫治疗已经成为肿瘤治疗的重要手段,免疫治疗利用人体自身免疫系统来对抗肿瘤,具有良好的安全性和耐受性,PD-1/PD-L1抗体药物已经取得了巨大的成功,但众多肿瘤患者只有10%-30%左右能够获益;CAR-T在血液瘤领域取得成功,但针对实体瘤的异质性,靶点的设计面临挑战,因此实体瘤迫切需要寻找更安全、有效的疗法。TIL细胞疗法具有独特的优势,TIL来源于肿瘤组织,一部分TIL细胞被肿瘤细胞激活,能够有效识别肿瘤抗原,归巢能力强,天然多靶向,具有巨大的潜在治疗价值。
美国IOVANCE全球第一款TIL细胞药物预计将于明年上市,IOVANCE已经在美国、欧洲、加拿大布局厂房和产能,目前中国有多款TIL药物进入正式临床,TIL在实体肿瘤上的巨大临床潜力和商业价值逐渐得到更多的认可,临床实验中也得到不断印证。
华赛伯曼的HS-IT101是青岛市第一个肿瘤治疗领域的细胞基因(CGT)临床批件,也是山东省该领域的第一个。华赛伯曼从成立之初就立足于山东青岛,虽与上海、苏州、北京的禀赋资源有差距,但华赛伯曼在青岛市良好产业政策和各级政府的大力支持下,实现了从零到一的突破,未来将快速推动多条产品管线,实现从一到N的跨越。
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!

















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论