
11月16日,Vertex Pharmaceuticals和CRISPR Therapeutics共同宣布,Exagamglogene Autotemcel(Exa-cel)获英国药品监管机构MHRA有条件批准上市,用于治疗治疗镰状细胞病(SCD)和输血依赖性β-地中海贫血(TDT)。Exa-cel现更名为Casgevy™。
Casgevy药物基本信息

截图来源:药融云全球药物研发数据库
而美国,预计2023年12月8日批准该药SCD适应症,2024年3月30日批准TDT适应症。在欧洲,今年1月26日,欧洲药品管理局(EMA)也已受理exa-cel的上市申请。这意味着,exa-cel有望于今年在欧洲获批。
据悉,CASGEVY™是全球首款获批上市的CRISPR基因编辑药物。
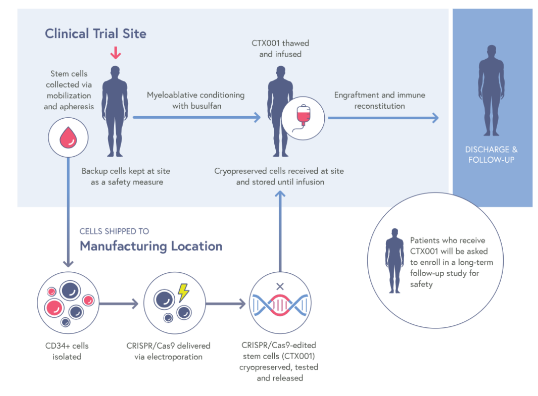
2015年,CRISPR和Vertex达成战略合作,专注于利用CRISPR/Cas9发现和开发针对人类疾病潜在遗传原因的潜在新治疗方法。exa-cel是该联合研究项目中第一个潜在治疗方法。根据协议,Vertex负责exa-cel的全球开发、制造和商业化,并与CRISPR在全球范围内以60/40的比例分割项目成本和利润。
exa-cel,原名CTX001™,是一种研究性、自体、体外CRISPR/Cas9基因编辑疗法,通过编辑患者自身的造血干细胞,使得患者血红细胞可以产生高水平的胎儿血红蛋白(HbF),以治疗输血依赖性β-地中海贫血(TDT)和镰状细胞病(SCD)。
试验结果表明,exa-cel不仅有可能让TDT患者摆脱长期输血的困扰,还可能缓解SCD患者镰状细胞危机和疼痛。
Vertex目前还没有确定Casgevy™在英国的定价。此前分析师预计Casgevy™上市后销售额为13亿美元,最高销售额或可达16亿美元(剔除风险因素)。
参考资料:
1.官方公告
2.药融云数据库
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!


















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论