2023年4月14日至19日,第114届美国癌症研究协会(AACR)年会在美国佛罗里达州奥兰多举行。AACR年会是规模最大的癌症研究会议之一,汇聚了全球肿瘤领域的科学家和临床医生,分享和探讨肿瘤预防、基础、转化和临床研究的最新进展。
一、SHR-A1811
01.SHR-A1811-101临床研究
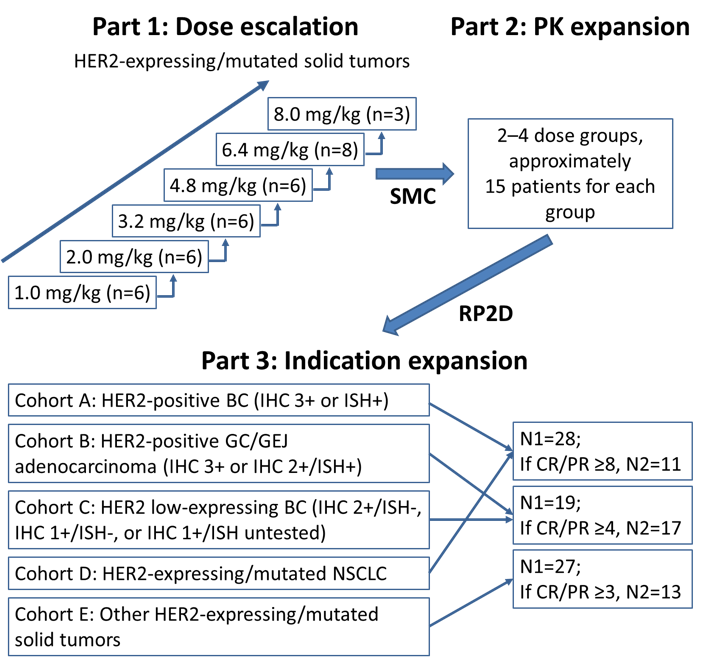
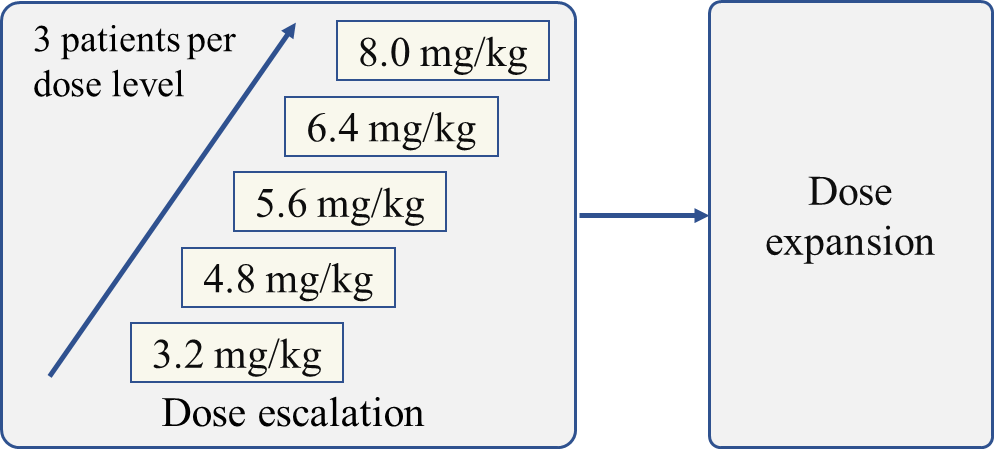
SHR-A1811-101是在HER2表达或突变晚期实体瘤中的国际多中心I期首次人体研究,旨在评估SHR-A1811的耐受性、安全性、药代动力学(PK)特征及免疫原性,并初步观察其抗肿瘤活性。研究分为剂量递增、PK拓展和疗效拓展三个阶段。
图 | 研究设计
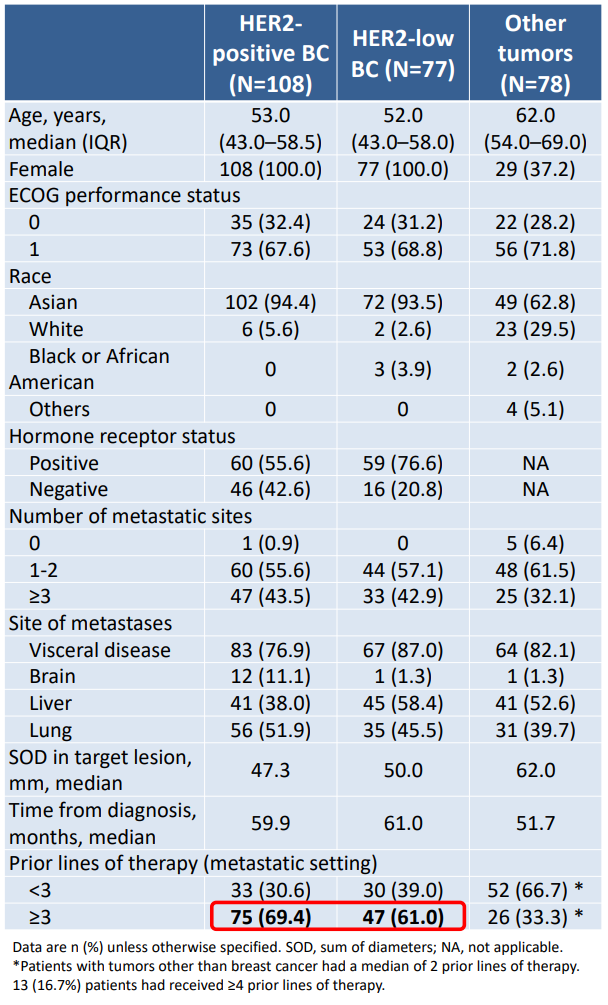
2020年9月7日至2022年11月29日,研究纳入了263例患者,包括HER2阳性乳腺癌(n=108)、HER2低表达乳腺癌(n=77)、以及HER2阳性胃/食管结合部腺癌、HER2表达或突变非小细胞肺癌(NSCLC)等其他实体瘤(n=78)。多数患者既往接受过3线及以上针对转移病灶的治疗。
表 | 基线资料
仅1例接受6.4mg/kg治疗的患者发生了剂量限制性毒性(DLT)。截至2022年11月30日,97.3%的患者发生了治疗相关不良事件(TRAE)。≥级TRAE、严重TRAE和治疗相关死亡事件的发生率分别为55.5%、13.7%和1.5%。间质性肺病的发生率仅为3.0%。
在3.2–8.0mg/kg的剂量范围内,SHR-A1811、抗体及有效载荷的暴露与剂量成正比。
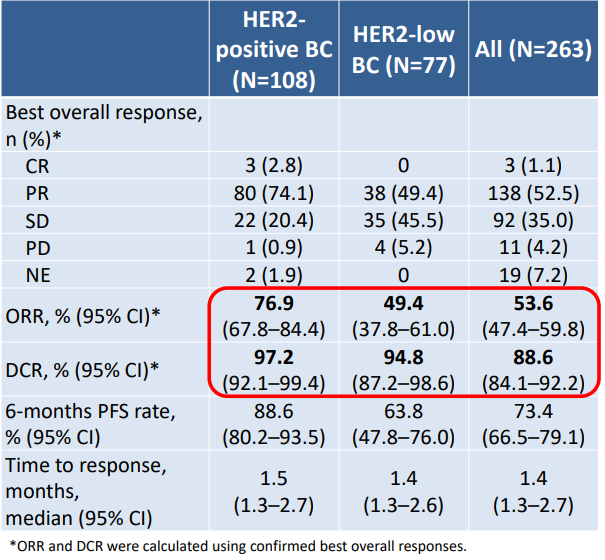
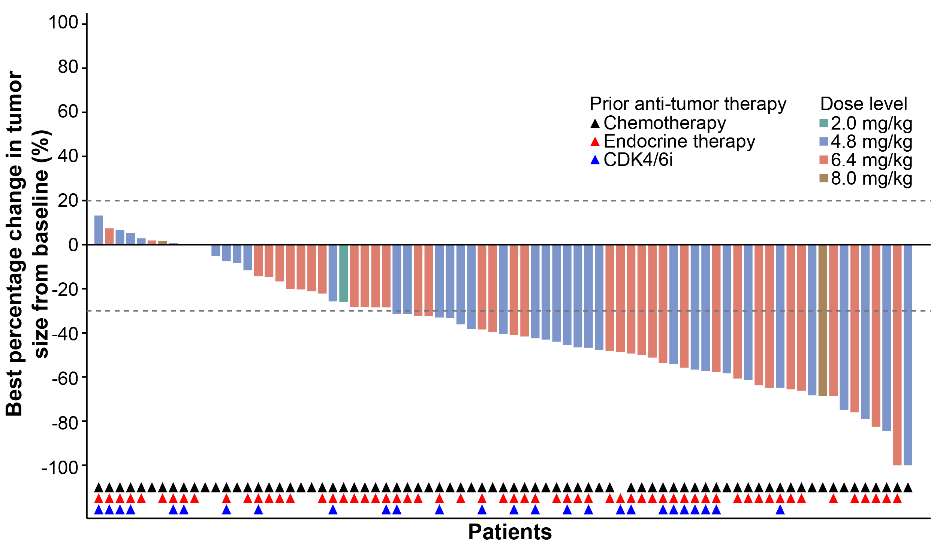
在有效性方面,多数患者经过SHR-A1811治疗后出现肿瘤缩小。在HER2阳性乳腺癌患者中,经确认的客观缓解率(ORR)达76.9%(95% CI 67.8–84.4),疾病控制率(DCR)为97.2%(95% CI 92.1–99.4),6个月的无进展生存(PFS)率为88.6%(95% CI 80.2–93.5)。在HER2低表达乳腺癌患者中,经确认的ORR为49.4%(95% CI 37.8–61.0),DCR为94.8%(95% CI 87.2–98.6),6个月的PFS率为63.8%(95% CI 47.8–76.0)。其他HER2表达或突变实体瘤的经确认的ORR为53.6%(95% CI 47.4–59.8),DCR为88.6%(95% CI 84.1–92.2),6个月的PFS率为73.4%(95% CI 66.5–79.1)。
表 | 有效性数据总结
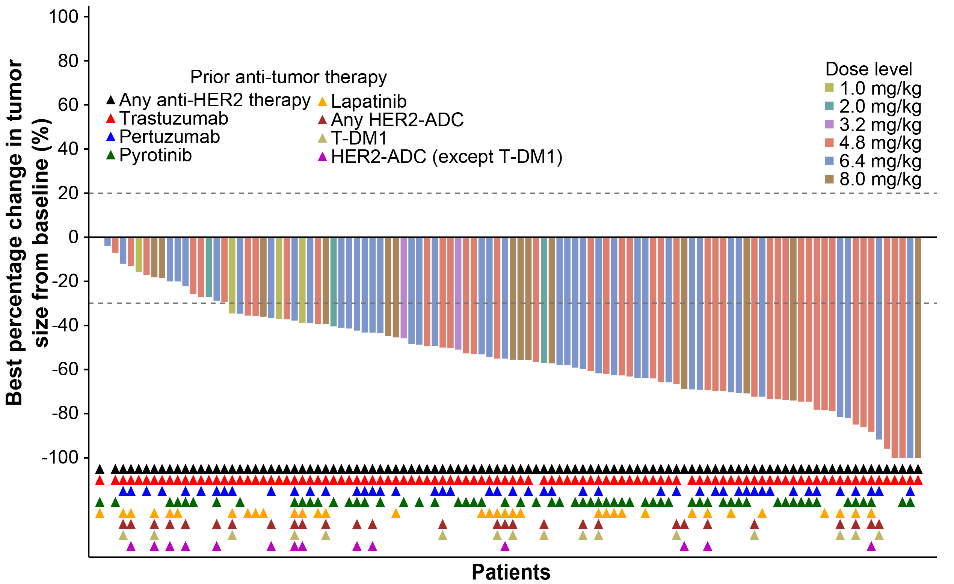
图 | HER2阳性乳腺癌队列的靶病灶相对基线最佳变化的瀑布图
图 | HER2低表达乳腺癌队列的靶病灶相对基线最佳变化的瀑布图
图 | 其他HER2表达或突变实体瘤的靶病灶相对基线最佳变化的瀑布图
02.SHR-A1811-103临床研究
SHR-A1811-103是在既往含铂化疗失败的HER2突变晚期NSCLC中的I/II期研究。本次报道的剂量爬坡和扩展I期阶段,旨在评估SHR-A1811的安全性、耐受性和PK特征,并初步探索其有效性。
图 | 研究设计
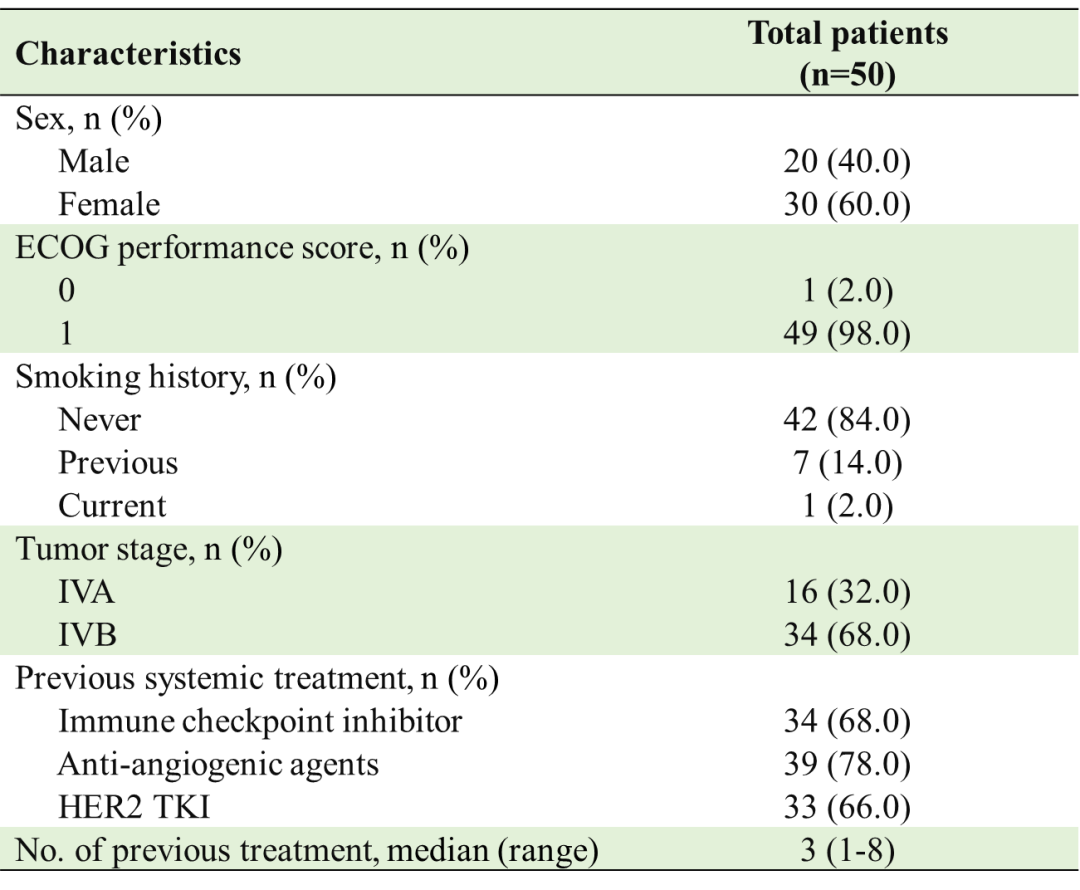
截至2022年11月8日,共50例患者入组。所有患者均处于IV期疾病状态。既往系统性治疗中位线数为3(范围1-8)。所有患者既往都接受过含铂化疗,33(66%)例患者接受过靶向HER2的酪氨酸激酶抑制剂(TKI)治疗,34(68%)例患者接受过免疫检查点抑制剂(ICI)治疗,39(78%)例患者接受过抗血管生成药物治疗。
表 | 基线数据
8.0mg/kg剂量组中有1例患者出现DLT。所有患者均发生TRAE。≥3级TRAE、严重TRAE和治疗相关死亡事件的发生率分别为42%、18%和2%。最常见的≥3级TRAE为中性粒细胞计数减少(30%)、白细胞计数减少(20%)、贫血(16%)和血小板减少(12%)。
在有效性方面,ORR为40.0%(95% CI 26.4–54.8),DCR为86.0%(95% CI 73.3–94.2),中位缓解持续时间(DoR)为8.3个月(95% CI 5.4–13.7),中位PFS达10.8个月(95% CI 6.7–15.0)。
图 | 靶病灶大小变化
(A)靶病灶相对基线变化的蜘蛛图;
(B)靶病灶相对基线最佳变化的瀑布图。
综上,SHR-A1811在既往经过治疗的HER2表达或突变晚期实体瘤中安全耐受,且表现出强效的抗肿瘤活性。SHR-A1811在针对HER2阳性复发或转移性乳腺癌、HER2低表达复发或转移性乳腺癌、以及既往含铂化疗失败的HER2突变NSCLC三项适应症已被国家药品监督管理局药品审评中心(CDE)纳入突破性疗法。
二、SHR-A1921
SHR-A1921-101临床研究
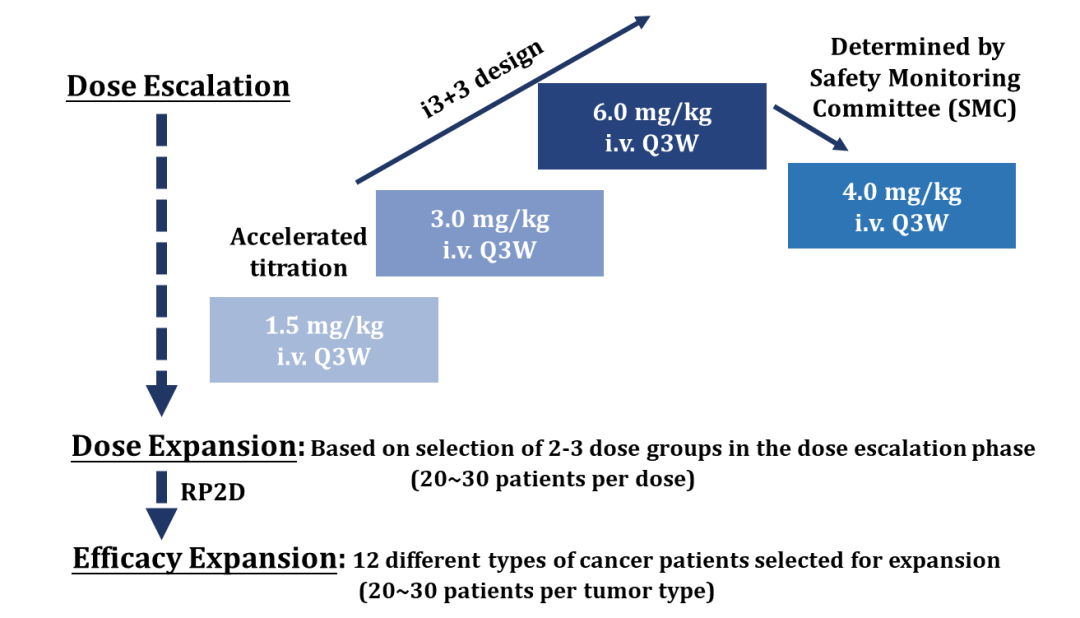
SHR-A1921-101是一项多中心、开放标签的I期首次人体研究,旨在评估SHR-A1921在晚期实体瘤患者中的安全性、耐受性、PK和抗肿瘤活性。研究分为剂量递增、剂量扩展和疗效拓展3个阶段。
图 | 研究设计
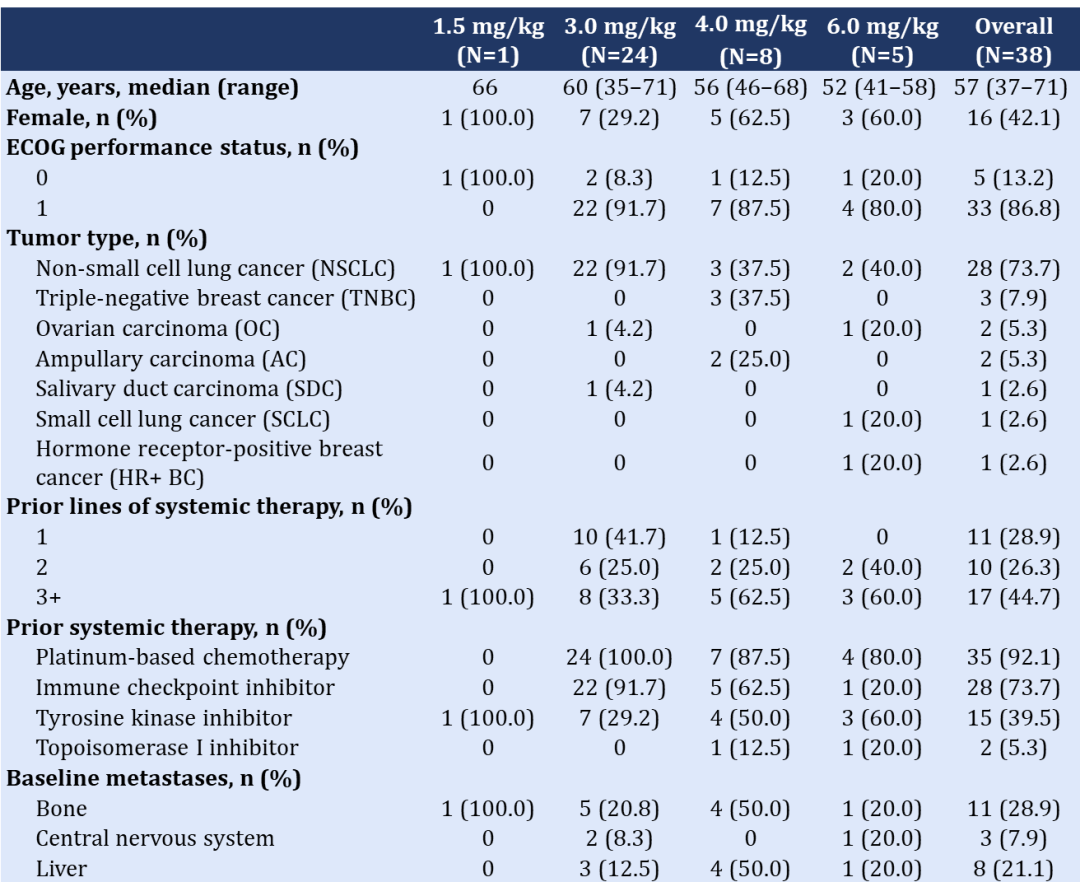
截至2022年10月21日,一共有38例标准治疗失败的晚期实体瘤患者入组。其中,18例患者在剂量递增阶段入组,20例在剂量扩展阶段入组。44.7%的患者既往接受过≥3线系统性抗肿瘤治疗。
表 | 基线资料
共有4例患者发生了DLT,均为3级口腔炎(6.0mg/kg,n=3;4.0mg/kg,n=1)。最大耐受剂量(MTD)为4.0mg/kg。
最常见的TRAE为恶心(71.1%)、口腔炎(65.8%)、贫血(42.1%)、呕吐、食欲下降、体重下降和皮疹(各为36.8%)。38例患者中,12(31.6%)例发生了≥3级TRAE,最常见的为口腔炎(18.4%)。无导致治疗终止的TRAE。
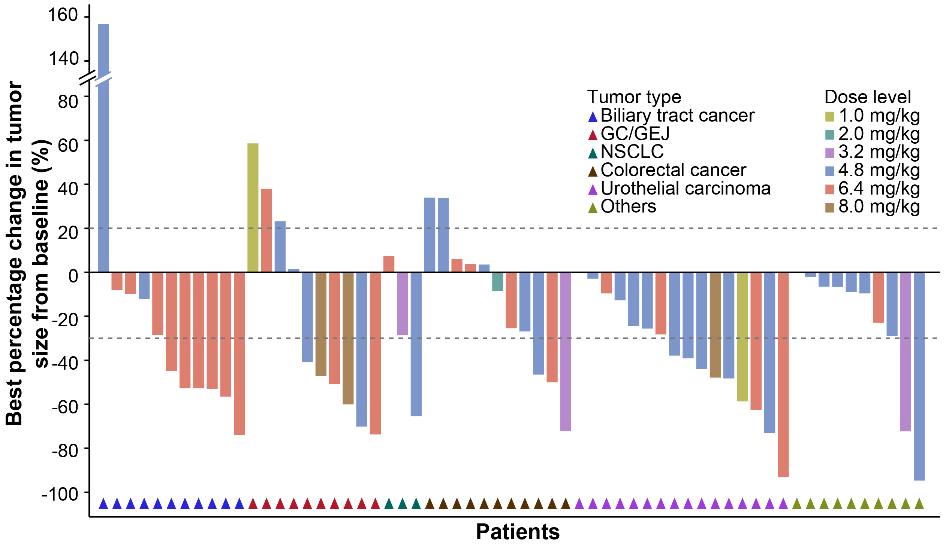
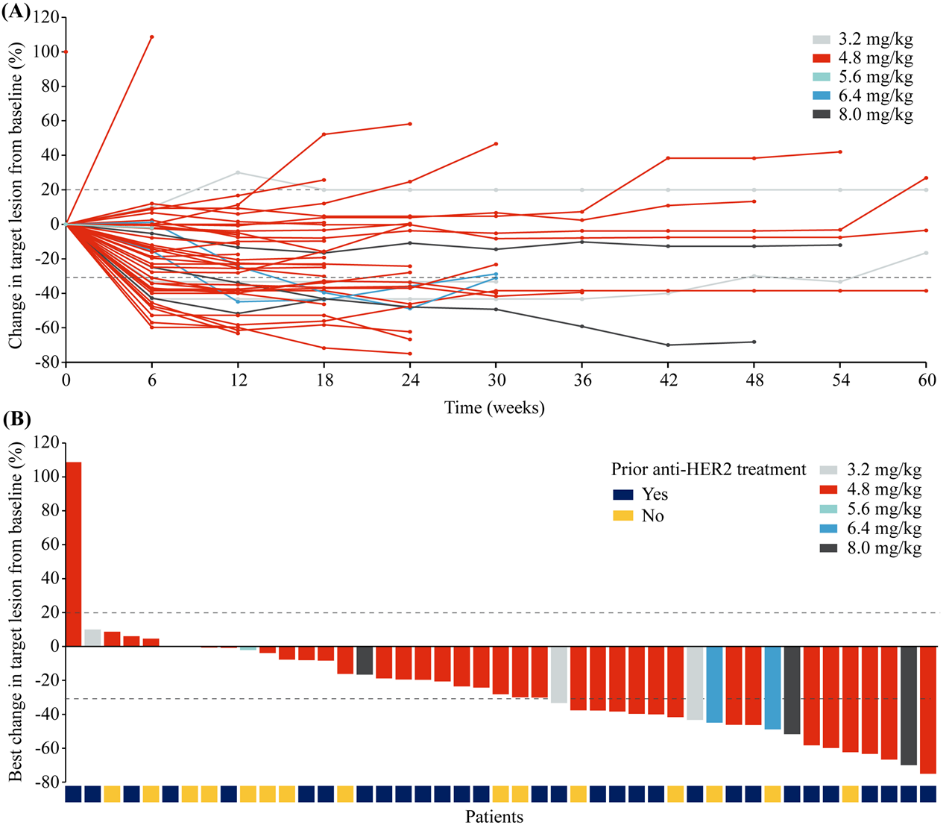
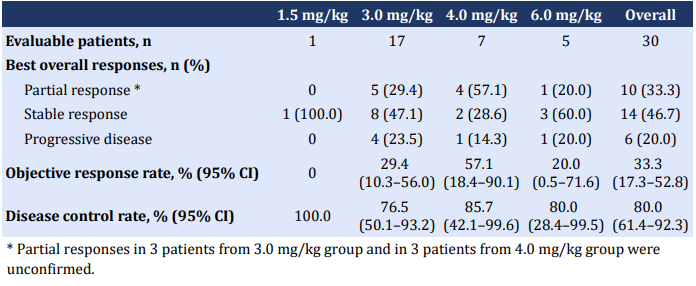
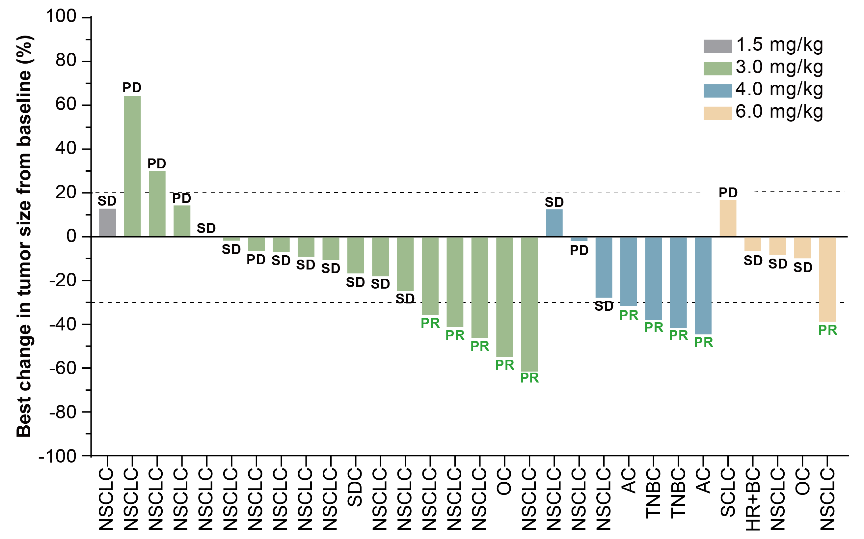
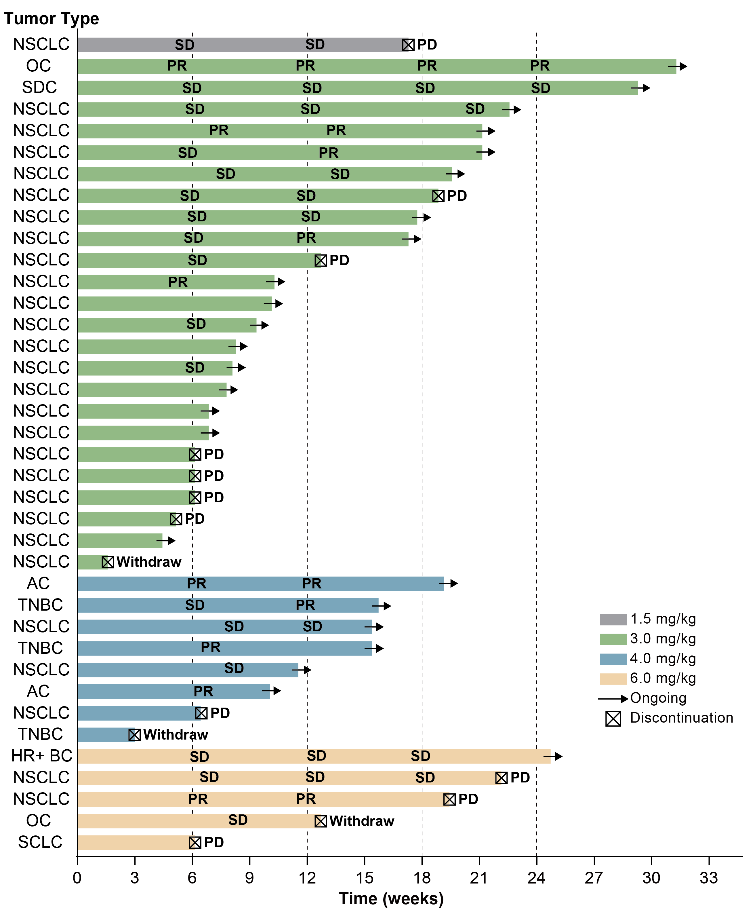
在有效性方面,10例患者获得部分缓解(PR),包括5例NSCLC,2例三阴性乳腺癌,2例壶腹癌和1例卵巢癌。可评估患者的ORR为33.3%(95% CI 17.3-52.8),DCR为80.0%(95% CI 61.4-92.3)。
表 | 有效性数据总结
图 | 靶病灶相对基线最佳变化的瀑布图
图 | 靶病灶相对基线变化的蜘蛛图
图 | 患者应答泳道图
综上,SHR-A1921在经治晚期实体瘤患者中的安全性可控,并具有良好的抗肿瘤活性。本研究仍在进行中,以进一步评估SHR-A1921在不同给药频率下以及在特定癌症类型中的有效性。
<END>
























收藏
登录后参与评论